MP Board Class 12th Chemistry Solutions Chapter 6 तत्त्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम
तत्त्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम NCERT पाठ्यनिहित प्रश्नोत्तर
प्रश्न 1.
सारणी 6.1 में दर्शाए गए अयस्कों में से किसका सान्द्रण चुम्बकीय पृथक्करण विधि द्वारा करते हैं ?
उत्तर
नोट-सारणी के लिए NCERT पाठ्य-पुस्तक देखें।
चुम्बकीय अयस्क को अचुम्बकीय अशुद्धियों से पृथक् चुम्बकीय पृथक्करण विधि द्वारा करते हैं। उदाहरण के लिए-मैग्नेटाइट को अचुम्बकीय सिलिका एवं अन्य अशुद्धियों से पृथक् इस विधि द्वारा करते हैं।
प्रश्न 2.
ऐल्युमिनियम के निष्कर्षण में प्रक्षालन का महत्व क्या है?
उत्तर
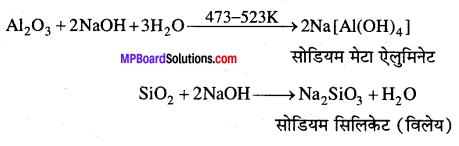
ऐल्युमिनियम का मुख्य अयस्क बॉक्साइट (Al2O3xH2O) है। इसमें अशुद्धियों के रूप में SiO2, FeO एवं टाइटेनियम ऑक्साइड (TiO2) होती है। इस अशुद्धियों को प्रक्षालन द्वारा पृथक् करते हैं। बॉक्साइट से शुद्ध एलुमिना बनाने में प्रक्षालन का महत्व है। बॉक्साइट चूर्ण को NaOH विलयन के साथ 473 – 523 K पर गर्म करते हैं । एलुमिना घुलकर सोडियम मेटा ऐलुमिनेट बनाता है, जबकि अशुद्धियाँ आयरन एवं टाइटेनियम शेष रह जाती है।
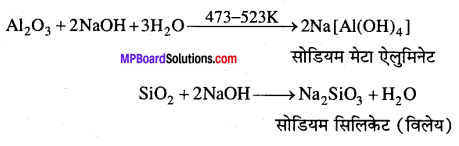
अशुद्धियों को छानकर अलग कर लेते हैं। छनित में CO2 प्रवाहित कर उदासीन करते हैं । ऐल्युमिनियम हाइड्रॉक्साइड को पृथक् कर लेते हैं, जबकि सोडियम सिलिकेट विलयन में शेष रह जाता है। ऐल्युमिनियम हाइड्रॉक्साइड को गर्म कर शुद्ध ऐलुमिना प्राप्त होता है।
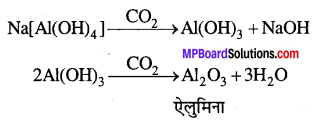
ऐलुमिना के वैद्युत-अपघटन से ऐल्युमिनियम प्राप्त होता है।
![]()
प्रश्न 3.
Cr2O3 + 2Al → Al2O3 +2Cr; (∆G° = -421kJ)
गिब्स ऊर्जा मान से स्पष्ट है कि उपरोक्त अभिक्रिया संभव है। यह कमरे के तापक्रम पर क्यों नहीं होती?
उत्तर
कमरे के ताप पर सभी अभिकारक एवं उत्पाद ठोस हैं। इसलिए कमरे के ताप पर अभिक्रिया नहीं होती। उच्च ताप पर अभि-कारक पिघलकर क्रिया करते हैं।
प्रश्न 4.
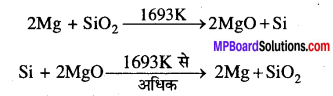
यह सत्य है कि कुछ विशिष्ट परिस्थितियों में, Mg, SiO2 को अपचयित करता है एवं Si, MgO को अपचयित करता है। ये उपरोक्त परिस्थितियाँ क्या हैं ?
उत्तर
मैग्नीशियम 1693 K पर अथवा कम पर SiO2 को अपचयित करते हैं । सिलिकॉन 1693 K के ऊपर Mgo को अपचयित करते हैं।
तत्त्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम NCERT पाठ्य-पुस्तक प्रश्नोत्तर
प्रश्न 1.
कॉपर का निष्कर्षण हाइड्रो धातुकर्म द्वारा किया जाता है, परन्तु जिंक का नहीं। व्याख्या कीजिए।
उत्तर
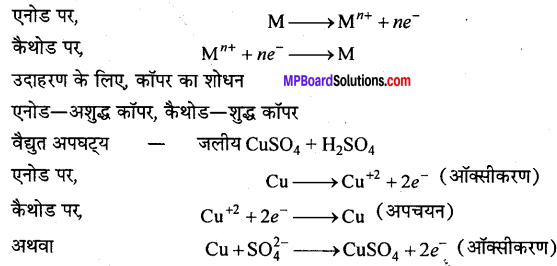
कॉपर तुलनात्मक कम क्रियाशील धातु है, इसका अपचयन विभव E° (Cu2+/Cu) उच्च है (+0.34V)। यह Cu2+ आयनों के विलयन से अधिक क्रियाशील धातुओं, जिनके E° मान कॉपर से कम होते हैं, द्वारा विस्थापित हो जाता है। उदाहरण के लिए, जिंक का E° (Zn2+/zn) – 0.76 है, जिंक कॉपर से Cu2+आयनों के विलयन से विस्थापित करता है। इसके विपरीत Zn2+ आयनों के विलयन से Zn को अधिक क्रियाशील धातु जैसे-Na, K, Mg, Ca आदि द्वारा विस्थापित किया जाता है। परन्तु ये अधिक क्रियाशील धातुएँ जल से क्रिया कर अपने आयनों को बनाकर हाइड्रोजन गैस निकालती हैं।
[2Na + 2H2O → 2NaOH + H2] इस प्रकार Zn2+ आयनों के विलयन से Zn को विस्थापित करना कठिन है। अत: कॉपर को हाइड्रोधातुकर्म द्वारा निष्कर्षित किया जाता है, जिंक को नहीं।
प्रश्न 2.
फेन प्लवन विधि में अवनमक (Depressant) की क्या भूमिका है?
उत्तर
दो सल्फाइड अयस्कों को पृथक् करने के लिए फेन प्लवन विधि में अवनमक (Depressant) का उपयोग किया जाता है। इसके लिए जल में तेल का भाग समायोजित करते हैं। यदि अयस्क में ZnS एवं Pbs है, तो अवसाद या अवनमक के रूप में NaCN का उपयोग करते हैं। NaCN, Pbs को झाग के रूप में ऊपर आने देता है, जबकि ZnS को झाग की बनी परत जिंक संकुल Na2[Zn(CN)6] के रूंप में रोकता है।
प्रश्न 3.
अपचयन द्वारा ऑक्साइड अयस्कों की अपेक्षा पाइराइट से ताँबे का निष्कर्षण अधिक कठिन है ?
उत्तर
H2S एवं CS2 से Cu2S की निर्माण की मानक मुक्त ऊर्जा (ΔfG°) अधिक ऋणात्मक है। उसी प्रकार Cu2S को कार्बन या H2 द्वारा अपचयित नहीं किया जा सकता। निम्न दो अभिक्रिया समान नहीं होतीं। इन अभिक्रियाओं की ΔrG° धनात्मक है।
Cu2S + H2 → 2Cu + H2S
2Cu2S + C → 4Cu + CS2
इसके विपरीत Cu2O की ΔfG°, CO से कम ऋणात्मक है एवं कार्बन सरलता से Cu2O को Cu में अपचयित करता है।
Cu2O(s) +Cs → 2Cu + CO(g)
इस कारण से पाइराइट अयस्क से कॉपर का निष्कर्षण, इसके ऑक्साइड से कठिन है।
प्रश्न 4.
व्याख्या कीजिए –
(i) मंडल परिष्करण (Zone refining)
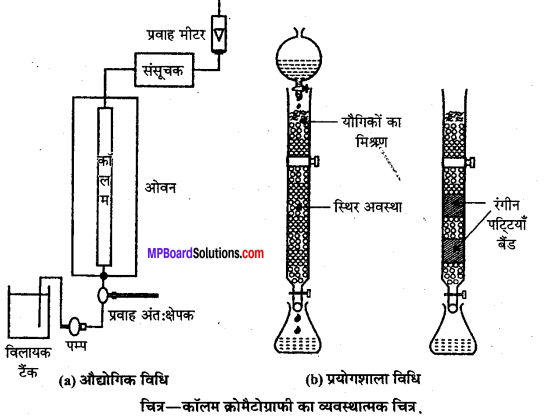
(ii) स्तंभ वर्णलेखिकी (Column chromatography)।
उत्तर
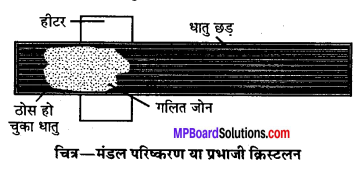
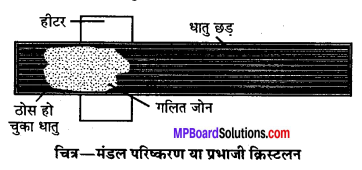
(i) मंडल परिष्करण या प्रभाजी क्रिस्टलीकरण (Zone refining or Fractional crystallisation) विशिष्ट उपयोगों हेतु शुद्धतम धातु प्राप्त करने हेतु इस विधि का उपयोग किया जाता है। उदाहरण के लिये, अर्द्धचालक (Semiconductors) के रूप में उपयोग के लिये सिलिकॉन व जर्मेनियम को इसी विधि द्वारा प्राप्त किया जाता है। यह विधि इस तथ्य पर आधारित है कि अशुद्ध धातु के ठोस अवस्था की तुलना में द्रव में अधिक विलेय होती हैं तथा अशुद्धियाँ होने पर उसका गलनांक शुद्ध धातु से कम होता है।
इस विधि में अशुद्ध धातु के छड़ के एक सिरे में गोलाकार चलित हीटर फिट कर दिया जाता है। हीटर को छड़ में धीरे-धीरे विस्थापित किया जाता है। हीटर के आसपास धातु पिघलती है। जैसे-जैसे हीटर आगे बढता है शुद्ध धातु क्रिस्टलीकृत होता जाता है तथा अशुद्धियाँ पिघले क्षेत्र में चली जाती हैं । यह प्रक्रिया तब तक दोहरायी जाती है जब तक पूरी अशुद्धियाँ छड़ के एक सिरे पर नहीं आ जाती जिसे बाद में अलग कर दिया जाता है। यह विधि प्रभाजी क्रिस्टलीकरण (Fractional crystallisation) भी कहलाती है।
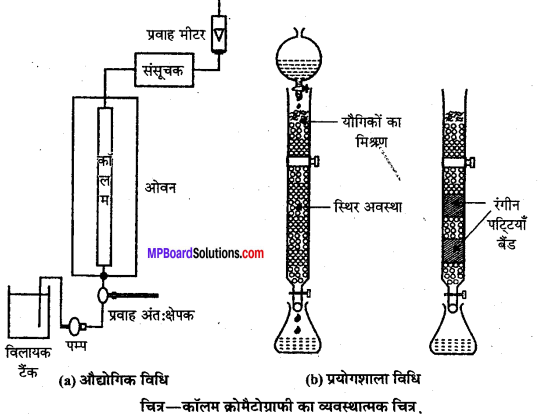
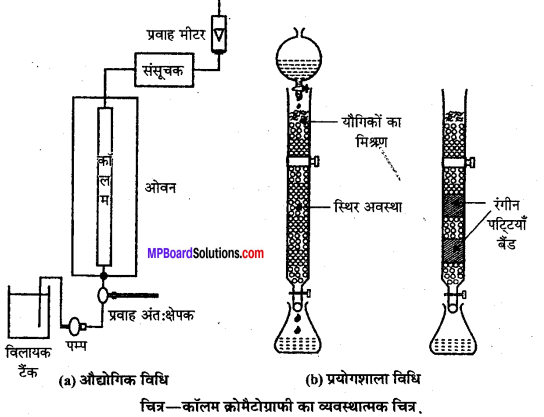
(ii) स्तम्भ वर्णप्रक्रम या अधिशोषण स्तम्भ वर्णप्रक्रम (Column chromatography or Adsorption column chromatography)- यह विधि काँच नली में बंद (Packed) अधिशोषक के स्तम्भ पर मिश्रण के पृथक्करण से संबंधित है। स्तम्भ के निचले सिरे पर स्टॉप कॉक (Stop cock) लगा होता है। अधिशोषक पर अधिशोषित होने वाले मिश्रण को अधिशोषक स्तम्भ के ऊपर रखा जाता है। अब एक अन्य द्रव मिश्रण, जो वाहक (Eluant) का कार्य करता है, स्तम्भ में नीचे की ओर बहने दिया जाता है। यह वाहक मिश्रण अपने साथ धीरे-धीरे पूर्व अधिशोषित पदार्थों को बहाकर ले जाता है। मिश्रण के विभिन्न अवयव स्तम्भ के विभिन्न भागों में अधिशोषित हो जाते हैं।
वह अवयव जो अधिक प्रबलता से अधिशोषित होता है, स्तम्भ के ऊपरी भाग में रहता है और पट्टी बनाता है। अधिशोषित यौगिकों को विभिन्न घोलकों में घुलाकर एक-एक करके पृथक् कर लिया जाता है। इस प्रक्रिया को निक्षालन (Elution) कहते हैं। निक्षालन की क्रिया के लिए प्रायः जल, ऐल्कोहॉल, ऐसीटोन, पेट्रोलियम, ईथर आदि घोलकों का उपयोग होता है। अधिशोषक के रूप में प्राय: एलुमिना, मैग्नीशियम
ऑक्साइड, सिलिका जेल, कैल्सियम कार्बोनेट आदि का व्यवहार होता है। इस विधि में साधारणतः एक भाग यौगिक के लिए चालीस भाग अधिशोषक प्रयुक्त होता है।
कभी-कभी नली से अधिशोषित स्तम्भ को बाहर निकालकर प्रत्येक रंगीन बैण्ड को काट लिया जाता है। इन रंगीन बैण्डों से अधिशोषित यौगिकों को घोलक द्वारा निष्कर्षित (Extract) कर रवाकरण की क्रिया द्वारा शुद्ध अवयव प्राप्त किये जाते हैं।
इस विधि द्वारा किसी मिश्रण से रंगहीन (Colourless) अवयवों का पृथक्करण तभी संभव है जब वे पराबैंगनी प्रकाश (Ultra-violet light) में विभिन्न प्रतिदीप्त (Fluorescence) प्रदर्शित करते हों। यदि वे प्रतिदीप्ति प्रदर्शित नहीं करते तो अधिशोषक को ही प्रतिदीप्तिशील पदार्थ (Fluorescent material) में डुबोया जाता है। मिश्रण के विभिन्न अवयवों को अधिशोषित करने वाले क्षेत्र पराबैंगनी प्रकाश में गहरे रंग (Dark colour) के दिखाई पड़ने लगते हैं जिससे अवयवों के पृथक्करण में सुविधा होती है। प्रयोग शीशे की नली की जगह क्वार्ट्स (Quartz) की नली में किया जाता है।
![]()
प्रश्न 5.
673 K ताप पर C तथा CO में से कौन-सा अच्छा अपचायक है ?
उत्तर
जब कार्बन, डाइऑक्सीजन से क्रिया करता है, दो अभिक्रियाएँ संभावित हैं।
C(s) + O2(g) → CO2(g) …………..(i)
2C(s) + O2(g) → 2CO(g) …………..(ii)
यदि CO अपचायक अभिकर्मक के रूप में उपयोग होती है, तब यह CO2 में ऑक्सीकृत होती है।
2CO + O2 → 2CO2…………..(iii)
एलिन्गम आरेख से स्पष्ट है कि 673 K पर CO से CO2 में ऑक्सीकरण पर ΔG° अभिक्रिया (i) एवं अभिक्रिया (ii) से अधिक ऋणात्मक है। इस प्रकार C से CO अच्छा अपचायक अभिकर्मक है। इस बात की पुष्टि अभिक्रिया (iii) का ग्राफ 673 K पर अभिक्रिया (i) एवं (ii) से नीचे है, से होती है। एलिन्गम आरेख में जो तत्व नीचे हैं, अन्य धातुओं के ऑक्साइड इससे ऊपर होते हैं।
प्रश्न 6.
कॉपर के वैद्युत अपघटन शोधन में ऐनोड पंक (Anode mud) में उपस्थित सामान्य तत्वों के नाम दीजिए। वे कहाँ कैसे उपस्थित होते है ?
उत्तर
ऐनोड पंक में उपस्थित सामान्य तत्वों Ag, Au, Pt, Sb, Se आदि हैं। ये तत्व कम क्रियाशील होते हैं एवं CuSO4 एवं H2SO4 विलयन से अप्रभावित रहते हैं, एवं इस प्रकार ये ऐनोड के नीचे ऐनोड पंक (Anode mud) के रूप में बैठ जाते हैं।
प्रश्न 7.
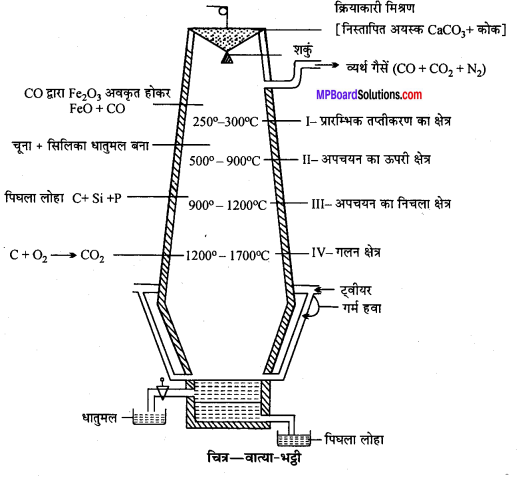
आयरन (लोहे) के निष्कर्षण के दौरान वात्या भट्टी के विभिन्न क्षेत्रों में होने वाली रासायनिक अभिक्रियाओं को लिखिए।
उत्तर
वात्या-भट्ठी में होने वाली क्रियाएँ –
(i) कोक वायु की उपस्थिति में जलकर CO2 बनाता है, जो कोक की अधिक मात्रा से रासायनिक संयोग करके CO बनाता है।
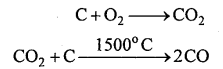
(ii) CO ऊपर की ओर उठकर 600°C पर हेमेटाइट अयस्क (Fe2O3) को फेरस ऑक्साइड (FeO) में अपचयित कर देता है।
![]()
(iii) लगभग 750°C पर CO द्वारा FeO को आयरन (Fe) में अपचयित कर देता है।
FeO + CO —> Fe+ CO2
इस प्रकार प्राप्त लोहे को स्पंजी आयरन कहते हैं। स्पंजी लोहा नीचे जाते-जाते ताप बढ़ने के कारण पिघल जाता है तथा अपने में कुछ C, S, Mn को घोल लेता है।
(iv) चूना पत्थर 1100°C ताप पर CaO और CO2 में अपघटित हो जाता है।
![]()
(v) CaO अयस्क उपस्थित सिलिका (SiO2) से क्रिया करके धातुमल (Slag) बना लेता है।
![]()
ये धातुमल पिघले लोहे के ऊपर तैरता रहता है, जिसे ऊपरी छिद्र से बाहर निकाल लेते हैं। वात्या-भट्ठी का नामांकित रेखाचित्र –
![]()
प्रश्न 8.
जिंक ब्लैण्ड से जिंक के निष्कर्षण में होने वाली रासायनिक अभिक्रियाओं को लिखिए।
उत्तर
जस्ते के अयस्क – (i) जिंक ब्लैण्ड ZnS, (ii) कैलामाइन ZnCO3, (iii) विलैमाइट ZnSiO4.
धातु निष्कर्षण की आधुनिक विधि-जिंक ब्लैण्ड तथा कैलामाइन अयस्कों से प्रायः धातु का निष्कर्षण किया जाता है।
1. सान्द्रण-जिंक ब्लैण्ड अयस्क का सान्द्रण झाग उत्प्लावन विधि से करते हैं।
2. भर्जन-सान्द्रित अयस्क को वायु की अधिकता में भर्जित करने से अयस्क ZnO में परिवर्तित हो जाता है। कुछ ZnS, ZnSO4 में परिवर्तित होते हैं, जो ZnO में अपघटित हो जाता है।
2ZnS + 3O2 → 2ZnO + 2SO2(g)
ZnS + 2O2 → ZnSO4
2ZnSo4 → 2ZnO + 2SO2(g) + O2(g)
कैलामाइन अयस्क केवल निस्तापन से ही ZnO बनाता है।
ZnCO3 → ZnO + CO2(g)
3. अपचयन- भर्जित या निस्तापित अयस्क को कोक से साथ ऊर्ध्वाधर रिटॉर्ट में रखकर प्रोड्यूसर गैस द्वारा 140°C तक गर्म किया जाता है, जिससे ZnO का Zn में अपचयन हो जाता है। प्राप्त Zn वाष्प को संघनित्र में एकत्रित करते हैं। इस प्रकार प्राप्त Zn को स्पेल्टर कहते हैं। इसमें Pb, As, Fe, Si, Cd और C की अशुद्धियाँ होती हैं और शेष 97.8% Zn होता है।
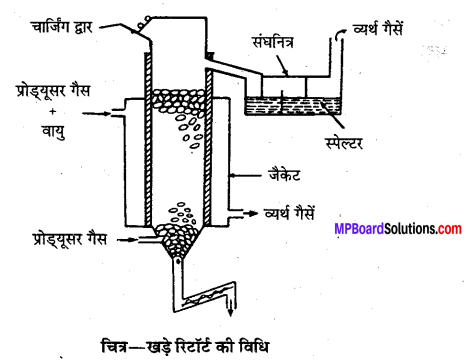
4. शोधन-अतिशुद्ध Zn विद्युत्-अपघटनी विधि द्वारा प्राप्त किया जाता है। इसमें अम्लीय ZnSO4 विलयन विद्युत्-अपघटन का कार्य करता है। प्राप्त अशुद्ध Zn ऐनोड तथा शुद्ध Zn छड़ कैथोड का कार्य करता है। विद्युत् धारा प्रवाहित करने पर शुद्ध Zn कैथोड पर एकत्रित होता है। यह लगभग 99.98% शुद्ध होता है।
प्रश्न 9.
कॉपर के धातुकर्म में सिलिका की भूमिका समझाइए।
उत्तर
सिलिका अम्लीय गालक के रूप में प्रयुक्त होता है, जो आयरन ऑक्साइड की क्षारीय अशुद्धि को हटाता है।

प्रश्न 10.
‘वर्णलेखिकी’ पद का क्या अर्थ है ?
उत्तर
पृथक्करण एवं शोधन के लिए वर्णलेखिकी एक तकनीक है, जो धातु एवं इसकी अशुद्धियों की उपयुक्त अधिशोषक द्वारा अधिशोषण क्षमताओं में अंतर पर आधारित है। यह इस सिद्धांत पर आधारित है, कि मिश्रण के विभिन्न यौगिक अधिशोषक द्वारा भिन्न-भिन्न अधिशोषित होता है। यह पद मुलतः ग्रीक शब्द ‘क्रोमा’ का अर्थ रंग एवं ग्राफी लिखते हैं, इस आधार पर इस विधि का नाम क्रोमेटोग्राफी रखा गया, जिसका अर्थ होता है, वर्णलेखन (Colour writing) जिसका सर्वप्रथम उपयोग पौधों के रंगीन वर्णकों के लिए किया गया।
प्रश्न 11.
वर्णलेखिकी में स्थिर प्रावस्था के चयन में क्या मापदंड अपनाए जाते हैं ?
उत्तर
अचल या स्थिर (Stationary phase) प्रावस्था का चयन इस प्रकार करते हैं कि जिन तत्वों का शोधन करना होता है, उनकी तुलना में अशुद्धियों को अधिक शक्ति से अधिशोषित करें। इन परिस्थितियों में, अशुद्धियाँ अचल या स्थिर प्रावस्था द्वारा रोक ली जाती हैं, जिसका अर्थ है, इन्हें सरलता से हटाया नहीं जा सकता, जबकि शुद्ध अवयव दुर्बल अधि-शोषित होते हैं, अतः सरलता से हटाए जा सकते हैं।
प्रश्न 12.
निकिल शोधन की विधि समझाइए।
उत्तर
(i) मंडल परिष्करण (Zone refining)- मंडल परिष्करण या प्रभाजी क्रिस्टलीकरण (Zone refining or Fractional crystallisation) विशिष्ट उपयोगों हेतु शुद्धतम धातु प्राप्त करने हेतु इस विधि का उपयोग किया जाता है। उदाहरण के लिये, अर्द्धचालक (Semiconductors) के रूप में उपयोग के लिये सिलिकॉन व जर्मेनियम को इसी विधि द्वारा प्राप्त किया जाता है। यह विधि इस तथ्य पर आधारित है कि अशुद्ध धातु के ठोस अवस्था की तुलना में द्रव में अधिक विलेय होती हैं तथा अशुद्धियाँ होने पर उसका गलनांक शुद्ध धातु से कम होता है।
इस विधि में अशुद्ध धातु के छड़ के एक सिरे में गोलाकार चलित हीटर फिट कर दिया जाता है। हीटर को छड़ में धीरे-धीरे विस्थापित किया जाता है। हीटर के आसपास धातु पिघलती है। जैसे-जैसे हीटर आगे बढता है शुद्ध धातु क्रिस्टलीकृत होता जाता है तथा अशुद्धियाँ पिघले क्षेत्र में चली जाती हैं । यह प्रक्रिया तब तक दोहरायी जाती है जब तक पूरी अशुद्धियाँ छड़ के एक सिरे पर नहीं आ जाती जिसे बाद में अलग कर दिया जाता है। यह विधि प्रभाजी क्रिस्टलीकरण (Fractional crystallisation) भी कहलाती है।
(ii) स्तम्भ वर्णप्रक्रम या अधिशोषण स्तम्भ वर्णप्रक्रम (Column chromatography or Adsorption column chromatography)- यह विधि काँच नली में बंद (Packed) अधिशोषक के स्तम्भ पर मिश्रण के पृथक्करण से संबंधित है। स्तम्भ के निचले सिरे पर स्टॉप कॉक (Stop cock) लगा होता है। अधिशोषक पर अधिशोषित होने वाले मिश्रण को अधिशोषक स्तम्भ के ऊपर रखा जाता है। अब एक अन्य द्रव मिश्रण, जो वाहक (Eluant) का कार्य करता है, स्तम्भ में नीचे की ओर बहने दिया जाता है। यह वाहक मिश्रण अपने साथ धीरे-धीरे पूर्व अधिशोषित पदार्थों को बहाकर ले जाता है। मिश्रण के विभिन्न अवयव स्तम्भ के विभिन्न भागों में अधिशोषित हो जाते हैं।
वह अवयव जो अधिक प्रबलता से अधिशोषित होता है, स्तम्भ के ऊपरी भाग में रहता है और पट्टी बनाता है। अधिशोषित यौगिकों को विभिन्न घोलकों में घुलाकर एक-एक करके पृथक् कर लिया जाता है। इस प्रक्रिया को निक्षालन (Elution) कहते हैं। निक्षालन की क्रिया के लिए प्रायः जल, ऐल्कोहॉल, ऐसीटोन, पेट्रोलियम, ईथर आदि घोलकों का उपयोग होता है। अधिशोषक के रूप में प्राय: एलुमिना, मैग्नीशियम
ऑक्साइड, सिलिका जेल, कैल्सियम कार्बोनेट आदि का व्यवहार होता है। इस विधि में साधारणतः एक भाग यौगिक के लिए चालीस भाग अधिशोषक प्रयुक्त होता है।
कभी-कभी नली से अधिशोषित स्तम्भ को बाहर निकालकर प्रत्येक रंगीन बैण्ड को काट लिया जाता है। इन रंगीन बैण्डों से अधिशोषित यौगिकों को घोलक द्वारा निष्कर्षित (Extract) कर रवाकरण की क्रिया द्वारा शुद्ध अवयव प्राप्त किये जाते हैं।
इस विधि द्वारा किसी मिश्रण से रंगहीन (Colourless) अवयवों का पृथक्करण तभी संभव है जब वे पराबैंगनी प्रकाश (Ultra-violet light) में विभिन्न प्रतिदीप्त (Fluorescence) प्रदर्शित करते हों। यदि वे प्रतिदीप्ति प्रदर्शित नहीं करते तो अधिशोषक को ही प्रतिदीप्तिशील पदार्थ (Fluorescent material) में डुबोया जाता है। मिश्रण के विभिन्न अवयवों को अधिशोषित करने वाले क्षेत्र पराबैंगनी प्रकाश में गहरे रंग (Dark colour) के दिखाई पड़ने लगते हैं जिससे अवयवों के पृथक्करण में सुविधा होती है। प्रयोग शीशे की नली की जगह क्वार्ट्स (Quartz) की नली में किया जाता है।
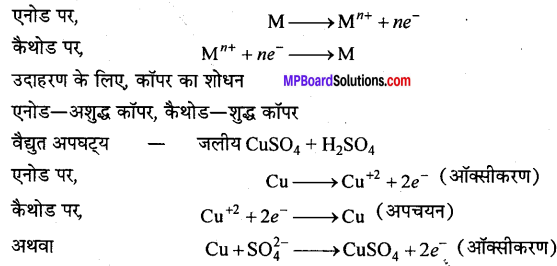
(ii) वैद्युत अपघटन परिष्करण (Electrolytic refining) धातुएँ अपने लवण के विलयन का विद्युत्अपघटन करने पर कैथोड पर जमा होती है। एक से अधिक धातुएँ रहने पर अपनी विद्युत् धनात्मक प्रवृत्ति के क्रम पर या बढ़ते ऑक्सीकरण विभव के क्रम में मुक्त होकर कैथोड पर जमा होती हैं । इस विधि में एक उपयुक्त विद्युत्-अपघट्य का चुनाव करके उसे विद्युत्-अपघटन सेल में ले लिया जाता है। शुद्ध धातु को कैथोड बनाकर विद्युत्-अपघटन सेल में लगाया जाता है। अशुद्ध धातु जिसका कि शोधन किया जाना है उसका एक मोटा एनोड बनाया जाता है। विद्युत्-अपघटन सेल में उपयुक्त विभव में जब विद्युत् प्रवाहित की जाती है तो एनोड से शुद्ध धातु विलयन में घुलेती है तथा विलयन से शुद्ध धातु, कैथोड के ऊपर लगातार संग्रहित होता रहता है। इस प्रकार विद्युत्-अपघटन की क्रिया में एनोड निरन्तर पतला होता चला जाता है तथा कैथोड लगातार मोटा होता जाता है। अशुद्धियाँ, एनोड पंक (Anode mud) के रूप में एनोड के नीचे जमा होती है। समय-समय पर आवश्यकतानुसार इलेक्ट्रोड परिवर्तित कर लिये जाते हैं।
(iii) वाष्प प्रावस्था परिष्करण (Vapour-phase refining)- कच्ची धातु को विशिष्ट अभिकर्मक के साथ गर्म करने पर निम्न ताप पर वाष्पशील यौगिक प्राप्त होता है। इस वाष्पशील यौगिक को उच्च तापक्रम पर गर्म करने से विघटित होकर धातु देता है। इस विधि द्वारा Ni, Ti, Zr आदि का शोधन किया जाता है।
(a) माण्ड प्रक्रम (Mond process)- इस विधि का उपयोग निकिल जैसी धातुओं के शोधन में किया जाता है जो कि वाष्पशील कार्बोनिल यौगिक बनाती है। ये धातु के कार्बोनिल यौगिक उच्च ताप पर विघटित हो जाते हैं तथा कार्बन मोनोऑक्साइड गैस मुक्त करती हैं व शुद्ध धातु शेष रह जाती है।

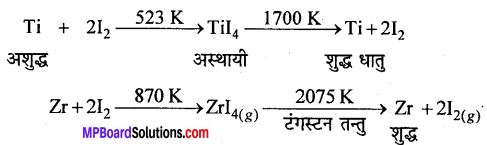
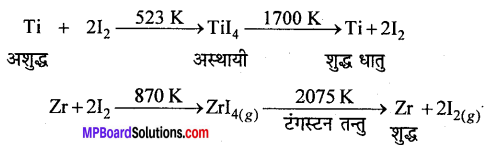
(b) वान-अर्केल विधि (Van-Arkel method)-जिर्कोनियम व टाइटेनियम जैसी धातुओं को अतिशुद्ध रूप में प्राप्त करने हेतु इस विधि का उपयोग किया जाता है। इस विधि में अशुद्ध धातु को वाष्पशील अस्थायी यौगिक (मुख्यतः धात्विक आयोडाइड) में परिवर्तित किया जाता है, जो गर्म करने पर विघटित होकर शुद्ध धातु प्रदान करते हैं। जैसे –
![]()
प्रश्न 13.
सिलिका युक्त बॉक्साइट अयस्क में से सिलिका को ऐलुमिना से कैसे अलग करते है ? यदि कोई समीकरण हो तो दीजिए।
उत्तर-
ऐल्युमिनियम का मुख्य अयस्क बॉक्साइट (Al2O3xH2O) है। इसमें अशुद्धियों के रूप में SiO2, FeO एवं टाइटेनियम ऑक्साइड (TiO2) होती है। इस अशुद्धियों को प्रक्षालन द्वारा पृथक् करते हैं। बॉक्साइट से शुद्ध एलुमिना बनाने में प्रक्षालन का महत्व है। बॉक्साइट चूर्ण को NaOH विलयन के साथ 473 – 523 K पर गर्म करते हैं । एलुमिना घुलकर सोडियम मेटा ऐलुमिनेट बनाता है, जबकि अशुद्धियाँ आयरन एवं टाइटेनियम शेष रह जाती है।
अशुद्धियों को छानकर अलग कर लेते हैं। छनित में CO2 प्रवाहित कर उदासीन करते हैं । ऐल्युमिनियम हाइड्रॉक्साइड को पृथक् कर लेते हैं, जबकि सोडियम सिलिकेट विलयन में शेष रह जाता है। ऐल्युमिनियम हाइड्रॉक्साइड को गर्म कर शुद्ध ऐलुमिना प्राप्त होता है।
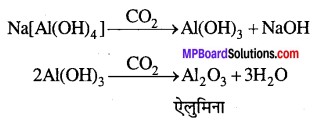
ऐलुमिना के वैद्युत-अपघटन से ऐल्युमिनियम प्राप्त होता है।
प्रश्न 14.
उदाहरण देते हुए भर्जन एवं निस्तापन में अन्तर बताइए।
उत्तर
भर्जन एवं निस्तापन में अन्तर –

प्रश्न 15.
ढलवाँ लोहा कच्चे लोहे से किस प्रकार भिन्न होता है ?
उत्तर
वात्या भट्टी से प्राप्त लोहे को कच्चा लोहा (Pig iron) कहते हैं। इसमें लगभग 4% कार्बन एवं अन्य अशुद्धियाँ S, P. Si, Mn आदि होती है। इस कच्चे लोहे दो स्क्रेप आयरन एवं कोक में मिलाकर गर्म वायु के झोकों से गर्म करते हैं, कुछ अशुद्धियाँ दूर हो जाती हैं, तब ढलवाँ लोहा (Cast iron) प्राप्त होता है। इसमें 3% कार्बन एवं कुछ अन्य अशुद्धियाँ होती है। यह कठोर एवं भंगुर होता है।
प्रश्न 16.
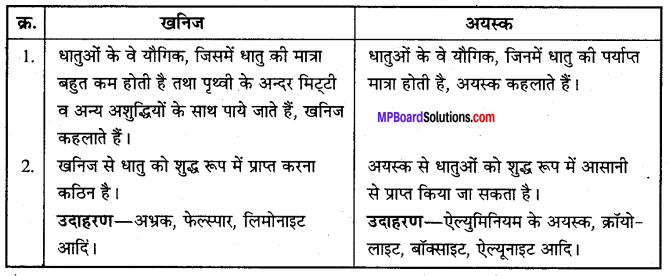
खनिजों एवं अयस्कों में अन्तर स्पष्ट कीजिए।
उत्तर
खनिज और अयस्क में अन्तर –
प्रश्न 17.
कॉपरमेट को सिलिका की परत चढ़े हुए परिवर्तन में क्यों रखा जाता है ?
उत्तर
कॉपरमेट में Cu2S एवं Fes होता है। कॉपरमेट को सिलिका के साथ गर्म करने से FeS की अशुद्धि FeSiO3 (धातुमल) के रूप में अलग हो जाती है।

![]()
प्रश्न 18.
ऐल्युमिनियम के धातुकर्म में क्रायोलाइट की क्या भूमिका है ?
उत्तर
क्रायोलाइट के दो उदेश्य हैं –
(i) यह ऐल्युमिना को विद्युत् का अच्छा सुचालक बनाता है।
(ii) यह वैद्युत अपघट्य के गलन का तापक्रम कम करता है।
प्रश्न 19.
निम्न कोटि के कॉपर अयस्कों के लिए निक्षालन क्रिया को कैसे किया जाता है ?
उत्तर
निम्न कोटि के कॉपर अयस्कों के निक्षालन क्रिया, वायु की उपस्थिति में अम्लों से करते हैं। जब कॉपर विलयन में Cu2+ आयनों के रूप में जाता है, तब
2Cu + 2H2SO4+O2 → 2CuSO4 + 2H2O
प्रश्न 20.
CO का उपयोग करते हुए अपचयन द्वारा जिंक ऑक्साइड से जिंक का निष्कर्षण क्यों नहीं किया जाता?
उत्तर
एलिन्गम आरेख में, CO का CO2 में ऑक्सीकरण का ग्राफ, Zn के ऑक्सीकरण ग्राफ से ऊपर रहता है। इस प्रकार CO,Zno को Zn में अपचयित नहीं करती। अन्य प्रकार से, कार्बन का CO में ऑक्सीकरण का ग्राफ, 1120 K अथवा ऊपर ताप-पर Zn के ऑक्सीकरण ग्राफ से नीचे है। इस प्रकार ‘C’ का उपयोग 1120 K अथवा अधिक ताप पर ZnO के ऑक्सीकरण में करते हैं।
प्रश्न 21.
Cr2O3 के विरचन के लिए ΔfG° का मान – 540kJmol-1 है, तथा Al2O3 के लिए-827 kJmol-1 है, क्या Cr2O3 का अपचयन AI से संभव है।
उत्तर
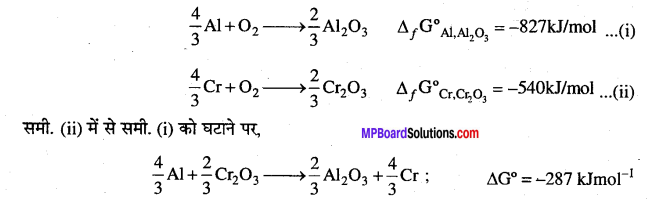
प्रश्न 22.
‘C’ एवं ‘Co’ में से Zno के लिए कौन-सा अपचायक अच्छा है?
उत्तर
कार्बन अच्छा अपचायक अभिकर्मक है।
एलिन्गम आरेख में, CO का CO2 में ऑक्सीकरण का ग्राफ, Zn के ऑक्सीकरण ग्राफ से ऊपर रहता है। इस प्रकार CO,Zno को Zn में अपचयित नहीं करती। अन्य प्रकार से, कार्बन का CO में ऑक्सीकरण का ग्राफ, 1120 K अथवा ऊपर ताप-पर Zn के ऑक्सीकरण ग्राफ से नीचे है। इस प्रकार ‘C’ का उपयोग 1120 K अथवा अधिक ताप पर ZnO के ऑक्सीकरण में करते हैं।
![]()
प्रश्न 23.
किसी विशेष स्थिति में अपचायक का चयन ऊष्मागतिकी कारकों पर आधारित है। आप इस कथन से कहाँ तक सहमत हैं ? अपने मत के समर्थन में दो उदाहरण दीजिए।
उत्तर
किसी निश्चित धातु-ऑक्साइड को धातु में अपचयन के लिए उपयुक्त अपचायक अभिकर्मक के चयन के लिए ऊष्मागतिकी कारक के रूप में सहायता करता है। ऑक्साइडों के निर्माण में ΔfG° vs T के बीच ग्राफ के आधार पर तापीय अपचयन की संभावना का अनुमान लगाया जाता है। इसे एलिन्गम आरेख कहते हैं। इस आरेख से यह अनुमान लगाया जाता है कि ऐसी धातु ऑक्साइड, जिनमें ΔfG° ऑक्साइड अधिक ऋणात्मक है, अपचयित की जा सकती है। अन्य शब्दों में एलिन्गम आरेख में अन्य धातुओं के ऑक्साइड ऊपर हैं अपचयित की जा सकती है, क्योंकि संयुक्त रेडॉक्स अभिक्रिया के लिए ΔrG° ऋणात्मक दो धातुएँ, जिनके ΔfG° ऑक्साइड कम ऋणात्मक है, की तुलना में, ऐसी धातु ऑक्साइडों को ΔfG° के अन्तर के बराबर होगा। उदाहरण के लिए, Al, Cr2O3 को अपचयित करता है, जबकि MgO को नहीं। इसी भाँति कार्बन ZnO को Zn में अपचयित करता है, किन्तु CO को नहीं। अतः निश्चित अपचायक अभिकर्मक का चयन ऊष्मागतिकी कारक पर निर्भर करता है।
प्रश्न 24.
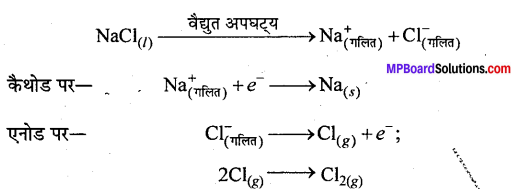
उस विधि का नाम लिखिए, जिसमें क्लोरीन सहउत्पाद के रूप में प्राप्त होती है। क्या होगा यदि NaCl के जलीय विलयन का वैद्युत अपघटन किया जाए ?
उत्तर
सोडियम धातु को डाउन प्रक्रम द्वारा बनाया जाता है। NaCl एवं CaCl2 के गलित मिश्रण को 873 K पर यह वैद्युत अपघटन से प्राप्त होता है।
यदि NaCl के जलीय विलयन का वैद्युत अपघटन किया जाये, तो कैथोड पर H2 निकलती है, जबकि Cl2 एनोड पर प्राप्त होती है। इसका कारण \(\mathrm{E}_{\mathrm{Na}^{+} / \mathrm{Na}}^{\mathrm{o}}\) (-2.71) \(\mathrm{E}_{\mathrm{H}_{2} \mathrm{O} / \mathrm{H}_{2}}^{\circ} (-0.832)\) से अधिक कम है। जल, Na+ आयनों की उपस्थिति में H2 में अपचयित हो जाता है।
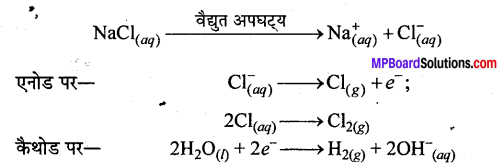
प्रश्न 25.
ऐल्युमिनियम के वैद्युत-धातुकर्म में ग्रेफाइट छड़ की क्या भूमिका है ?
उत्तर
ऐलुमिना के विद्युतीय अपचयन में ग्रेफाइट एनोड वैद्युत अपघटन द्वारा Al2O3 का ऐल्युमिनियम में अपचयन की सुविधा प्रदान करता है। कार्बन ऑक्सीजन से क्रिया कर एनोड पर CO एवं CO2 निकालता है।
एनोड पर – C + O2- → CO + 2e–
C + 2O2- → CO2 + 4e–
कैथोड पर – Al3+ + 3e– → Al.
प्रश्न 26.
निम्नलिखित विधियों द्वारा धातुओं के शोधन के सिद्धांतों की रूपरेखा दीजिए
(i) मंडल परिष्करण (Zone refining); (ii) वैद्युत अपघटन परिष्करण (Electrolytic refining), (ii) वाष्प प्रावस्था परिष्करण (Vapour phase refining)।
उत्तर
(i) मंडल परिष्करण (Zone refining)- मंडल परिष्करण या प्रभाजी क्रिस्टलीकरण (Zone refining or Fractional crystallisation) विशिष्ट उपयोगों हेतु शुद्धतम धातु प्राप्त करने हेतु इस विधि का उपयोग किया जाता है। उदाहरण के लिये, अर्द्धचालक (Semiconductors) के रूप में उपयोग के लिये सिलिकॉन व जर्मेनियम को इसी विधि द्वारा प्राप्त किया जाता है। यह विधि इस तथ्य पर आधारित है कि अशुद्ध धातु के ठोस अवस्था की तुलना में द्रव में अधिक विलेय होती हैं तथा अशुद्धियाँ होने पर उसका गलनांक शुद्ध धातु से कम होता है।
इस विधि में अशुद्ध धातु के छड़ के एक सिरे में गोलाकार चलित हीटर फिट कर दिया जाता है। हीटर को छड़ में धीरे-धीरे विस्थापित किया जाता है। हीटर के आसपास धातु पिघलती है। जैसे-जैसे हीटर आगे बढता है शुद्ध धातु क्रिस्टलीकृत होता जाता है तथा अशुद्धियाँ पिघले क्षेत्र में चली जाती हैं । यह प्रक्रिया तब तक दोहरायी जाती है जब तक पूरी अशुद्धियाँ छड़ के एक सिरे पर नहीं आ जाती जिसे बाद में अलग कर दिया जाता है। यह विधि प्रभाजी क्रिस्टलीकरण (Fractional crystallisation) भी कहलाती है।
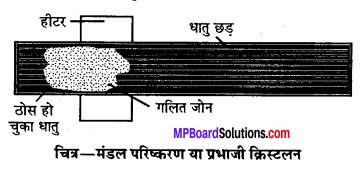
(ii) स्तम्भ वर्णप्रक्रम या अधिशोषण स्तम्भ वर्णप्रक्रम (Column chromatography or Adsorption column chromatography)- यह विधि काँच नली में बंद (Packed) अधिशोषक के स्तम्भ पर मिश्रण के पृथक्करण से संबंधित है। स्तम्भ के निचले सिरे पर स्टॉप कॉक (Stop cock) लगा होता है। अधिशोषक पर अधिशोषित होने वाले मिश्रण को अधिशोषक स्तम्भ के ऊपर रखा जाता है। अब एक अन्य द्रव मिश्रण, जो वाहक (Eluant) का कार्य करता है, स्तम्भ में नीचे की ओर बहने दिया जाता है। यह वाहक मिश्रण अपने साथ धीरे-धीरे पूर्व अधिशोषित पदार्थों को बहाकर ले जाता है। मिश्रण के विभिन्न अवयव स्तम्भ के विभिन्न भागों में अधिशोषित हो जाते हैं।
वह अवयव जो अधिक प्रबलता से अधिशोषित होता है, स्तम्भ के ऊपरी भाग में रहता है और पट्टी बनाता है। अधिशोषित यौगिकों को विभिन्न घोलकों में घुलाकर एक-एक करके पृथक् कर लिया जाता है। इस प्रक्रिया को निक्षालन (Elution) कहते हैं। निक्षालन की क्रिया के लिए प्रायः जल, ऐल्कोहॉल, ऐसीटोन, पेट्रोलियम, ईथर आदि घोलकों का उपयोग होता है। अधिशोषक के रूप में प्राय: एलुमिना, मैग्नीशियम
ऑक्साइड, सिलिका जेल, कैल्सियम कार्बोनेट आदि का व्यवहार होता है। इस विधि में साधारणतः एक भाग यौगिक के लिए चालीस भाग अधिशोषक प्रयुक्त होता है।
कभी-कभी नली से अधिशोषित स्तम्भ को बाहर निकालकर प्रत्येक रंगीन बैण्ड को काट लिया जाता है। इन रंगीन बैण्डों से अधिशोषित यौगिकों को घोलक द्वारा निष्कर्षित (Extract) कर रवाकरण की क्रिया द्वारा शुद्ध अवयव प्राप्त किये जाते हैं।
इस विधि द्वारा किसी मिश्रण से रंगहीन (Colourless) अवयवों का पृथक्करण तभी संभव है जब वे पराबैंगनी प्रकाश (Ultra-violet light) में विभिन्न प्रतिदीप्त (Fluorescence) प्रदर्शित करते हों। यदि वे प्रतिदीप्ति प्रदर्शित नहीं करते तो अधिशोषक को ही प्रतिदीप्तिशील पदार्थ (Fluorescent material) में डुबोया जाता है। मिश्रण के विभिन्न अवयवों को अधिशोषित करने वाले क्षेत्र पराबैंगनी प्रकाश में गहरे रंग (Dark colour) के दिखाई पड़ने लगते हैं जिससे अवयवों के पृथक्करण में सुविधा होती है। प्रयोग शीशे की नली की जगह क्वार्ट्स (Quartz) की नली में किया जाता है।
(ii) वैद्युत अपघटन परिष्करण (Electrolytic refining) धातुएँ अपने लवण के विलयन का विद्युत्अपघटन करने पर कैथोड पर जमा होती है। एक से अधिक धातुएँ रहने पर अपनी विद्युत् धनात्मक प्रवृत्ति के क्रम पर या बढ़ते ऑक्सीकरण विभव के क्रम में मुक्त होकर कैथोड पर जमा होती हैं । इस विधि में एक उपयुक्त विद्युत्-अपघट्य का चुनाव करके उसे विद्युत्-अपघटन सेल में ले लिया जाता है। शुद्ध धातु को कैथोड बनाकर विद्युत्-अपघटन सेल में लगाया जाता है। अशुद्ध धातु जिसका कि शोधन किया जाना है उसका एक मोटा एनोड बनाया जाता है। विद्युत्-अपघटन सेल में उपयुक्त विभव में जब विद्युत् प्रवाहित की जाती है तो एनोड से शुद्ध धातु विलयन में घुलेती है तथा विलयन से शुद्ध धातु, कैथोड के ऊपर लगातार संग्रहित होता रहता है। इस प्रकार विद्युत्-अपघटन की क्रिया में एनोड निरन्तर पतला होता चला जाता है तथा कैथोड लगातार मोटा होता जाता है। अशुद्धियाँ, एनोड पंक (Anode mud) के रूप में एनोड के नीचे जमा होती है। समय-समय पर आवश्यकतानुसार इलेक्ट्रोड परिवर्तित कर लिये जाते हैं।
(iii) वाष्प प्रावस्था परिष्करण (Vapour-phase refining)- कच्ची धातु को विशिष्ट अभिकर्मक के साथ गर्म करने पर निम्न ताप पर वाष्पशील यौगिक प्राप्त होता है। इस वाष्पशील यौगिक को उच्च तापक्रम पर गर्म करने से विघटित होकर धातु देता है। इस विधि द्वारा Ni, Ti, Zr आदि का शोधन किया जाता है।
(a) माण्ड प्रक्रम (Mond process)- इस विधि का उपयोग निकिल जैसी धातुओं के शोधन में किया जाता है जो कि वाष्पशील कार्बोनिल यौगिक बनाती है। ये धातु के कार्बोनिल यौगिक उच्च ताप पर विघटित हो जाते हैं तथा कार्बन मोनोऑक्साइड गैस मुक्त करती हैं व शुद्ध धातु शेष रह जाती है।

(b) वान-अर्केल विधि (Van-Arkel method)-जिर्कोनियम व टाइटेनियम जैसी धातुओं को अतिशुद्ध रूप में प्राप्त करने हेतु इस विधि का उपयोग किया जाता है। इस विधि में अशुद्ध धातु को वाष्पशील अस्थायी यौगिक (मुख्यतः धात्विक आयोडाइड) में परिवर्तित किया जाता है, जो गर्म करने पर विघटित होकर शुद्ध धातु प्रदान करते हैं। जैसे –
![]()
प्रश्न 27.
उन परिस्थितियों का अनुमान लगाइए, जिनमें AI, Mgo को अपचयित कर सकता है।
उत्तर
1623 K के ऊपर, AI, Mgo को Mg में अपचयित करता है।
![]()
Mgo से Al2O, अधिक स्थायी है, अत: Al, 1623 K के ऊपर MgO को अपचयित करता है।
तत्त्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम अन्य महत्वपूर्ण प्रश्नोत्तर
तत्त्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम वस्तुनिष्ठ प्रश्न
1. सही विकल्प चुनकर लिखिए
प्रश्न 1.
ऐल्युमिना के वैद्युत-अपघटन में क्रायोलाइट इसलिए मिलाया जाता है
(a) ऐल्युमिना के गलनांक घटाने के लिए
(b) वैद्युत-चालकता घटाने के लिए
(c) ऐल्युमिना की अशुद्धियाँ पृथक् करने के लिए
(d) एनोड प्रभाव को कम करने के लिए।
उत्तर
(a) ऐल्युमिना के गलनांक घटाने के लिए
प्रश्न 2.
कौन-सी धातु अपनी ही ऑक्साइड की परत से रक्षित होती है –
(a) Ag
(b) Fe
(c) Cu
(d) Al.
उत्तर
(d) Al.
प्रश्न 3.
बॉक्साइट से Al के निर्माण में कौन-सी विधि का उपयोग किया जाता है –
(a) मैग्नीशियम द्वारा अपचयन
(b) कोक द्वारा अपचयन
(c) विद्युत्-अपघटनी अपचयन
(d) लोहे द्वारा अपचयन।
उत्तर
(c) विद्युत्-अपघटनी अपचयन
प्रश्न 4.
आयरन ऑक्साइड की अशुद्धियों वाले बॉक्साइट का शोधन किस विधि द्वारा किया जाता है –
(a) हुप की विधि
(b) सर्पक विधि
(c) बेयर विधि
(d) विद्युत्-अपघटनी विधि।
उत्तर
(c) बेयर विधि
![]()
प्रश्न 5.
फफोलेदार ताँबा है –
(a) Cu का अयस्क
(b) Cu की मिश्र-धातु
(c) शुद्ध ताँबा .
(d) 1% अशुद्धियाँ युक्त ताँबा।
उत्तर
(d) 1% अशुद्धियाँ युक्त ताँबा।
प्रश्न 6.
वात्या-भट्टी में आयरन ऑक्साइड अवकृत होता है
(a) SiO2 से
(b) CO से
(c)C से
(d) CaCO3 से।
उत्तर
(b) CO से
प्रश्न 7.
हेमेटाइट से लोहे के निष्कर्षण में चूने का पत्थर का कार्य है –
(a) अपचायक पदार्थ
(b) धातुमल
(c) अधात्री
(d) गालक।
उत्तर
(d) गालक।
प्रश्न 8.
क्यूपेलीकरण इसके धातुकर्म में प्रयुक्त होती है –
(a) Cu
(b) Ag
(c) Al .
(d) Fe.
उत्तर
(b) Ag
प्रश्न 9.
फोटोग्राफी में काम आने वाली प्लेट तथा फिल्मों का यह आवश्यक अवयव है
(a) AgNO3
(b) Ag2S2O3
(c) AgBr
(d) Ag2CO3.
उत्तर
(c) AgBr
प्रश्न 10.
जिंक, कॉस्टिक सोडा विलयन के आधिक्य से क्रिया करके बनाता है
(a) Zn(OH)2
(b) ZnO
(c) Na2ZnO2
(d) ZnH2.
उत्तर
(c) Na2ZnO2
प्रश्न 11.
कैलोमल है
(a) Hg2Cl2
(b) HgCl2
(c) Hg2Cl2 + Hg
(d) Hg + HgCl2.
उत्तर
(a) Hg2Cl2
![]()
प्रश्न 12.
पोटैशियम आयोडाइड घोल को मरक्यूरिक आयोडाइड पर अत्यधिक मात्रा में डालने पर बनाता
(a) Hg2Cl2
(b) K2HgI4
(c) Hg
(d) Hg + KI3
उत्तर
(b) K2HgI4
प्रश्न 13.
HgCI, के विलयन में अधिक मात्रा में KI मिलाने पर प्राप्त होने वाला रंग है –
(a) नारंगी
(b) भूरा
(c) लाल
(d) रंगहीन।
उत्तर
(c) लाल
प्रश्न 14.
निम्न में से कौन-सी धातु अमलगम नहीं बनाती है –
(a) Zn
(b) Cu
(c) Mg
(d) Fe.
उत्तर
(d) Fe.
प्रश्न 15.
निम्नलिखित अयस्क मैलेकाइट है –
(a) Cu2S
(b) CuCO3.Cu(OH)2
(c) Cu2O
(d) CuCO3
उत्तर
(b) CuCO3.Cu(OH)2
प्रश्न 16.
हाइपो में AgBr की विलेयता इसके बनने के कारण है –
(a) Ag2SO3
(b) Ag2S2O3
(c) [Ag(S2O3)]–
(d) [Ag(S2O3)2]3-
उत्तर
(c) [Ag(S2O3)]–
प्रश्न 17.
AgCI अमोनिया में इसके बनने के कारण विलेय है –
(a) [Ag(NH3)4]+
(b) [Ag(NH3)2]2+
(c) [Ag(NH3)4] 3+
(d) [Ag(NH3)2]+
उत्तर
(d) [Ag(NH3)2]+
![]()
प्रश्न 18.
कॉपर सल्फेट घोल में KI डालने से बनाता है –
(a) CuI2
(b) CuI22+
(c) K2[CuI4]
(d) Cu2F2 + I2.
उत्तर
(d) Cu2F2 + I2.
प्रश्न 19.
CuSO4 विलयन की KCN के साथ क्रिया से बनता है
(a) Cu(CN)2
(b) CuCN
(c) K2[Cu(CN4)]
(d) K3[Cu(CN)4].
उत्तर
(d) K3[Cu(CN)4].
प्रश्न 20.
फोटोग्राफी में निम्न रूप में Na2S2O3,, प्रयुक्त होता है –
(a) अपचयन करने वाला
(b) डेवलेपर
(c) स्थिर करने वाला
(d) टोनिंग करने वाला।
उत्तर
(c) स्थिर करने वाला
2. रिक्त स्थानों की पूर्ति कीजिए
- मैलेकाइट ……………. का एक अयस्क है।
- स्टेनलेस स्टील में लोहे के साथ ………… एवं ……….. धातु मिश्र-धातु बनाती है।
- ………… का उपयोग परगेटिव के रूप में किया जाता है।
- …………. का कोलॉइडी विलयन का उपयोग आँख की दवाई बनाने में होता है।
- AgNO3 को ………….. कहते हैं।
- कोरोसिव सब्लीमेट का रासायनिक सूत्र ……….. है।
- झाग उत्प्लावन विधि ………… अयस्कों के लिए प्रयोग की जाती है।
- ऐल्युमिनियम द्वारा किसी धातु का अपचयन ………… कहलाता है।
- अमोनिया को सुखाने में प्रयुक्त होता है।
- ……….. को लूनर कॉस्टिक कहते हैं।
- फ्लोरस्पार का सूत्र ………… है।
- HgCl2 व KI का क्षारीय विलयन …………… कहलाता है।
- रक्त तप्त स्टील को वायु में धीरे-धीरे ठण्डा करने पर वह मृदु इस्पात में परिवर्तित होता है, इसे …………… कहते है।
उत्तर
- कॉपर
- Cr, Ni
- कैलोमल
- Ag
- लूनर कॉस्टिक,
- HgCl2
- सल्फाइड
- ऐल्युमिनोतापी
- CuO
- सिल्वर नाइट्रेट
- CaF2
- नेस्लर अभिकर्मक,
- एनीलिंग।
![]()
3. उचित संबंध जोड़िए –
I.

उत्तर
1. (d), 2. (c), 3. (e), 4. (b), 5. (a), 6. (f), 7. (g).
II.

उत्तर
1. (d), 2. (a), 3. (b), 4. (e), 5. (c).
III.

उत्तर
1. (d), 2. (e), 3. (1), 4. (c), 5. (b), 6. (a).
![]()
4. एक शब्द/वाक्य में उत्तर दीजिए –
- वात्या-भट्टी से प्राप्त Cu2S तथा FeS का मिश्रण कहलाता है।
- प्रदण्डन (Polling) से किस धातु का शोधन किया जाता है ?
- डेवलप करने के पश्चात् फोटोग्राफिक फिल्म को स्थिर करने के लिए किस विलयन में डुबाया जाता
- दार्शनिक वुल का रासायनिक सूत्र है।
- हार्न सिल्वर का रासायनिक सूत्र लिखिए।
- फोटोग्राफी में टोनिंग के लिए सामान्यतः किस यौगिक का उपयोग किया जाता है ?
- सिक्का धातु किसे कहते हैं ?
- कॉपर प्राप्त करने का प्रमुख अयस्क कौन-सा है ?
- आयरन प्राप्त करने का प्रमुख अयस्क कौन-सा है ?
- तत्वों की ऑक्साइड निर्माण के लिए मानक मुक्त उर्जा परिवर्तन (∆G°) व परमताप आरेख क्या कहलाता है?
- ढलवाँ लोहे से अशुद्धि दूर कर जो लोहा प्राप्त होता है, इसका नाम क्या है ?
- कठोर इस्पात को गर्म कर धीरे -धीरे ठण्डा करने की विधि क्या कहलाती है ?
- कठोर इस्पात को गर्म करने की विधि क्या कहलाती है ?
- इस्पात को अमोनिया के वातावरण में गर्म करने की विधि क्या कहलाती है ?
- लूनर कॉस्टिक किसे कहते है ?
उत्तर
- मैट
- कॉपर
- हाइपो विलयन (Na2S2O3)
- ZnO
- AgCl
- ऑरिक क्लोराइड
- Cu,Ag और Au को
- कॉपर पायराइटीज
- हेमेटाइट
- एलिन्गम आरेख
- पिटवाँ लोहा
- तापानुशीतन
- मृदुकरण
- नाइट्राइडीकरण
- AgNO3.
तत्त्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम अति लघु उत्तरीय प्रश्न
प्रश्न 1.
एल्युमिना के विद्युत् अपघटन में AI प्राप्त करते समय क्रायोलाइट मिलाया जाता है। कारण बताइए। .
उत्तर
एल्युमिना का गलनांक अति उच्च है (2050°C) क्रायोलाइट मिलाने पर एल्युमिना का गलनांक कम हो जाता है। साथ ही साथ क्रायोलाइट का विद्युत् अपघटन आसान हो जाता है।
प्रश्न 2.
जब AI को सान्द्र HNO3 के संपर्क में रखा जाता है तो किसी भी अभिक्रिया के होने का पता नहीं लगता है। क्यों?
उत्तर
चूँकि AI को सान्द्र HNO3 से क्रिया करके Al2O3 बनाता है जो AI धातु या एक सुरक्षात्मक आवरण बना लेता है, जिससे अभिक्रिया आगे नहीं बढ़ती।
प्रश्न 3.
AI का कौन-सा यौगिक अच्छा अपचायक है ?
उत्तर
AI का जटिल हाइड्राइड Li(AlH4 ) मुख्यतः कार्बनिक यौगिकों के लिये अच्छा अपचायक है।
प्रश्न 4.
निम्न के रासायनिक सूत्र लिखिए(i) कैलोमल, (ii) फिलॉस्फर वूल, (ii) कोरोसिव सब्लिमेट।
उत्तर
(i) कैलोमल-Hg2Cl2 मरक्यूरस क्लोराइड
(ii) फिलॉस्फर वूल-ZnO
(iii) कोरोसिव सब्लिमेट-HgCl2 मरक्यूरिक क्लोराइड।
उपयोग- (i) एण्टीसेप्टिक के रूप में, (ii) लकड़ी को सुरक्षित करने के लिए, (iii) प्रयोगशाला में अभिकर्मक के रूप में।
प्रश्न 5.
कॉपर के मुख्य अयस्क लिखिए।
उत्तर
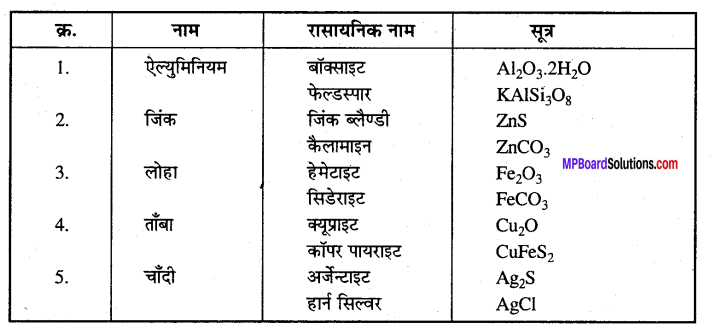
कॉपर के मुख्य अयस्क निम्नलिखित हैं –
(1) ऑक्साइड-क्यूप्राइट या रूबी कॉपर (Cu2O)
(2) कार्बोनेट-ऐज्युराइट-2CuCO2.Cu(OH)2
मैलेकाइट-CuCO3.Cu(OH)2 या CuCO3.CuO.H2O
(3) सल्फाइड-कॉपर पायराइटीज या कैल्कोपाइराइट-Cu2S + Fe2S3,या CuFeS2
कॉपर ग्लांस या कैल्कोसाइट – Cu2S
![]()
प्रश्न 6.
लूनर कॉस्टिक का रासायनिक नाम, सूत्र व दो उपयोग लिखिए।
उत्तर
(1) रासायनिक नाम-सिल्वर नाइट्रेट।
(2) सूत्र- AgNO3
(3) उपयोग-(i) दवाइयों में इसका उपयोग क्षार के रूप में
(ii) विशेष प्रकार की स्थायी व हेयर डाई बनाने में।
तत्त्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम लघु उत्तरीय प्रश्न
प्रश्न 1.
इस्पात के कठोरीकरण, तापानुशीतन, पायनीकरण एवं नाइट्राइडीकरण को समझाइए।
उत्तर-
1. कठोरीकरण-यदि रक्त-तप्त इस्पात को पानी में डालकर एकदम ठण्डा किया जाये तो प्राप्त इस्पात अति कठोर और भंगुर हो जाता है। इस क्रिया को इस्पात का कठोरीकरण कहते हैं।
2. तापानुशीतन-जब रक्त-तप्त इस्पात को धीरे-धीरे ठण्डा किया जाता है तब वह बहुत मुलायम हो जाता है। इस क्रिया को इस्पात का तापानुशीतन कहते हैं।
3. पायनीकरण-जब कठोर एवं भंगुर इस्पात को गर्म करके धीरे-धीरे भिन्न तापों पर ठण्डा किया जाता है। भिन्न-भिन्म तापों पर इस्पात की कठोरता कम होती जाती है और ताप के अनुसार इस्पात अलग-अलग गुण प्रदर्शित करता है। इस क्रिया को इस्पात का पायनीकरण कहते हैं।
4. नाइट्राइडीकरण-इस्पात की सतह का नाइट्रोजन द्वारा संतृप्त होना नाइट्राइडीकरण कहलाता है। इस्पात को 500-600°C ताप पर अमोनिया गैस में गर्म करने पर इस्पात का नाइट्राइडीकरण हो जाता है। आयरन नाइट्राइड की पर्त इस्पात को कठोर बना देती है।
प्रश्न 2.
कॉपर सल्फेट (नीला थोथा) बनाने की विधि व इसके उपयोग लिखिए।
उत्तर
कॉपर सल्फेट बनाने की विधियाँ –
(1) कॉपर को वायु की उपस्थिति में तनु H,SOR के साथ गरम करके
2Cu + 2H2SO4 + O2 → 2CuSO4 + 2H2O .
(2) कॉपर ऑक्साइड, हाइड्रॉक्साइड या कार्बोनेट पर H2SO4 की क्रिया से
CuO + H2SO4 → CuSO4 + H2O
Cu(OH)2 +H2SO4 → CuSO4 + 2H2O
CuCO3 + H2SO4 → CuSO4 + H2O + CO2.
उपयोग-(1) कपड़ों की रंगाई एवं छपाई में। (2) जीवाणुनाशी के रूप में। (3) कीटाणुनाशी के रूप में। (4) विद्युत् सेलों में। .
प्रश्न 3.
कॉपर सल्फेट विलयन की निम्न के साथ होने वाली अभिक्रिया का समीकरण लिखिए(i) NaOH विलयन, (ii) NH4OH, (iii) KI विलयन, (iv) KCN.
उत्तर
(i) कॉपर सल्फेट विलयन में NaOH विलयन मिलाने से हल्के नीले रंग का क्यूप्रिक हाइड्रॉक्साइड का अवक्षेप बनता है।
CuSO4 +2NaOH → Cu(OH)2 + Na2SO4.
(ii) कॉपर सल्फेट विलयन में अमोनियम हाइड्रॉक्साइड आधिक्य में मिलाने पर क्यूप्रिक अमोनियम सल्फेट का विलेय संकर लवण का गहरा नीला रंग प्राप्त होता है।
CuSO4 + 4NH4OH → [Cu(NH3)4]SO4 + 4H2O
(iii) कॉपर सल्फेट के विलयन में KI विलयन मिलाने पर I2 मुक्त होती है।
CuSO4 +2KI → K2SO4 + CuI2
2CuI2 → I2 + Cu2I2.
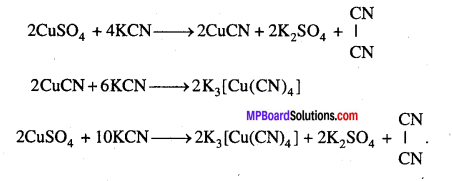
(iv) कॉपर सल्फेट KCN के आधिक्य में घुलकर पोटैशियम क्यूप्रोसाइनाइड बनाता है।
![]()
प्रश्न 4.
नीला थोथा क्या है ? इस पर ऊष्मा का प्रभाव लिखिए।
उत्तर
कॉपर सल्फेट का व्यापारिक नाम नीला थोथा है, जिसमें पाँच अणु क्रिस्टलन जल के होते हैं। यह नीले रंग का क्रिस्टलीय ठोस.पदार्थ है जो जल में विलेय है।
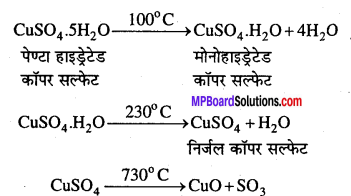
ऊष्मा का प्रभाव – CuSO4.5H2O को 100°C ताप पर गर्म करने पर 4 क्रिस्टलन जल के अणु निकल जाते हैं और मोनोहाइड्रेटेड CuSO4 प्राप्त होता है, जो 130°C ताप निर्जल कॉपर सल्फेट देता है तथा 730°C ताप पर वियोजित होकर क्यूप्रिक ऑक्साइड व सल्फर ट्राइऑक्साइड देता है।
प्रश्न 5.
Al के मुख्य अयस्क कौन-कौन से हैं ? अशुद्ध Al का शोधन किस प्रकार किया जाता है ?
अथवा, ऐल्युमिना के विद्युत्-अपघटनी सेल का नामांकित चित्र बनाइए व इसमें होने वाली रासायनिक अभिक्रियाएँ लिखिए।
उत्तर
Al के मुख्य अयस्क
(1) बॉक्साइट – Al2O3.2H2O
(2) फेल्स्पार – K2O.Al2O3.6H2O
(3) क्रायोलाइट- Na3AIF6
Al का शोधन- Al का शोधन विद्युतीय हूप विधि द्वारा किया जाता है जिससे सेल में तीन स्तर होते हैं
(1) AL, Cu एवं Si की बनी मिश्र धातु की तली पर ऐनोड परत।
(2) क्रायोलाइट एवं बेरियम फ्लुओराइड का गलित मिश्रण मध्य परत।
(3) शुद्ध धातु की ऊपरी के कैथोड परत।
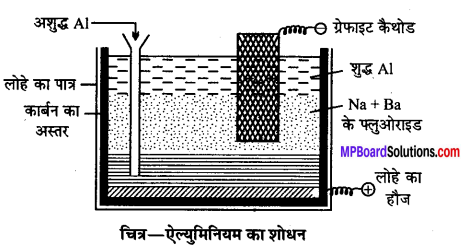
सेल-कार्बन अस्तर युक्त लोहे का एक बॉक्स होता है। धारा प्रवाहित करने पर मध्य पर्त के ऐल्युमिनियम आयन ऊपरी पर्त की ओर गमन करते हैं तथा शुद्ध Al के रूप में कैथोड पर जाकर अपचयित हो जाते हैं और उतनी ही मात्रा में AI निचली परत (ऐनोड) से मध्य परत में आ जाते हैं और अशुद्धियाँ नीचे रह जाती हैं। इस विधि से 99.9% शुद्ध Al धातु प्राप्त होता है।
समीकरण- 2Al2O3 + 3C → 4Al + 3CO2
कैथोड पर- Al3+(l) + 3e– → Al(l)
ऐनोड पर- C + O–2 → CO + 2e–
प्रश्न 6.
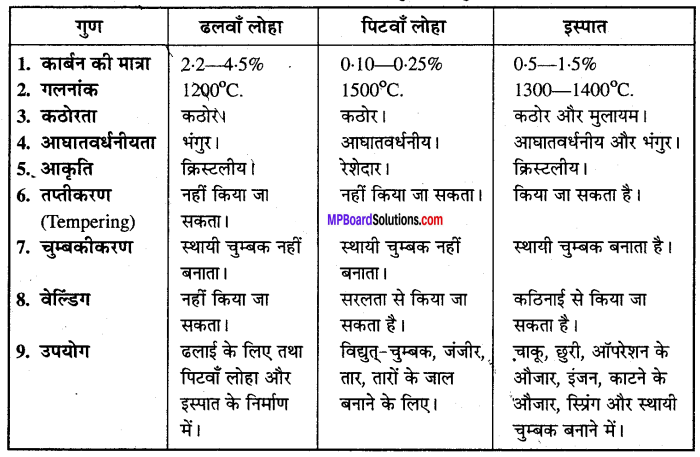
हलवा लोहा, पिटवाँ लोहा और इस्पात के गुणों की तुलना कीजिए।
उत्तर
ढलवाँ लोहा, पिटवाँ लोहा और इस्पात के गुणों की तुलना –
प्रश्न 7.
निम्नलिखित धातु के दो अयस्कों के रासायनिक नाम व सूत्र लिखिए –
(1) ऐल्युमिनियम
(2) जिंक
(3) लोहा
(4) ताँबा
(5) चाँदी।
उत्तर
अयस्कों के नाम –
![]()
प्रश्न 8.
ताँबे की नाइट्रिक अम्ल से होने वाली चार विभिन्न रासायनिक अभिक्रिया समीकरण सहित लिखिए।
उत्तर
ताँबे पर नाइट्रिक अम्ल की अभिक्रिया –
(i) तनु और ठण्डे HNO3 के साथ नाइट्रस ऑक्साइड बनाता है।
4Cu + 10HNO3 → 4Cu(NO3)2 + 5H2O+N2O
(ii) तनु और गर्म HNO3 के साथ नाइट्रिक ऑक्साइड बनाता है।
3Cu + 8HNO3 → 3Cu(NO3)2 + 4H20+ 2NO
(iii) सान्द्र और ठण्डे HNO3 के साथ नाइट्रोजन ऑक्साइड बनाता है।
Cu + 4HNO3 → Cu(NO3)2 + 2NO2+2H2O
(iv) सान्द्र और गर्म HNOJ के साथ नाइट्रोजन गैस बनती है।
5Cu+12HNO3 → 5Cu(NO3)2 + 6H2O + N2
प्रश्न 9.
बॉक्साइट से ऐल्युमिनियम के निष्कर्षण हॉल की विधि की रासायनिक समीकरण लिखिए।
उत्तर
हॉल की विधि की रासायनिक समीकरण इस प्रकार है –
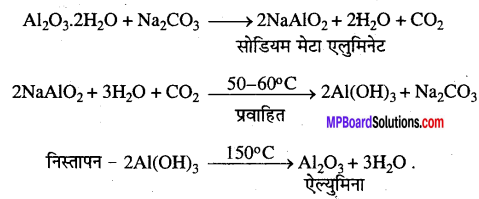
प्रश्न 10.
कॉपर की प्रमुख मिश्र धातु, उनके संघटन एवं उपयोग लिखिए।
उत्तर
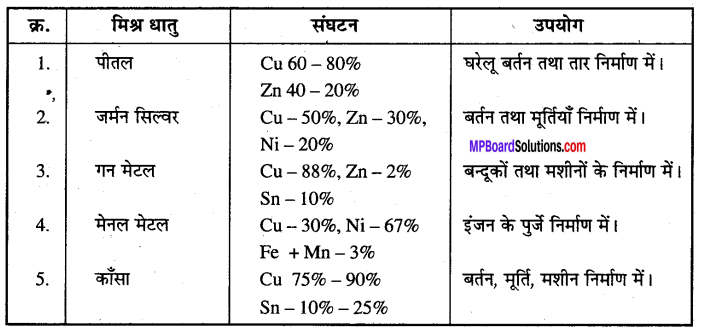
कॉपर की प्रमुख मिश्र धातु संघटन एवं उपयोग –
प्रश्न 11.
Al2O3 से Al के निष्कर्षण में विद्युत् परिपथ के समानान्तर क्रम में बल्ब लगाया जाता है। कारण समझाइए।
उत्तर-ऐल्युमिना सें A1 धातु का निष्कर्षण करते समय विद्युत् परिपथ के समानान्तर क्रम में बल्ब लगा दिया जाता है। इसका कारण यह है कि विद्युत्-अपघटन से जब ऐल्युमिना समाप्त हो जाता है तो विद्युत् प्रतिरोध बढ़ जाता है जिससे विद्युत् धारा बल्ब में से प्रवाहित होने लगती है और बल्ब जलने लगता है बल्ब के जलने पर ऐल्युमिना की और मात्रा मिला देते हैं, जिससे विद्युत्-अपघटन का प्रक्रम लगातार चलते रहता है।
![]()
प्रश्न 12.
बॉक्साइट के शोधन की बेयर विधि को समीकरण सहित लिखिए।
उत्तर
बेयर की विधि (Baeyer’s Process)—यदि बॉक्साइट में Fe2O3 अशुद्धि की मात्रा अधिक हो तो उसका शुद्धिकरण बेयर विधि से किया जाता है। इसमें बॉक्साइट अयस्क को पीसकर NaOH विलयन के साथ 80 वायुमण्डलीय दाब तथा 130°C ताप पर एक ऑटोक्लेव भट्टी में गर्म करते हैं, जिससे बॉक्साइट विलेय होकर सोडियम मेटा ऐल्युमिनेट (NaAlO2) में परिवर्तित हो जाता है तथा अशुद्धियाँ (Fe2O3) अविलेय रहती हैं जो छानकर अलग कर दी जाती हैं।

प्राप्त सोडियम मेटा ऐल्युमिनेट (NaAlO2) विलयन को जल के साथ तनु करने पर Al(OH)3 का अवक्षेप प्राप्त होता है। इसमें ताजा AI(OH)3 की कुछ मात्रा मिला दी जाती है जो अवक्षेप देने में सहायता करती है, इसे सीडिंग (Seeding) कहते हैं।
NaAlO2 + 2H2O → Al(OH)3 + NaOH
Al(OH)3 को छानकर, धोकर सुखाने के पश्चात् गर्म करने पर शुद्ध Al2O3 प्राप्त होता है।
![]()
प्रश्न 13.
कॉपर पायराइटीज से स्वअपचयन विधि द्वारा शुद्ध कॉपर प्राप्त करने का समीकरण दीजिए।
उत्तर
प्रगलन से प्राप्त द्रवित मैट को बेसेमर परिवर्तक में लेकर रेत और वायु को ट्वीयर के द्वारा पिघले मैट में प्रवाहित कराने पर मैट में उपस्थित FeS, FeO में बदल जाता है जो SiO2 से क्रिया करके धातुमल (FeSiO3) बना लेता है और Cu2S का कुछ भाग Cu2O में ऑक्सीकृत हो जाता है –
2FeS +3O2 → 2FeO + 2SO2
FeO + SiO2 → FeSiO3
2Cu2S+3O2 → 2Cu2O + 2SO2
जो बचे हुए Cu2S से क्रिया कर धात्विक कॉपर में अपचयित हो जाता है इसे स्वअपचयन कहते हैं।
2Cu2O + Cu2S → 6Cu+SO2
प्रश्न 14.
लोहा कितने प्रकार का होता है ? प्रत्येक के नाम और दो-दो विशेषताएँ लिखिए। उत्तर-लोहे के प्रकार व विशेषताएँ –
- ढलवाँ लोहा – (i) इसमें C की मात्रा 2:2 -4.5% होती है।
(ii) आघात करने पर भंगुर प्रकृति का होता है। - पिटवाँ लोहा – (i) इसमें C की मात्रा 0.10 – 0.25% होती है।
(ii) आघात करने पर फैलता है। - इस्पात – (i) इसमें C की मात्रा 0-25 से 2% होती है।
(ii) यह आघातवर्धनीय एवं भंगुर होता है।
प्रश्न 15.
बॉक्साइट अयस्क का शोधन किस विधि से किया जाता है, जबकि उसमें सिलिका की मात्रा अधिक होती है ? इस विधि का वर्णन कीजिए।
उत्तर
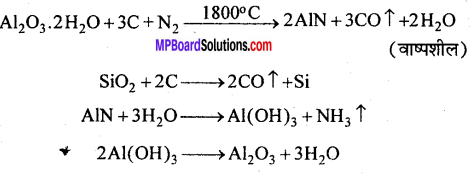
सर्पक विधि – इस विधि में सिलिकायुक्त बॉक्साइट का शोधन किया जाता है। बारीक पीसे बॉक्साइट अयस्कों को कोक के साथ मिलाकर नाइट्रोजन की धारा में 1800°C तक गर्म किया जाता है, जिससे एल्युमिनियम नाइट्राइड बनता है तथा वाष्पशील सिलिकॉन के रूप में सिलिका से पृथक् हो जाता है। AlN का जल-अपघटन करके AI(OH)3 बना लेते हैं, जिसके निस्तापन द्वारा शुद्ध Al2O3 प्राप्त होता है।
तत्त्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
फोटोग्राफी पर संक्षिप्त टिप्पणी लिखिए।
उत्तर
फोटोग्राफी में सिल्वर हैलाइडों (AgX) के अत्यन्त प्रकाश सुग्राहिता का उपयोग करके वस्तुओं के स्थायी चित्र प्राप्त किये जाते हैं। इसे निम्न पदों में समझा जा सकता है –
(1) प्लेट या फिल्म बनाना-फोटोग्राफिक प्लेट या (फोटोरील) AgBr का जिलेटिन में इमल्सन होता है, जो कि प्रकाश में बैंगनी व नीली किरणों के प्रति विशेष सुग्राही होता है। इसे और सुग्राही बनाने हेतु कुछ विशेष रंजक मिला दिये जाते हैं। इसे निम्नांकित प्रकार से बनाया जाता है –
NH4Br + AgNO3 → AgBr↓ + + NH4NO3
(2) चित्र लेना (Exposure) कैमरे के लेंस को वस्तु पर केन्द्रित करके प्रकाश को कुछ क्षण के लिए प्लेट या फिल्म में आने देते हैं। इसके कारण AgBr के उपस्थित होने से वस्तु का उल्टा प्रतिबिम्ब बन जाता है।
(3) डेवलपमेण्ट (Development)-डेवलपर क्विनोल, पाइरोगैलाल, हाइड्रोक्विनोन या एमिडाल का क्षारीय घोल होता है, जो कि AgBr के Ag में अपचयन होने वाली क्रिया को पूर्ण कर देता है। इस प्रक्रिया में काला भाग सफेद व सफेद भाग काला हो जाता है तथा उल्टा चित्र प्राप्त होता है, जिसे निगेटिव कहते हैं।
C6H4 (OH)2 + 2AgBr → C6H4O2 + 2Ag↓ + 2HBr
(4) स्थिरीकरण (Fixation) सोडियम थायोसल्फेट (हाइपो विलयन) का उपयोग निगेटिव के स्थिरीकरण हेतु किया जाता है। अप्रयुक्त AgBr हाइपो में घुलकर अलग हो जाता है।
AgBr + Na2S2O3 → NaAgS2O3 + NaBr
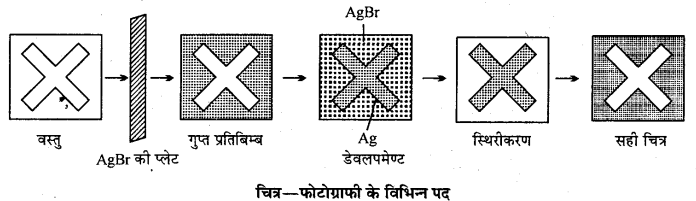
(5) प्रिंटिंग (Printing)-P.O.P. (Printing out paper) या ब्रोमाइड पेपर पर निगेटिव के द्वारा प्रकाश डालकर कुछ समय के लिए रख दिया जाता है जिससे पेपर पर वस्तु का सही चित्र अंकित हो जाता है। प्रिंटिंग पेपर पर AgCl, जिलेटिन व सिल्वर सिट्रेट का लेप लगा होता है।
(6) रंग-संस्करण (Toning)—काले-सफेद चित्र को चमकीला बनाने हेतु ऑरिक क्लोराइड (AuCl3) या प्लैटिनम क्लोराइड का विलयन उपयोग किया जाता है, जिसे (Toning) कहते हैं।
AuCl3 + 3Ag → 3AgCl + Au
![]()
प्रश्न 2.
फफोलेदार ताँबा क्या है ? इसके शोधन हेतु विद्युत्-अपघटन विधि का नामांकित चित्र सहित वर्णन कीजिए।
उत्तर
बेसेमर परिवर्तक से प्राप्त पिघली हुई कॉपर धातु में बहुत-सी SO2, गैस घुली रहती है, जिसे ठंडा करने: पर SO2 गैस बुलबुलों के रूप में निकलती है। इस प्रकार कॉपर धातु की सतह पर छोटे-छोटे छिद्र हो जाते हैं, यही फफोलेदार ताँबा कहलाता है जिसमें 98% शुद्ध कॉपर प्राप्त होता है।
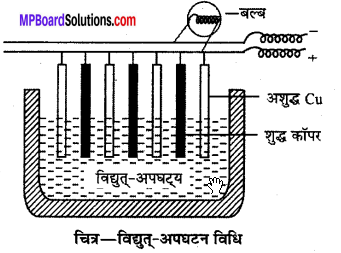
कॉपर धातु शोधन की विद्युत्-अपघटन विधि – अति शुद्ध धातु प्राप्त करने के लिए बड़ी टंकी में 15% CusO4 और 5 % H2SO4 विलयन भरकर तथा अशुद्ध Cu धातु की मोटी प्लेटों का एनोड और शुद्ध Cu की पतली प्लेटों का कैथोड लगाकर विद्युत्-अपघटन करते हैं। विद्युत् धारा प्रवाहित करने पर एनोड का अशुद्ध ताँबा धुलकर विलयन में चला जाता है और विलयन में से शुद्ध कॉपर कैथोड पर जमा हो जाता है। एनोड के नीचे अशुद्धियाँ, जिनमें Au, Ag जैसी मूल्यवान धातुएँ भी होती है, एकत्र हो जाती है इन्हें एनोड कीचड़ कहते हैं। इस प्रकार 99.99 % शुद्ध धातु प्राप्त होती है।
प्रश्न 3.
इस्पात निर्माण की सीमेन-मार्टिन विधि का सचित्र वर्णन कीजिए। अथवा, इस्पात को ढलवाँ लोहा से किस प्रकार खुले तल की भट्ठी विधि से प्राप्त किया जाता है ?
उत्तर
सीमेन और मार्टिन की खुले तल वाली भट्ठी से (By Seimen and Martin’s Open Hearth Furnace)—यह इस्पात बनाने की आधुनिक विधि है। इस विधि में अशुद्धियों का ऑक्सीकरण वायु द्वारा न करके फेरिक ऑक्साइड (हेमेटाइट) द्वारा किया जाता है। इस
विधि में एक विशेष प्रकार की भट्ठी होती है, जिसका तल उथला और खुला रहता है। इसके भीतरी भाग में अम्लीय विधि के लिये सिलिका तथा क्षारीय विधि के लिये चूना और मैग्नेशिया का अस्तर लगा रहता है। इस भट्ठी को प्रोड्यूसर गैस (Producer gas) या वायु अंगार गैस द्वारा गर्म करते हैं चूल्हे में आने के पहले प्रोड्यूसर गैस को काफी गर्म कर लेते हैं, वह भट्ठी में जलकर लगभग 1800°C ताप देता है। भट्ठी को गर्म करने के बाद उसके उथले तल पर 70-80% ढलवाँ लोहा, 20-30% लोहे की छीलन (Scrap iron) तथा हेमेटाइट (Fe2O3) डाल देते हैं । ढलवाँ लोहे में उपस्थित कार्बन ऑक्सीकृत होकर CO बनाता है तथा बाहर निकल जाता है। अन्य अशुद्धियाँ जैसे-सल्फर, फॉस्फोरस, सिलिकॉन और मैंगनीज, हेमेटाइट (Fe2O3) द्वारा ऑक्सीकृत हो जाती है।
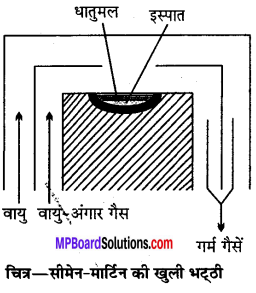
Fe2O3 + 3C → 2Fe + 3CO
2Fe2O3 + 3S → 4Fe + 3SO2
10Fe2O3 + 3P4 → 20Fe + 6P2O5
2Fe2O3 + 3Si → 4Fe + 3SiO2
Fe2O3 + 3Mn → 2Fe + 3MnO
इन क्रियाओं से बनने वाली CO और SO2 गैसें बाहर निकल जाती हैं। शेष अशुद्धियाँ भट्ठी के अस्तर से क्रिया करके धातुमल (Slag) बना लेती हैं।

थोड़ी-थोड़ी देर बाद भट्ठी से इस्पात की कुछ मात्रा निकालकर उसमें कार्बन की मात्रा ज्ञात करते रहते हैं। जब इस्पात में कार्बन की उपयुक्त मात्रा रह जाती है, तो इस्पात को भट्ठी से बाहर निकाल लिया जाता है। आवश्यक हो तो कार्बन स्पीजील के रूप में मिला दिया जाता है।
प्रश्न 4.
सिल्वर के दो मुख्य अयस्कों के नाम एवं सूत्र लिखिए तथा उसमें से किसी भी एक अयस्कों से शुद्ध धातु प्राप्त करने की विधि का समीकरण सहित वर्णन कीजिए।
अथवा, सिल्वर के दो अयस्कों के नाम और सूत्र लिखिए। चाँदी का निष्कर्षण सायनाइड विधि द्वारा किस प्रकार करते हैं ?
उत्तर
चाँदी प्रकृति में मुक्त एवं संयुक्त दोनों रूपों में पायी जाती है। संयुक्त अवस्था में यह प्रायः निम्नलिखित रूपों में पायी जाती है –
सल्फाइड – अर्जेन्टाइट या सिल्वर ग्लास (Ag2S), सिल्वर कॉपर ग्लास (Ag2S.Cu2S) आदि।
हैलाइड – हार्न सिल्वर (AgCl), ब्रोमाइड (AgBr) आदि। मुक्त अवस्था में यह सोने व ताँबा के साथ मिश्रित रहती है।
सायनाइड विधि – इसे मैक आर्थर फारेस्ट विधि भी कहते हैं । यह सिल्वर ग्लांस से सिल्वर प्राप्त करने की उपयुक्त विधि है। सान्द्रित सल्फाइड अयस्क को सोडियम सायनाइड के जलीय विलयन के साथ खूब हिलाकर मिलाया जाता है। इस प्रक्रिया में विलयन में वायु भी प्रवाहित की जाती है। सोडियम सायनाइड के आधिक्य में संकर सोडियम अर्जेण्टो सायनाइड (विलेय) बनता है।

विलयन में Zn चूर्ण मिलाने पर चाँदी अवक्षेपित हो जाती है।
2Na [Ag(CN)2] + Zn → Na2[Zn(CN)4] + 2Ag↓
गलन मिश्रण के साथ अवक्षेप को गलाने पर चमकदार चाँदी प्राप्त हो जाती है।
उपयोग – (i) सस्ती धातुओं की वस्तुओं पर चाँदी का लेपन करने में।
(ii) कलिल सिल्वर का उपयोग आँख की दवाई बनाने में होता है।
प्रश्न 5.
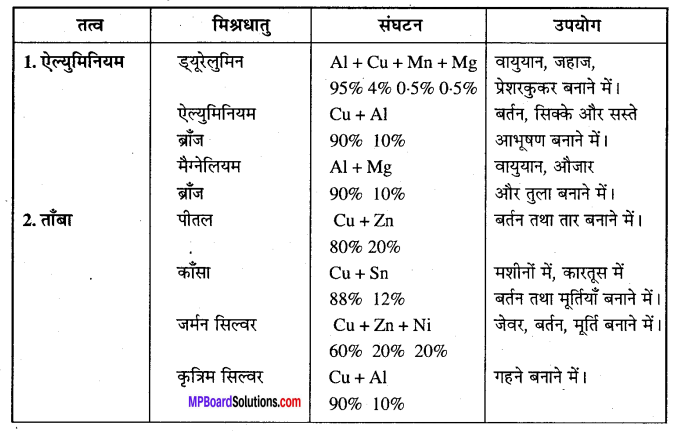
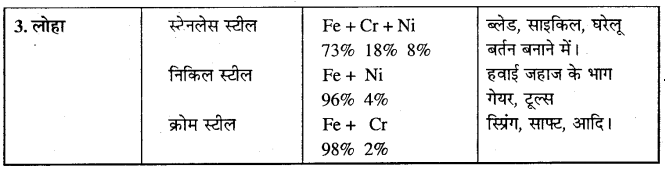
निम्न की मिश्र धातुओं के संघटन, उपयोग का वर्णन कीजिए –
(1) ऐल्युमिनियम, (2) ताँबा, (3) लोहा।।
उत्तर
मिश्र धातुओं के संघटन तथा उपयोग –
![]()
प्रश्न 6.
कॉपर के प्रमुख अयस्क कौन-से हैं ? कॉपर पायराइट से कॉपर धातु के निष्कर्षण का वर्णन कीजिए।
उत्तर
कॉपर के प्रमुख अयस्क-(i) क्यूप्राइट या रूबी कॉपर Cu2O, (ii) कॉपर पायराइट CuFeS2, या CuS.Fe2S3, (iii) मैलेकाइट CuCO3.Cu(OH)2, (iv) ऐज्युराइट 2CuCo3.Cu(OH)2.
पायराइट अयस्क से कॉपर का निष्कर्षण निम्न पदों में किया जाता है –
1. सान्द्रण (Concentration)-अयस्क को महीन पीसकर उसका सान्द्रण फेन उत्प्लावन विधि (Froth floatation process) द्वारा करते हैं।
2. भर्जन क्रिया (Roasting)—सान्द्रित अयस्क को एक उथले तल की परावर्तनी भट्ठी (Reverberatory furnace) में रखकर कम ताप पर (जिससे अयस्क पिघलने न पाए) वायु की धारा में गर्म करते हैं। पायराइट अयस्क का कॉपर, कॉपर सल्फाइड और आयरन सल्फाइड के मिश्रण में परिवर्तित हो जाता है।
2CuFeS2 + O2 → Cu2S + 2Fes + SO2
पायराइट से प्राप्त कॉपर सल्फाइड और आयरन सल्फाइड का कुछ भाग उनके ऑक्साइडों में परिणित हो जाता है।
2FeS + 3O2 → 2FeO + 2SO2
2Cu2S + 3O2 → 2Cu2O + 2SO2
3. प्रमलन (Smelting)-भर्जन क्रिया (Roasting) से प्राप्त अयस्क में रेत और कोक मिलाकर वात्याभट्ठी (Blast furnace) में प्रगलित (विगलित) करते हैं । भट्ठी के ऊपरी भाग में अयस्क डालने के लिए द्वार होता है तथा व्यर्थ गैसों के निकलने के लिए ऊपरी कोने में रास्ता बना होता है। । भट्ठी में उच्च ताप पर भर्जन से प्राप्त Cuho और Fes संयोग करके आयरन ऑक्साइड बनाते हैं।
Cu2O + FeS → Cu2S + Feo
आयरन ऑक्साइड सिलिका (रेत) गालक (flux) से मिलकर आयरन सिलिकेट, धातुमल (Slag) बनाता
FeO + SiO2 → FeSiO3 (धातुमल)
वात्या-भट्ठी के ऊपर की सतह हल्के धातुमल की होती है तथा नीचे की सतह में क्यूप्रस सल्फाइड तथा थोड़ा फेरस सल्फाइड रहता है। इसे मैट (Matte) कहते हैं। ऊपरी सतह पर स्थित हल्की धातुमल बाहर निकाल दी जाती है।
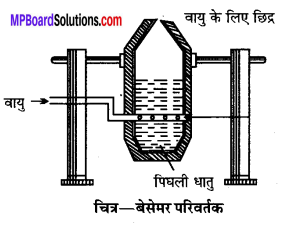
4. बेसेमरीकरण (Bessemerization) – प्रगलन की क्रिया से प्राप्त द्रवित मैट को थोड़ा सिलिका (रेत) मिलाकर बेसेमर परिवर्तक में भर देते हैं। इस भट्ठी के भीतरी सतह पर चूने या मैग्नीशियम ऑक्साइड (MgO) का अस्तर लगा होता है। इसके बाजू में काफी ऊँचाई पर ट्वीयर (tuyer) द्वारा हवा भेजी जाती है।
मैट में उपस्थित FeS, FeO में परिवर्तित हो जाता है। Feo रेत से क्रिया करके धातुमल FeSiO3, बनाता है। यह धातुमल बेसेमर परिवर्तक की ऊपरी सतह पर तैरने लगता है, इसे बाहर निकाल लिया जाता है।
पिघली धातु dirty
2FeS + 3O2 → 2FeO + 2SO2
FeO + SiO2 → FeSiO3 (धातुमल)
क्यूप्रस सल्फाइड का कुछ भाग ऑक्सीकृत होकर क्यूप्रस ऑक्साइड बनाता है, जो बचे हुए Cu2s से क्रिया करके Cu देता है।
2Cu2S + 3O2→ 2Cu2O + 2SO2
Cu2S + 2Cu2O→ 6Cu+ SO2
बेसेमर परिवर्तक को उल्टा कर ताँबे को निकाल लिया जाता है। इस प्रकार प्राप्त पिघली हुई धातु में बहुत-सी SO2 गैस रहती है। जब धातु को ठण्डा किया जाता है तो SO2 गैस बुलबुलों के रूप में निकलती है। इस प्रकार कॉपर धातु की सतह पर छोटे-छोटे छिद्र हो जाते हैं और यह फफोलेदार ताँबा (Blister copper) कहलाता है। इसमें 98% शुद्ध कॉपर होता है। .
5.शोधन-दो विधियों द्वारा शोधन किया जाता है –
(a) विद्युत्-अपघटनी विधि। (b) प्रदण्डन विधि।
विद्युत्-अपघटनी विधि-अति शुद्ध धातु प्राप्त करने के लिए एक बड़ी टंकी में 15% CuSO4 और 5% H2SO4 विलयन भरकर तथा अशुद्ध Cu धातु की मोटी प्लेटों का ऐनोड और शुद्ध Cu धातु की पतली प्लेटों का कैथोड लगाकर विद्युत्-अपघटन करते हैं। कैथोड पर 99.9% शुद्ध ताँबा प्राप्त होता है।
प्रश्न 7.
जिंक के निष्कर्षण की ऊर्ध्वाधर रिटॉर्ट विधि का नामांकित चित्र बनाइये।
अथवा, जस्ते के प्रमुख अयस्क कौन-कौन से हैं ? किसी अयस्क से जिंक धातु के निष्कर्षण की आधुनिक विधि का वर्णन कीजिए।
उत्तर
जस्ते के अयस्क – (i) जिंक ब्लैण्ड ZnS, (ii) कैलामाइन ZnCO3, (iii) विलैमाइट ZnSiO4.
धातु निष्कर्षण की आधुनिक विधि-जिंक ब्लैण्ड तथा कैलामाइन अयस्कों से प्रायः धातु का निष्कर्षण किया जाता है।
1. सान्द्रण-जिंक ब्लैण्ड अयस्क का सान्द्रण झाग उत्प्लावन विधि से करते हैं।
2. भर्जन-सान्द्रित अयस्क को वायु की अधिकता में भर्जित करने से अयस्क ZnO में परिवर्तित हो जाता है। कुछ ZnS, ZnSO4 में परिवर्तित होते हैं, जो ZnO में अपघटित हो जाता है।
2ZnS + 3O2 → 2ZnO + 2SO2(g)
ZnS + 2O2 → ZnSO4
2ZnSo4 → 2ZnO + 2SO2(g) + O2(g)
कैलामाइन अयस्क केवल निस्तापन से ही ZnO बनाता है।
ZnCO3 → ZnO + CO2(g)
3. अपचयन- भर्जित या निस्तापित अयस्क को कोक से साथ ऊर्ध्वाधर रिटॉर्ट में रखकर प्रोड्यूसर गैस द्वारा 140°C तक गर्म किया जाता है, जिससे ZnO का Zn में अपचयन हो जाता है। प्राप्त Zn वाष्प को संघनित्र में एकत्रित करते हैं। इस प्रकार प्राप्त Zn को स्पेल्टर कहते हैं। इसमें Pb, As, Fe, Si, Cd और C की अशुद्धियाँ होती हैं और शेष 97.8% Zn होता है।
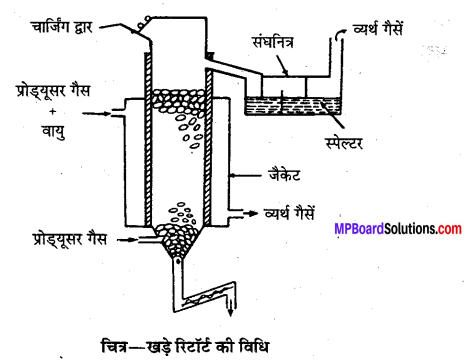
4. शोधन-अतिशुद्ध Zn विद्युत्-अपघटनी विधि द्वारा प्राप्त किया जाता है। इसमें अम्लीय ZnSO4 विलयन विद्युत्-अपघटन का कार्य करता है। प्राप्त अशुद्ध Zn ऐनोड तथा शुद्ध Zn छड़ कैथोड का कार्य करता है। विद्युत् धारा प्रवाहित करने पर शुद्ध Zn कैथोड पर एकत्रित होता है। यह लगभग 99.98% शुद्ध होता है।
![]()
प्रश्न 8.
क्या होता है जब (केवल समीकरण दीजिए) –
(i) नीले थोथे को गर्म किया जाता है।
(ii) सिल्वर नाइट्रेट के विलयन में अमोनियम हाइड्रॉक्साइड मिलाया जाता है।
(iii) स्टैनस क्लोराइड के विलयन में मरक्यूरिक क्लोराइड मिलाया जाता है।
(iv) ताँबा गर्म व सान्द्र नाइट्रिक अम्ल से क्रिया करता है।
(v) मरक्यूरिक क्लोराइड की KI से अभिक्रिया होती है।
(vi) मरक्यूरिक क्लोराइड पोटैशियम आयोडाइड से किया करता है।
(vii) सिल्वर नाइट्रेट हाइड्रोक्लोरिक अम्ल से क्रिया करता है।
(viii) सिल्वर नाइट्रेट को गर्म किया जाता है।
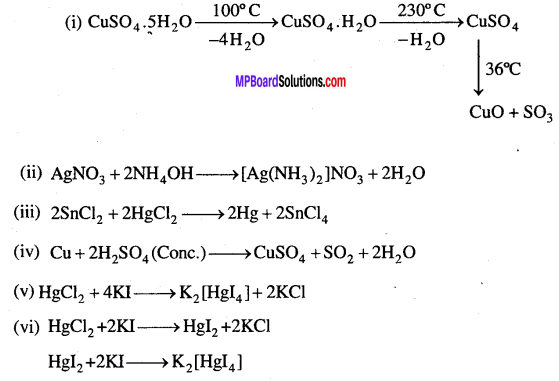
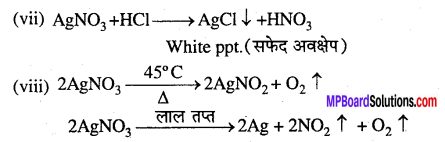
प्रश्न 9.
शुद्ध ऐल्युमिनियम धातु प्राप्त करने के विद्युत्-अपघटन विधि का नामांकित चित्र सहित वर्णन कीजिए।
उत्तर
Al धातु प्राप्त करने की विद्युत्-अपघटन विधि-उपयुक्त विधि से प्राप्त शुद्ध Al2O3, का गलनांक 2050°C होता है अत: इसमें थोड़ा-सा क्रायोलाइट (Na3AlF6) तथा कैल्सियम फ्लोराइड (CaF2) के संगलित मिश्रण घोल दिया जाता है जिससे (Al2O3) का गलनांक कम हो जाता है तथा विद्युत् चालकता बढ़ जाती है।
हॉल एवं हैराल्ट द्वारा विकसित विधि में एक खुली लोहे की टंकी जिसके भीतर कार्बन का अस्तर लगा होता है जो कैथोड का कार्य करता है कई कार्बन की छड़ों को विद्युत् अपघटन में लटका दिया जाता है जो एनोड का कार्य करते हैं। विद्युत् धारा प्रवाहित करने पर क्रायोलाइट (Na3AlF6) पिघलकर अपने में (Al2O3) को घोल लेता है विद्युत् धारा के प्रवाह से उत्पन्न ताप 900-950°C पर मिश्रण में घुले हुए Al2O3, Al और ऑक्सीजन में अपघटित हो जाता है। जिसमें Al कैथोड पर तथा O2 एनोड पर मुक्त हो जाता है।
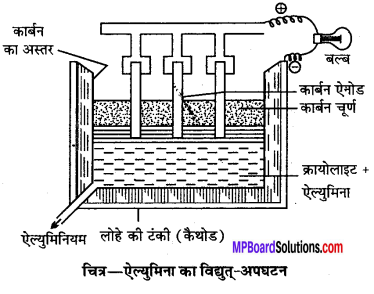
क्रायोलाइट (Na3AlF6) में उपस्थित फ्लोराइड निम्न प्रकार से आयनित होते हैं

इस प्रकार, ऐल्युमिनियम आयन (Al3+) कैथोड पर AI धातु के रूप में और F आयन एनोड पर फ्लोरीन के रूप में मुक्त होते हैं। एनोड में मुक्त F ,Al2O3 से क्रिया करके AlF3 बनाता है।
इस प्रकार वास्तव में ऐल्युमिना का ही विद्युत्-अपघटन होता है और इस प्रकार एनोड पर मुक्त O2 का कुछ भाग कार्बन एनोड से क्रिया करके CO बनाती है। जिसके कारण कार्बन एनोड को बार-बार बदलना पड़ता है जब Al2O3 की मात्रा एक निश्चित स्तर से गिर जाती है तो सेल का प्रतिरोध बढ़ जाता है, तो समान्तर क्रम में जुड़ा हुआ बल्ब जलने लगता है उस समय Al2O3 की और अधिक मात्रा मिला दी जाती है। कैथोड पर मुक्त हुआ Al पिछली अवस्था में टंकी के तली से एकत्र होता है जिसे निकास द्वार से समय-समय पर निकाल लेते हैं। पिघले हुए क्रायोलाइट और एल्युमिना के मिश्रण के ऊपर कोक का चूर्ण डाल देते हैं जो उसे ठण्डा नहीं होने देता तथा इससे आँखों को चमक भी कम लगती है। इस विधि से 99% शुद्ध Al धातु प्राप्त होता है।