In this article, we will share MP Board Class 12th Chemistry Solutions Chapter 2 विलयन Pdf, These solutions are solved subject experts from the latest edition books.
MP Board Class 12th Chemistry Solutions Chapter 2 विलयन
विलयन NCERT पाठ्यनिहित प्रश्न
प्रश्न 1.
यदि 22g बेन्जीन 122g कार्बन टेट्राक्लोराइड में घुली हुई है, तब बेन्जीन (C6H6) एवं कार्बन टेट्राक्लोराइड (CCl4) का द्रव्यमान प्रतिशत की गणना कीजिए।
हल
विलयन का द्रव्यमान = बेन्जीन का द्रव्यमान +CCl4 का द्रव्यमान
= 22g + 122g = 144g
(a)

बेन्जीन का द्रव्यमान % = 15.28%.
(b)

CCl4 का द्रव्यमान % = 84.72%
या
CCl4 का द्रव्यमान % = 100-15.28
CCl4 का द्रव्यमान % = 84.72%.
प्रश्न 2.
बेन्जीन विलयन में 30% द्रव्यमान की दृष्टि से कार्बन टेट्राक्लोराइड है, तब बेन्जीन मोल प्रभाज की गणना कीजिए।
उत्तर
हल- A → बेन्जीन : B → CCl4
A → Benzene : B → CCl4
WA = 30g
MA = 78g
WB = 70g
MB = 154g
nA = \(\frac{\mathrm{W}_{\mathrm{A}}}{\mathrm{M}_{\mathrm{A}}}=\frac{30}{78} = 0.38\)
nB =\( \frac{\mathrm{W}_{\mathrm{B}}}{\mathrm{M}_{\mathrm{B}}}=\frac{70}{154} = 0.45\)
XA = \(\frac{n_{\mathrm{A}}}{n_{\mathrm{A}}+n_{\mathrm{B}}}=\frac{0.38}{0.38+0.45}\) = 0.46g
XB =1-XA = 0.54.
प्रश्न 3.
निम्न विलयनों में प्रत्येक की मोलरता की गणना कीजिए
(a) 30g CO(NO3), 6H2O 4:3L विलयन में
(b) 30g ml 0.5 MH2SO4 500 ml तक तनु करते हैं।
हल
(a) CO(NO3), 6H2O का मोलर द्रव्यमान = MB = 29
CO(NO3), 6H2O का WB = 30g,
Vsol 4.3L = 4300ml
M = \(\frac{30 \times 1000}{291 \times 4300}\) = 0.024.
(b) तनुता के बाद विलयन की मोलरता की गणना कर सकते हैं
M1V1 (सान्द्रण)= M2V2 (तनुता)
0.5 ×30 = M2 × 500
M2 = \(\frac{0.5 \times 30}{500}\) = 0.03.
प्रश्न 4.
यूरिया (NH2CONH2) के द्रव्यमान की गणना कीजिए, जिसके 2.5kg के 0.25 मोलल जलीय विलयन बनाने के लिए आवश्यक है।
हल
0.25 मोलल विलयन का अर्थ है, 0.25 मोल यूरिया 1000g जल में है।
यूरिया का द्रव्यमान = 0.25 × 60 = 15g
विलयन का कुल द्रव्यमान = 1000 + 15 = 1015g
= 1.015kg
1.015 kg विलयन में यूरिया है = 15g.
2.5 kg विलयन में यूरिया की आवश्यकता होगी,
= \(\frac{15 \times 2.5}{1 \cdot 015}\) = 36.94g.
प्रश्न 5.
गणना कीजिए (a) मोललता, (b) मोलरता एवं (c) KI का मोल प्रभाज यदि 20% (द्रव्यमान/द्रव्यमान ) जलीय KI का घनत्व 1.202 gmL-1 है।
हल-
(a) M = \(\frac{\% \times d \times 10}{M_{B}}\) = MB = 166
M = \(\frac{20 \times 1.202 \times 10}{166}\) = =1.45molL-1
(b) M = \(\frac{\mathrm{W}_{\mathrm{B}} \times 1000}{\mathrm{M}_{\mathrm{B}} \times \mathrm{W}_{\mathrm{A}}}\), MB = 20, WA = 80
m = \(\frac{20 \times 1000}{166 \times 80}\) = 1.5 kgmol-1
(c)
KI के मोल = 0.120
H2O के मोल = \(\frac{80}{18}\) = 4.44
Xkl = \(\frac{0.120}{4.44+0.120}\) = 0.0263.
प्रश्न 6.
H2S सड़े अण्डे जैसी गंध वाली जहरीली गैस है, जिसका उपयोग गुणात्मक विश्लेषण में करते हैं। यदि STP पर H2S की जल में विलेयता 0.195 m है, हेनरी नियम स्थिरांक की गणना कीजिए।
हल
0.195 M विलयन का अर्थ है, 0.195 मोल H2S 1kg जल में विलेय है।
H2S के मोल = 0.195
जल के मोल = \(\frac{1000}{18}\) =55.55
H2S का मोल प्रभाज = \(\frac{0.195}{55.55+0.195}\) = 0.0035
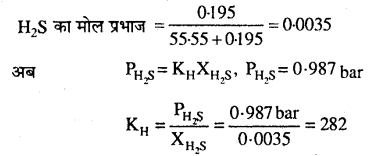
प्रश्न 7.
298K पर CO2 का जल में हेनरी नियम स्थिरांक 1.67×108 pa है। 500 ml सोडा वाटर में CO2 की मात्रा की गणना कीजिए, जबकि इसे 298K एवं 2.5 atm. दाब पर CO2 को भरा गया है।
हल- हेनरी नियम के अनुसार,
P= KHX…………. (i)
P2 = 2.5atm = 2.5 × 101325 Pa
KH = 1.67 × 108 Pa
इन मानों को समी. (i) में रखने पर, हमें प्राप्त होगा,
2.5 ×101325 = 1.67 × 10% ×X
X = 1.517 × 10-3
\(\mathrm{X}_{\mathrm{CO}_{2}}=\frac{n_{\mathrm{CO}_{2}}}{n_{\mathrm{H}_{2} \mathrm{O}}+n_{\mathrm{CO}_{2}}}=\frac{n_{\mathrm{CO}_{2}}}{n_{\mathrm{H}_{2} \mathrm{O}}}
n_{\mathrm{H}_{2} \mathrm{O}}=\frac{500}{18}\) = 27.77
अतः समी. (ii) से हमें प्राप्त होता है।
1.517×101-3 = \(\frac{n_{\mathrm{CO}_{2}}}{27 \cdot 77}\)
\(n_{\mathrm{CO}_{2}}\) = 0.042mol.
प्रश्न 8.
350K पर शुद्ध द्रवों A एवं B का वाष्पदाब क्रमशः 450 एवं 700 mm Hg हैं। यदि कुल वाष्पदाब 600mm Hg हो, तब द्रव मिश्रण का संघटन ज्ञात कीजिए, वाष्प प्रावस्था में संघटन भी ज्ञात कीजिए।


प्रश्न 9.
298K पर शुद्ध जल का वाष्पदाब 23-8mm Hg है। 50g यूरिया (NH,CONH) को 850g जल में घुला हो, तब इस विलयन में जल के वाष्प दाब एवं इसके आपेक्षिक अवनमन की गणना कीजिए। .
हल
हमें ज्ञात है,
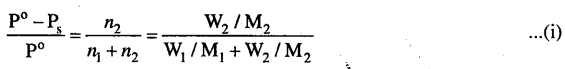
यहाँ P° = 23.8mm, W2 = 50g,
M2 (यूरिया) = 60g mol-1
W1 = 850g, M1 (जल) = 18g mol-1
हमारा उद्देश्य P एवं p° – Ps/P° की गणना करना है।
मानों को समी. (i) में रखने पर
\(\frac{P^{0}-P_{s}}{P^{0}}\) = \(\frac{50 / 60}{850 / 18+50 / 60}=0 \cdot 017\)
वाष्प दाब में आपेक्षिक अवनमन 0.017 है
P° = 23.8mm को रखने पर हमें प्राप्त होगा,
\(\frac{23 \cdot 8-P_{S}}{23 \cdot 8}=0 \cdot 017\)
23.8 Ps = 0.412
Ps= 23:39
अतः विलयन में जल का वाष्प दाब = 23-4 mm.
प्रश्न 10.
750 mmHg पर जल का क्वथनांक 99.63°C है। 500g जल में कितना सुक्रोस मिलावे, कि यह जल 100°C पर क्वथन करें।
हल
ΔTb = 100 – 99.63 = 0.37
आवश्यक सुक्रोस की मात्रा की गणना निम्न व्यंजक से गणना कर सकते हैं
ΔTb = \(\frac{\mathrm{K}_{b} \times \mathrm{W}_{\mathrm{B}} \times 1000}{\mathrm{M}_{\mathrm{B}} \times \mathrm{W}_{\mathrm{A}}}\)
Kb = 0.52kgmol-1,MB = 342gmol-1,
WA = 500g, ΔTb = 0.37
इन मानों को समी. (i) में रखने पर, हमें प्राप्त होगा –
0.37 = \(\frac{0.52 \times \mathrm{W}_{\mathrm{B}} \times 1000}{342 \times 500}\)
342×500
wB = 121.67g.
प्रश्न 11.
एस्कॉर्बिक अम्ल (विटामिन C,CH,08)) के द्रव्यमान की गणना कीजिए, जिसे 75g एसीटिक अम्ल में घोलने पर गलनांक 1.5°C कम होवे।kf = 3.9k kg mol-1.
हल
हमें ज्ञात है,
ΔTf = \(\frac{\mathbf{K}_{f} \times 1000}{\mathbf{M}_{\mathbf{B}} \times \mathbf{W}_{\mathbf{A}}}\)
दिया गया है, ΔTb =1.5, Kf = 3.9Kkg mol-1,
WA = 75g
MB (एस्कॉर्बिक अम्ल C6H8O6)
= 6 × 12 + 8 + 16 × 8 =176
इन मानों को समी (i) में रखने पर
1.5 = \(\frac{3.9 \times \mathrm{W}_{\mathrm{B}} \times 1000}{176 \times 75}\)
WB = 5.077g.
प्रश्न 12.
उस विलयन के परासरण दाब की पास्कल में गणना कीजिए, जिसे 1.0g बहुलक, जिसका मोलर द्रव्यमान 185,000 है को 37°C पर 450 ml जल में घोला गया है।
हल
हमें ज्ञात है, π = CRT =\(\frac { n }{ v }\) RT
π = \(\frac{1 \cdot 0}{185,000}\)
V= 450ml, T = 273+37 =310K
R = 8:314 × 103 PaLmol-1K-1
π = \(\frac{1 \times 8.314 \times 10^{3} \times 310}{185,000 \times \frac{450}{1000}}\)
π = 30.96 Pa
विलयन NCERT पाठ्य-पुस्तक प्रश्नोत्तर
प्रश्न 1.
विलयन को परिभाषित कीजिए। कितने प्रकार के विलयन बनाए जा सकते हैं ? प्रत्येक प्रकार के विलयन को उदाहरण देकर समझाइये।
उत्तर
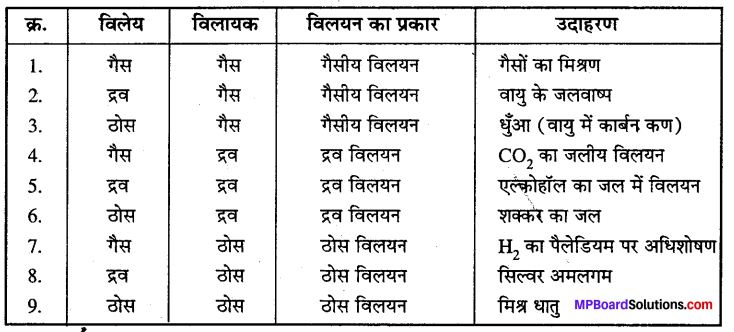
विलयन – दो या दो से अधिक अक्रियाशील पदार्थों का समांगी मिश्रण होता है। जिसके रासायनिक संघटन को कुछ सीमा तक परिवर्तित किया जा सकता है। प्रत्येक विलयन में दो घटक विलायक तथा विलेय होते हैं।
विलयन के प्रकार – भौतिक अवस्था के आधार पर विलयन के तीन प्रकार होते हैं। जिन्हें पुनः तीन वर्गों में वर्गीकृत किया जा सकता है –
प्रश्न 2.
माना दो पदार्थों के बीच ठोस विलयन बनता है, जिनमें से एक के कण अत्यधिक बड़े तथा दूसरे के कण अत्यधिक छोटे हैं। किस प्रकार का ठोस विलयन संभव है ?
हल- अन्तराकाशी ठोस विलयन।
प्रश्न 3.
निम्न को परिभाषित कीजिए –
(i) मोल प्रभाज
(ii) मोललता
(iii) मोलरता
(iv) द्रव्यमान प्रतिशत।
उत्तर
(i) मोल प्रभाज (Mole fraction)-किसी विलयन में उपस्थित किसी अवयव (विलायक या विलेय) के मोलों की संख्या तथा विलयन में उपस्थित कुल मोलों की संख्या के अनुपात को मोल प्रभाज कहते हैं।
यदि विलेय के मोलों की संख्या n व विलायक के मोलों की संख्या N हो, तो
विलेय का मोल प्रभाज = \(\frac{n}{n+N} \)
विलायक का मोल प्रभाज = \(\frac{n}{n+N} \)
(ii) मोललता (Molality)-“किसी विलयन की मोललता प्रति 1000 ग्राम विलायक में घुले विलेय पदार्थ के मोलों की संख्या है।” इसे m द्वारा प्रदर्शित करते हैं।

(iii) मोलरता (Molarity) – “किसी विलयन की मोलरता उसके एक लीटर में घुले विलेय पदार्थ के मोलों की संख्या है।” इसे M द्वारा दर्शाते हैं।

(iv) द्रव्यमान प्रतिशत (Percentage by mass)-किसी विलयन की द्रव्यमान प्रतिशतता द्रव्यमान के अनुसार विलेय के भागों की वह संख्या है, जो द्रव्यमान के अनुसार विलयन के 100 भागों में उपस्थित रहती है। साधारणतः विलेय का ग्रामों में वह द्रव्यमान जो 100 ग्राम विलयन में उपस्थित रहता है, द्रव्यमान प्रतिशतता कहलाता है।

किसी द्विअंगी विलयन के लिए WA विलायक का द्रव्यमान एवं WBविलेय का द्रव्यमान हो, तो
विलायक (A) का द्रव्यमान % = \(\frac{\mathrm{w}_{\mathrm{A}}}{\mathrm{W}_{\mathrm{A}}+\mathrm{W}_{\mathrm{B}}} \times 100\)
इसी भाँति,
विलेय (B) का द्रव्यमान % = \(\frac{\mathrm{w}_{\mathrm{B}}}{\mathrm{W}_{\mathrm{A}}+\mathrm{W}_{\mathrm{B}}} \times 100\)
इसे (W/W) से व्यक्त किया जाता है। उदाहरणार्थ- 10% Na2CO3 (W/W) का अर्थ है कि 100 ग्राम विलयन में 10 ग्राम Na2CO3 उपस्थित है (अर्थात् 10g Na2CO3 को 90g जल में विलेय किया गया है।)
प्रश्न 4.
प्रयोगशाला में उपयोग लाए जाने वाले नाइट्रिक अम्ल जलीय विलयन में द्रव्यमान की दृष्टि से 68% होता है। यदि विलयन का घनत्व 1.504gmL-1 हो, तो इस अम्ल के सेम्पल की मोललता क्या होगी?
हल
विलयन की मोललता निम्न के उपयोग से गणना की जा सकती है –
M = \(\frac{\% \times d \times 10}{M_{B}}\) ; % = 68;d = 1.504g mol-1,
MB= 63
M = \(\frac{68 \times 1.504 \times 10}{63}\) = 16.23M.
प्रश्न 5.
जल में ग्लूकोस के विलयन पर 10% W/W लिखा है, तब विलयन में प्रत्येक अवयव की मोललता एवं मोल प्रभाज क्या होगा? यदि विलयन का घनत्व 1.2gmL-1 है, तब विलयन की मोलरता क्या होगी?
हल-
10% (W/w) ग्लूकोस का अर्थ है- 10g ग्लूकोस 100g विलयन में है, i.e., 90 g जल = 0.090 kg जल
nग्लूकोस = \(\frac{10}{180}\) = 0.05555mol,
\(n_{\mathrm{H}_{2} \mathrm{O}}\) = \(\frac{90}{18}\) = 5 mol.

प्रश्न 6.
1g Na2CO3, एवं NaHCO3 के मिश्रण से पूर्ण क्रिया कराने के लिए 0.1M HCl के कितने ml की आवश्यकता होगी, जबकि मिश्रण में दोनों सम आण्विक मात्रा में हैं ?
हल
माना यहाँ xg Na2CO3 एवं (1 – x) g NaHCO3 मिश्रण में है –
Na2CO3 का मोलर द्रव्यमान = 106 g/mol
NaHCO3 का मोलर द्रव्यमान = 84g/mol
Na2CO3 के मोलों की संख्या = NaHCO3 के मोलों की संख्या
\(\frac{x}{106}\) = \(\frac{(1-x)}{84}\)
हल करने पर x= 0.56.
Na2CO3के मोलों की संख्या = NaHCO3 के मोलों की संख्या
=5.283 x 10-3
उदासीनीकरण प्रक्रम की अवधि, निम्न अभिक्रिया होती है –
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
NaHCO3 + HCl + NaCl + H2O +CO2↑
आवश्यक HCl के मोलों की संख्या
= 2 × Na2CO3 के मोलों की संख्या + NaHCO3 के मोलों की संख्या
= 2 × 5.283 × 10-3 + 5.283 × 10-3
= 0.0158
अब
M =\(\frac{n_{B} \times 1000}{V}\)
V = \(\frac{0.0158 \times 1000}{0.1}\) = 158ml.
प्रश्न 7.
द्रव्यमान की दृष्टि से 25% विलयन के 300g एवं 40% के 400g को मिलाने पर प्राप्त विलयन के द्रव्यमान प्रतिशत की गणना कीजिए।
हल
25% विलयन के 300 g में विलेय है = 75g
40% विलयन के 400 g में विलेय है = 160g
कुल विलेय = 160 + 75 = 235g
कुल विलयन = 300 + 400 = 700g
विलेय का द्रव्यमान % =\(\frac{235}{700}\) × 100 = 33.5%
जल का द्रव्यमान % = 100 – 33.5 = 66.5%.
प्रश्न 8.
222.6 g एथिलीन ग्लाइकॉल (C2H6O2) एवं 200g जल को मिलाने पर एण्टीफ्रिज विलयन बनता है। विलयन की मोललता की गणना कीजिए। यदि विलयन का घनत्व 1.072 gmL-1 हो, तब विलयन की मोलरता क्या होगी?
हल
विलेय C2H4(OH)2 का द्रव्यमान = 222.6g, विलेय का मोलर द्रव्यमान = 62 g mol-1
∴ विलेय के मोल =\(\frac{222 \cdot 6}{62}\) = 3.59
विलायक का द्रव्यमान = 200g = 0.2kg
m=\(\frac{3.59}{0.2}\)molkg-1
विलयन का कुल द्रव्यमान = 222.6 + 200 = 422.6g .
∴विलयन का आयतन = \(\frac{422.6}{1.072}\)
= 394.2 ml = 0.3942 L
M=\(\frac{3 \cdot 59}{0.3942}\) = 9.11molL-1.
प्रश्न 9.
एक पेयजल के सेम्पल में क्लोरोफॉर्म (CHCl3) सहित अनेक अशुद्धियाँ पाई जाती हैं, माना ये कासनोजन है। इन अशुद्धियों का लेवल 15 ppm (द्रव्यमान की दृष्टि से) था।
(i) इसे द्रव्यमान के प्रतिशत में दर्शाइए।
(ii) जल के सेम्पल में क्लोरोफॉर्म की मोललता ज्ञात कीजिए।
हल
15 ppm (द्रव्यमान में) का अर्थ है- 15 g CHCl3 106 g विलयन में उपस्थित है।


प्रश्न 10.
ऐल्कोहॉल एवं जल के विलयन में आण्विक अन्तःक्रिया का क्या रोल होगा?
हल
एल्कोहॉल जल के साथ अन्तर आण्विक H-बंध बनाता है, इसलिए जल में ऐल्कोहॉल विलेय है।
प्रश्न 11.
क्या कारण है कि तापक्रम में वृद्धि से गैसें द्रव में कम विलेय होती हैं ?
हल-
अधिकतर गैसों की ताप में वृद्धि से द्रव में विलेयता घटती है, क्योंकि घुलना एक ऊष्माक्षेपी प्रक्रम है। गर्म करने पर घुली हुई गैसें विलयन से बाहर निकलती हैं।
प्रश्न 12.
हेनरी नियम को लिखते हुए कुछ प्रमुख अनुप्रयोग भी लिखिए।
हल
हेनरी का नियम-स्थिर ताप पर किसी विलायक के निश्चित आयतन में विलेय गैस का द्रव्यमान गैस के दाब के समानुपाती होता है, जिसके साथ वह विलायक साम्यावस्था में है।
यदि विलायक आयतन में विलेय गैस का द्रव्यमान m तथा साम्य दाब हो, तो
m = kp (जहाँ k एक स्थिरांक है।)
हेनरी के नियम के अनुप्रयोग (Applications of Henry’s law) –
1. कार्बोनिकृत पेय पदार्थों के उत्पादन में- मृदु पेय, सोडा वाटर, बीयर जैसे कार्बोनिकृत पेय पदार्थों (Carbonated beverages) को बनाते समय CO2 की विलेयता बढ़ाने के लिए उच्च दाब का उपयोग किया जाता है।’
2. रक्त में घुली गैसों के विनिमय में- श्वास के द्वारा अन्दर ली गई वायु में O2 का आंशिक दाब उच्च होता है, फेफड़ों में पहुँचकर यह हीमोग्लोबीन से संयुक्त होकर ऑक्सीहीमोग्लोबीन बनाती है। उतकों (Tissues) में ऑक्सीजन का आंशिक दाब तुलनात्मक रूप से कम होता है अत: ऑक्सीहीमोग्लोबीन से ऑक्सीजन मुक्त होकर कोशिका सक्रियण के लिए उपलब्ध हो जाती है।
3. गहरे समुद्र में गोताखोरी के लिए- गहरे समुद्र में गोताखोरी करते समय श्वसन के लिए संपीडित वायु का उपयोग किया जाता है। संपीडित वायु में O2 के अतिरिक्त N2 भी होती है जो सामान्य दाब पर रक्त में ज्यादा विलेयशील नहीं होती है किन्तु उच्च दाब पर N2 की रक्त में विलेयता बढ़ जाती है एवं N2 रक्त में घुल जाती है। रक्त में नाइट्रोजन की उच्च सान्द्रता के हानिकारक प्रभावों एवं बेण्ड्स को रोकने के लिए गोताखोरों द्वारा प्रयुक्त टैंक को हीलियम द्वारा तनु किए गए वायु (He = 11.7%, N2 = 56-2% एवं O2 = 32.9%) से भरते हैं।
4. बहुत ऊँचाई पर बहुत ऊँचाई पर O2 का आंशिक दाब सतह की तुलना में अत्यन्त कम होता है। परिणामस्वरूप पर्वतारोहियों के श्वसन द्वारा उनके रक्त एवं कोशिकाओं में उपस्थित ऑक्सीजन का सान्द्रण निम्न हो जाता है। रक्त में ऑक्सीजन की कमी पर्वतारोहियों को कमजोर बना देती है एवं वे ठीक-ठीक सोचने में भी असमर्थ होते हैं जिसे एनॉक्सिया (Anoxia) कहा जाता है।
5. जलीय जीवन में- वायु में उपस्थित ऑक्सीजन की जल में विलेयता के कारण ही नदी, समुद्र एवं झीलों में जलीय जीव-जन्तुओं का जीवन संभव हो पाता है।
प्रश्न 13.
एक विलयन में 6.56 x 10-3g एथेन है, तब एथेन का आंशिक दाब 1 bar है। यदि विलयन में 5.00 x 10-2g एथेन हो, तब गैस का आंशिक दाब क्या होगा?
हल
हेनरी नियम से, m = K × P
6.56 × 10-3g=K × 1 bar
K= 6-56 × 10-3g bar-1
अब यदि m = 5 × 10-2g, P= ?
प्रयुक्त करने पर, m’ =K × P’
5-00 × 10-2g = 6.56 × 10-3g bar-1 × P’
P =\(\frac{5 \cdot 00 \times 10^{-2}}{6 \cdot 56 \times 10^{-3}}\) = 7.62 bar
प्रश्न 14.
राउल्ट नियम से धनात्मक एवं ऋणात्मक विचलन का क्या अर्थ है, एवं Δmix चिन्ह किस प्रकार राउल्ट नियम से धनात्मक एवं ऋणात्मक विचलन से संबंधित है ?
उत्तर
धनात्मक विचलन-जब विलयन का वाष्प दाब, राउल्ट के नियम से प्राप्त वाष्प दाब से अधिक होता है, तो वह धनात्मक विचलन कहलाता है। दो घटक A तथा B से बने विलयन के लिए यदि विलेय और विलायक A-B के अन्तराकर्षण बल का मान विलेय (A-A) एवं विलायक (B-B) के अन्तराकर्षण बल के मान से कम हो तो विलेय और विलायक की निष्कासन की प्रवृत्ति का मान घटकों की शुद्ध अवस्था की तुलना में ज्यादा हो जाता है। अतः प्रत्येक घटक के आंशिक दाब का मान राउल्ट के नियम से प्राप्त होने वाले आंशिक दाब की तुलना में उच्च होता है।
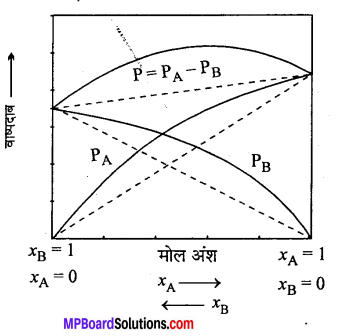
धनात्मक विचलन प्रदर्शित करने वाले विलयन के गुण
(i) \(\mathrm{P}_{\mathrm{A}}>\mathrm{P}_{\mathrm{A}}^{\circ} \mathrm{X}_{\mathrm{A}}\) एवं \(\mathrm{P}_{\mathrm{B}}>\mathrm{P}_{\mathrm{B}}^{\circ} \mathrm{X}_{\mathrm{B}}\)
(ii) ΔHmixing > 0 तब विचलन धनात्मक होता है।
(iii) ΔUmixing > 0 तब विचलन धनात्मक होता
उदाहरण – (1) एथिल एल्कोहॉल तथा जल, (2) एसीटोन तथा बेंजीन।
ऋणात्मक विचलन – जब विलयन का वाष्पदाब राउल्ट के नियम से प्राप्त वाष्प दाब से कम प्राप्त होता है तो यह ऋणात्मक विचलन कहलाता है। इस प्रकार के विलयनों में A-B (विलेय और विलायक) अन्तराकर्षण बल का । मान A-A (विलेय-विलेय) और B-B (विलायक-विलायक) के मध्य लगने वाले अन्तराकर्षण बल से प्रबल होता है। अतः विलयन में A और B (विलेय एवं विलायक) के अणुओं के निष्कासित होने की प्रवृत्ति शुद्ध घटकों की तुलना में कम होती है। अतः प्रत्येक घटक का विलयन में वाष्प दाब राउल्ट के नियम से प्राप्त होने वाले दाब से कम होता है।
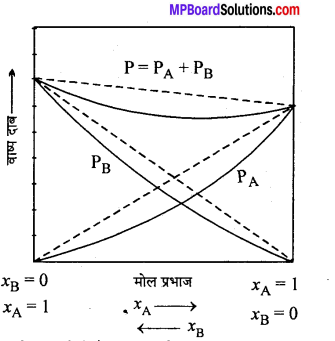
ऋणात्मक विचलन प्रदर्शित करने वाले विलयन के गुण –
(i) PA <\(\mathrm{P}_{\mathrm{A}}^{\circ} \mathrm{X}_{\mathrm{A}}\) तथा PB< \(\mathrm{P}_{\mathrm{B}}^{\mathrm{o}} \mathrm{X}_{\mathrm{B}}\)
(ii) ΔHmisxing <0 तब विचलन ऋणात्मक होता है।
(iii) Δmisxing <0 तब विचलन ऋणात्मक होता है।
उदाहरण – (1) HNO3 तथा जल, (2) क्लोरोफॉर्म तथा एसीटोन।
प्रश्न 15.
विलायक के सामान्य क्वथनांक पर एक 2% अवाष्पशील विलेय का जलीय विलयन 1.004 bar दाब प्रेक्षित करता है। विलेय का मोलर द्रव्यमान क्या होगा?
हल

प्रश्न 16.
हेप्टेन एवं ऑक्टेन आदर्श विलयन बनाते हैं। 373K पर दो द्रवों अवयवों का वाष्प दाब क्रमशः 105.2K Pa एवं 46.8 k Pa हैं। 26.0g हेप्टेन एवं 35g ऑक्टेन के मिश्रण का वाष्पदाब क्या होगा?
हल
हेप्टेन (C7H16),
द्रव्यमान = 26g
मोलर द्रव्यमान = 100
ऑक्टेन (C8H18)
द्रव्यमान = 35g .
मोलर द्रव्यमान = 114
मोलों की संख्या (n1) = \(\frac{26}{100}\) = 0.26
मोलों की संख्या (n2) = \(\frac{35}{114}\) = 0.31
मोल प्रभाज = X1 = \(\frac{n_{1}}{n_{1}+n_{2}}\) X2 = 1 – 0.456
X1 = \(\frac{0 \cdot 26}{0 \cdot 26+0 \cdot 31}\) X2 =0.544
X1 = 0.456
वाष्पदाब \(\mathrm{P}_{1}^{\mathrm{o}}\) = 105.2
\(\mathrm{P}_{2}^{\mathrm{o}}\) = 46.8
मिश्रण का वाष्प दाब (P) = \(\mathrm{P}_{1}^{\mathrm{o}} \mathrm{X}_{1}+\mathrm{P}_{2}^{\mathrm{o}} \mathrm{X}_{2}\)
P = 105.2 × 0.456 + 46.8 × 0.544
P = 42.97 + 25.46 = 73.43 kPa.
प्रश्न 17.
300K पर जल का वाष्पदाब 123kPa है, यदि इसके अवाष्पशील विलेय के 1 मोलल विलयन के वाष्पदाब की गणना कीजिए।
हल
1 मोलल विलयन का अर्थ है, विलेय का 1 मोल विलायक के 1 kg (जल) में उपस्थित है। …
∴ विलेय का मोल प्रभाज =\(\frac{1}{1+55.5}\) = 0-0177
अब, \(\frac{p^{0}-p_{s}}{p^{0}}=x_{2}\) , i.e. \(\frac{12 \cdot 3-P_{s}}{12 \cdot 3}=0 \cdot 0177\)
∴ Ps = 12.08 kPa.
प्रश्न 18.
उस अवाष्पशील विलेय (मोलर द्रव्यमान 40g mol-1) की गणना कीजिए जो 114g ऑक्टेन में घुलकर उसके वाष्पदाब को 80% कम कर देता है।
हल
राउल्ट के नियम से,
P= \(\mathrm{P}_{\mathrm{A}}^{\mathrm{o}} \mathrm{X}_{\mathrm{A}}\)
\(\mathrm{P}_{\mathrm{A}}^{\circ}\) = 100, P = 80
∴ समी. (i) से XA = 0.80
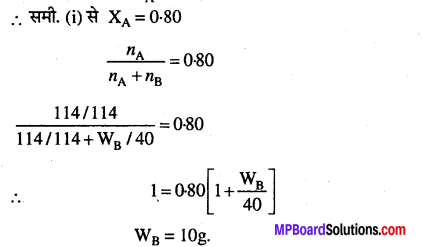
प्रश्न 19.
एक विलयन जिसे एक अवाष्पशील ठोस के 30g को 90g जल में विलीन करके बनाया गया है, इसका 298K पर वाष्पदाब 2.8kPa है, इसमें 18g जल मिलाने पर विलयन का नया वाष्पदाब 298K पर 2.9kPa हो जाता है, तब गणना कीजिए –
(i) विलेय का मोलर द्रव्यमान, (ii) 298K पर जल का वाष्पदाब।
हल
रॉउल्ट के नियम को लागू करने पर,
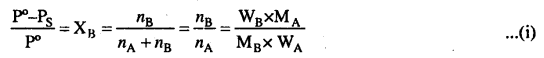
प्रथम प्रयोग से
जहाँ A = विलायक, B = विलेय
दिया गया है- WB = 30g, WA = 90g, Ps = 2.8kPa
MA = 18g mol-1
मानों को समी. (i) में रखने पर,

द्वितीय प्रयोग से
दिया गया है- WB = 30g, WA = 90 + 18 = 108g,
Ps = 2.9 kPa, MA = 18gmol-1
समी. (i) में मानों को रखने पर

समी. (iii) को समी. (ii) से भाग देने पर हमें प्राप्त होता है,
\(\frac{\mathrm{M}_{\mathrm{B}}-5}{\mathrm{M}_{\mathrm{B}}-6}\) = \(\frac{2 \cdot 9}{2 \cdot 8}\)
अथवा, 2.8(MB – 5) = 2.9 (MB – 6)
अथवा, 2.9 × 6 – 2.8 ×5 = MB (2.9 – 2.8)
अथवा, MB =\(\frac{3 \cdot 4}{0 \cdot 1}\) = 34g mol-1 …………………………….. (iv)
समी. (iv) से Mg का मान समी. (iii) में रखने पर हमें प्राप्त होता है,
\(\frac{34-5}{34} = \frac{2 \cdot 9}{\mathrm{P}^{\circ}}\)
अथवा, P0 =\( \frac{2 \cdot 9}{0.853}\) = 3.4kPa.
प्रश्न 20.
गन्ने के रस (Cane sugar) का जल में 5% विलयन का हिमांक बिन्दु 271K है। यदि शुद्ध जल का हिमांक बिन्दु 273.15K हो, तो जल में 5% ग्लूकोस के हिमांक बिन्दु की गणना कीजिए। हल-गन्ने की शर्करा के लिए,
ΔTf = 273.15-271-0 = 2.15°C
Kf = \(\frac{2 \cdot 15 \times 100 \times 342}{1000 \times 5}\)
= 14.706 KM -1
ग्लूकोस विलयन के लिए,
ΔTb = \(\frac{14706 \times 1000 \times 5}{100 \times 180}\) = 4.085K.
प्रश्न 21.
दो तत्व A एवं B यौगिक बनाते हैं, जिनका सूत्र AB2एवं AB4 है। यदि 20g बेन्जीन (C6H6) में घोल देवें, AB2 का 1g हिमांक बिन्दु में 2-3K का अवनमन करता है, जबकि 1g AB41:3K का अवनमन होता है। बेंजीन के लिए मोलर अवनमन स्थिरांक 5.1Kkg mol-1 A एवं B के परमाणु द्रव्यमान की गणना कीजिए।
हल
सूत्र को लागू करने पर,

माना A एवं B के परमाणु द्रव्यमान क्रमशः ‘a’ एवं ‘b’ हैं,
तब AB2 का मोलर द्रव्यमान = a+2b = 110.87g mol-1
AB4 का मोलर द्रव्यमान = a+4b = 196.15g mol-1
समी. (ii) से समी. (i) को घटाने पर –
2b = 85-28 अथवा b = 42.64
समी. (i) में रखने पर, हमें प्राप्त होगा, a + 2 × 42.64 = 110.8
अथवा a = 25.59
अतः A का परमाणु द्रव्यमान = 25.59u.
B का परमाणु द्रव्यमान = 42.6u.
प्रश्न 22.
300K पर 36g ग्लूकोस एक लीटर विलयन में उपस्थित है, इसका परासरण दाब 4.98 bar है। यदि समान ताप पर विलयन का परासरण दाब 1.52 bar हो, तो इसका सान्द्रण क्या होगा?
हल
हमें ज्ञात है- πV = nRT
प्रथम प्रकरण में, 4.98 × 1= \(\frac{36}{180} \)× R × T
द्वितीय प्रकरण में, 1:52 × 1 = \(\frac{\mathrm{W}}{180}\) × RT
समी (i) में समी. (ii) का भाग देने पर, हमें प्राप्त होगा,
\(\frac{4 \cdot 98}{1 \cdot 52}=\frac{36}{W}\)
w = 10.987g/L.
प्रश्न 23.
निम्न जोड़ों में प्रमुख अन्तर-आण्विक आकर्षण अन्तःक्रिया को समझाइये
(i) n-हेक्सेन एवं n-ऑक्टेन,
(ii) I2 एवं CCl4
(iii) NaClO4 एवं जल
(iv) मेथेनॉल एवं एसीटोन
(v) एसीटोनाइट्राइल (CH3CN) एवं एसीटोन (C3H6O)।
उत्तर-
(i) n-हेक्सेन एवं n- ऑक्टेन – परिक्षेपण अथवा लण्डन बल
(ii) I2 एवं CCl4 (दोनों अध्रुवीय हैं) – लण्डन अथवा परिक्षेपण बल
(iii) NaClO4 एवं जल (आयनिक) (ध्रुवीय) – आयन-द्विध्रुव अन्तर-क्रिया को आयन का जलयोजन (ध्रुवीय) कहते हैं।
(iv) मेथेनॉल एवं ऐसीटोन – द्विध्रुव-द्विध्रुव (ध्रुवीय)
(iv) एसीटोनाइट्राइल एवं ऐसीटोन (ध्रुवीय) – द्विध्रुव-द्विध्रुव (ध्रुवीय )।
प्रश्न 24.
विलेय-विलायक अन्तःक्रिया के आधार पर निम्न को n-ऑक्टेन में विलेयता के बढ़ते क्रम में व्यवस्थित कीजिए एवं समझाइए- चक्रीय हेक्सेन, KCl, CH3OH, CH3CN.
उत्तर
विलेयता के लिए हमें ज्ञात है Like dissolves like (समान-समान को घोलना), n-ऑक्टेन अध्रुवीय विलायक है, अतः अध्रुवीय यौगिक अधिक विलेय होते हैं।
KCl> CH3OH <CH3CN < चक्रीय हेक्सेन
प्रश्न 25.
निम्न में से कौन-सा यौगिक जल में अविलेय है, आंशिक विलेय है एवं अत्यधिक विलेय है, पहचान कीजिए.
(i) फीनॉल,
(i) टॉलुईन
(iii) फॉर्मिक अम्ल
(iv) एथिलीन ग्लाइकॉल
(v) क्लोरोफॉर्म
(vi) पेण्टेनॉल।
उत्तर
अत्यधिक विलेय -फॉर्मिक अम्ल एवं एथिलीन ग्लाइकॉल। ये जल के अणुओं के साथ Hबंध बनाने की क्षमता रखते हैं।
अविलेय -क्लोरोफॉर्म एवं टॉलुईन अध्रुवीय हैं, ये ध्रुवीय माध्यम जैसे-जल में अविलेय हैं। आंशिक विलेय-फीनॉल एवं पेन्टेनॉल जल के साथ दुर्बल H-बंध बनाते हैं, अतः ये आंशिक विलेय हैं।
प्रश्न 26.
झील के जल का घनत्व 1.25gmL-1 है एवं 92g Na+ आयन प्रति kg जल में हैं, झील में Na+ आयनों की मोललता की गणना कीजिए। .
हल
दिया गया है,
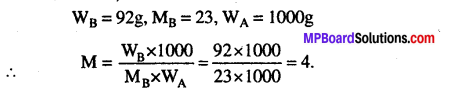
प्रश्न 27.
यदि CuS का विलेयता गुणनफल 6 × 10-16 है। जलीय विलयन में Cus की अधिकतम मोलरता की गणना कीजिए।
हल
दिया गया है,
Cus at Ksp = 6 × 10-16
यदि ‘S’ विलेयता है, तब
Cus ⇌ Cu2+ + S2-
[Cu2+] = S [Su2-] = S
Ksp = [Cu2+] [Su2-] = S2
∴ विलेयता S = \(\sqrt{\mathrm{K}_{s p}}\) = \(\sqrt{6 \times 10^{-16}}\) = 2.45 × 10-8M.
प्रश्न 28.
यदि 6.5g C9H8O4 450g CH3CN में घुली है, तब एसीटोनाइट्राइल (CH3CN) में एस्पिन (C9H8O4) के द्रव्यमान प्रतिशत की गणना कीजिए।
हल

प्रश्न 29.
नेलोरफिन (C19H21NO3) जो मार्फिन के समान है, का उपयोग स्वापक (Narcotic) उपभोक्ताओं द्वारा स्वापक छोड़ने से उत्पन्न लक्षणों को दूर करने के लिए करते हैं। सामान्यतः नेलोरफिन खुराक 1.5 mg दिया जाता है। उपरोक्त खुराक के लिए 1.5 x 10-m जलीय विलयन में आवश्यक द्रव्यमान की गणना कीजिए।

प्रश्न 30.
मेथेनॉल में 0.15M 250ml विलयन बनाने के लिए आवश्यक बेन्जोइक अम्ल (C6H5 COOH) की मात्रा की गणना कीजिए।
हल-हमें ज्ञात है M = \(\frac{\mathrm{w}_{\mathrm{B}} \times 1000}{\mathrm{M}_{\mathrm{B}} \times \mathrm{V}}\)
दिया गया है, M = 0.15, V = 250 ml, MB= 122
0.15 = \(\frac{\mathrm{W}_{\mathrm{B}} \times 1000}{122 \times 250}\)
WB = 4.575g.
प्रश्न 31.
प्रेक्षिप्त जल के हिमांक में अवनमन, समान मात्रा में एसीटिक अम्ल, ट्राईक्लोरो एसीटिक अम्ल एवं ट्राई फ्लुओरो एसीटिक अम्ल, में वृद्धि उपरोक्त दिए गए क्रम में होती है, विस्तृत रूप में समझाइये।
उत्तर-
एसीटिक अम्ल < ट्राइक्लोरो एसीटिक अम्ल < ट्राइफ्लुओरो एसीटिक अम्ल
कार्बोक्सिलिक समूह के साथ जुड़े समूहों के इलेक्ट्रॉन विकर्षी प्रभाव में वृद्धि से आयनन की मात्रा में वृद्धि होती है।
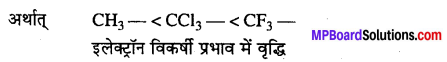
इलेक्ट्रॉन विकर्षी प्रभाव में वृद्धि हिमांक में अवनमन एक अणुसंख्यक गुणधर्म है । ट्राइफ्लुओरो एसीटिक अम्ल के आयनन से अधिक आयन उत्पन्न होते हैं, तब हिमांक में अवनमन अधिकतम होगा।
प्रश्न 32.
250g जल में 10g CH3CH2CHClCOOH को मिलाने पर जल के हिमांक में अवनमन की गणना कीजिए।
Ka = 1.4 x 10-13, Kf =1.86K kgmol-1.
हल- CH3CH2CHClCOOH का मोलर द्रव्यमान (MB)
(विलेय) = 122.5g mol-1.
WB = 10g.
nB = \(\frac{10}{122 \cdot 5}\) = 8.16 × 10-2mol
m = \(\frac{8.16 \times 10^{-2} \times 1000}{250}\)
= 0.3265m
यदि αCH3CH2 CHCl COOH के वियोजन की मात्रा है,
CH3CH2 CHCl COOH ⇌ CH3CH2 CHCl COO– + H+

प्रश्न 33.
500g जल में 19-5g CH2F COOH घुला है।जल में हिमांक में अवनयन 1.0°C प्रेक्षित हुआ, फ्लुओरो-एसीटिक अम्ल का वॉण्ट हॉफ गुणांक एवं वियोजन स्थिरांक की गणना कीजिए।
हल
CH2F COOH का आण्विक द्रव्यमान (MB ) = 78
WB = 19.5g, WA= 500g
m = \(\frac{\mathrm{W}_{\mathrm{B}} \times 1000}{\mathrm{M}_{\mathrm{B}} \times 500}\)=\(\frac{19.5 \times 1000}{78 \times 500}=0.50 \mathrm{m}\)
= 1.86 × 0.50 = 0.93K
वॉण्ट हॉफ कारक

प्रश्न 34.
293K पर जल का वाष्पदाब 17:535 mm Hg है। 25g ग्लुकोस को 450g जल में घोलकर 293K पर जल के वाष्पदाब की गणना कीजिए।
हल

प्रश्न 35.
298K पर मेथेन की बेन्जीन में मोललता का हेनरी नियम स्थिरांक 4.27x 105 mmHg है। 298K एवं 760mm Hg पर मेथेन की बेन्जीन में विलेयता की गणना कीजिए।
हल
जहाँ KH = 4.27 × 105 mm, P=760mm
हेनरी नियम को लागू करने पर, P = KHX
X = \(\frac{P}{K_{H}}=\frac{760}{4.27 \times 10^{5}}\) = 1.78 × 10-3
∴ बेन्जीन में मेथेन का मोल प्रभाज = 1.78 × 10-3
प्रश्न 36.
100g द्रव A (मोलर द्रव्यमान 140g mol-1) 1000g द्रव B (मोलर द्रव्यमान 180g mor’) में विलेय है।शुद्ध द्रव B का वाष्पदाब 500 torr प्राप्त होता है। यदि विलयन का कुल वाष्पदाब 475 torr है, तब शुद्ध द्रव A का वाष्प दाब एवं विलयन में इसके वाष्प दाब की गणना कीजिए।
हल:

प्रश्न 37.
328K पर शुद्ध ऐसीटोन एवं क्लोरोफॉर्म के वाष्पदाब क्रमश: 741.8 mm Hg एवं 632.8 mm Hg हैं। माना ये सभी संघटन पर आदर्श विलयन बनाते हैं।
PTotal, Pक्लोरोफॉर्म एवं Pएसीटोन को Xएसीटोन के फलन के रूप में ग्राफ खींचते हैं। मिश्रण के विभिन्न संघटनों पर प्रेक्षित प्रायोगिक आँकड़े है –
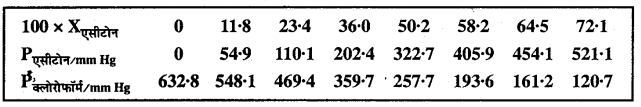
समान ग्राफ पेपर पर इन आँकड़ों को प्लाट करना है। तब यह बताना है ये आदर्श विलयन से धनात्मक विलयन अथवा ऋणात्मक विचलन दर्शाते हैं।
हल
From the question, we have the following data

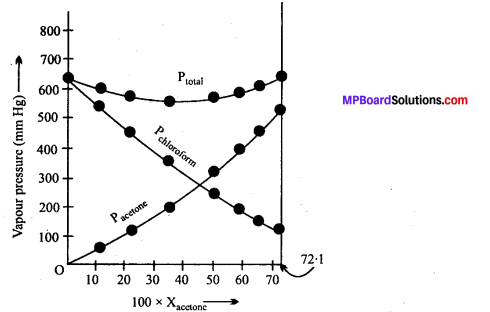
उक्त ग्राफ से देखा जा सकता है कि विलयन के PTotal के लिए प्लॉट निम्नवक्रीय है। अतः विलयन आदर्श व्यवहार से ऋणात्मक विचलन प्रदर्शित करता है।
प्रश्न 38.
सभी संघटनों पर बेन्जीन एवं टॉलुईन आदर्श विलयन बनाते हैं। शुद्ध बेन्जीन एवं टॉलुईन का 300 K पर वाष्पदाब क्रमशः 50.71mm Hg एवं 32.06mm Hg है। यदि 80g बेन्जीन को 100g टॉलुईन में मिलावें, तो वाष्य प्रावस्था में बेन्जीन के मोल प्रभाज की गणना कीजिए।
हल
A→ बेन्जीन (C6H6), B-→ टॉलुईन (C7H8)
बेन्जीन के मोलों की संख्या nA = \(\frac { 80 }{ 78 }\) = 1.026
टॉलुईन के मोलों की संख्या nB = \(\frac { 100 }{ 92 }\) = 1.087

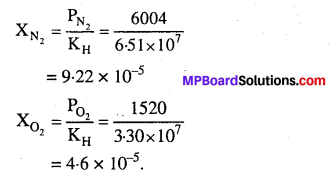
प्रश्न 39.
वायु अनेक गैसों का मिश्रण है। इनमें मुख्य अवयव 298K पर लगभग ऑक्सीजन एवं नाइट्रोजन 20% एवं 79% हैं। 10 atm. दाब पर जल एवं वायु साम्यावस्था में हैं। यदि 298K पर ऑक्सीजन एवं नाइट्रोजन के हेनरी नियम स्थिरांक क्रमश: 3.30 x 107 mmHg एवं 6.51 x 107 mm हों तो जल में इन गैसों का संघटन की गणना कीजिए।
हल
जल के ऊपर वायु का वाष्पदाब = 10 atm.
N2 एवं O2 आंशिक दाब
\(\mathrm{P}_{\mathrm{N}_{2}}\) =\(\frac{79 \times 10}{100}\) = 7.9 atm.
= 7.9 × 760 mm = 6004 mm Hg
\(P_{O_{2}}\)=\(\frac{20 \times 10}{100}\) = 2 atm.
= 2 × 760 mm Hg = 1520 mm Hg.
हेनरी नियम लागू करने पर,
\(\mathrm{P}_{\mathrm{N}_{2}}=\mathrm{K}_{\mathrm{H}} \mathrm{X}_{\mathrm{N}_{2}}\)
प्रश्न 40.
CaCl2 (i = 2.47) की मात्रा ज्ञात कीजिए, जब इसे 2.5 लीटर जल में घोला जाता है, इसका 27°C पर परासरण दाब 0.75 atm. है।
हल
CaCl2 के लिए, i = 2.47
π= iCRT
\(\pi=i \frac{n_{\mathrm{B}}}{\mathrm{V}} \mathrm{RT}\)
0.75 = \(\frac{2 \cdot 47 \times n_{\mathrm{B}} \times 0 \cdot 082 \times 300}{2 \cdot 5}\)
nB = \(\frac{0.75 \times 2.5}{2.47 \times 0.082 \times 300}\)
nB = 0.0308 mol.
प्रश्न 41.
25°C पर 25 mg K2SO4 को 2 लीटर जल में घोलने पर बने विलयन का वाष्प दाब ज्ञात कीजिए, मान लीजिए यह पूर्ण वियोजित हो जाता है।
हुल
πV= inBRT
π × 2 = 3 × \(\frac{0.025}{174}\) × 0.0821 × 298
π = 5.272 × 10-3 atm.
विलयन अन्य महत्वपूर्ण प्रश्नोत्तर
विलयन वस्तुनिष्ठ प्रश्न
1. सही विकल्प चुनकर लिखिए –
प्रश्न 1.
विलेय की मोलल सान्द्रता वाले विलयन का क्वथनांक उन्नयन सर्वाधिक होगा यदि विलायक –
(a) एथिल ऐल्कोहॉल है
(b) ऐसीटोन है
(c) बेन्जीन है
(d) क्लोरोफॉर्म है।
उत्तर
(c) बेन्जीन है
प्रश्न 2.
समान परासरण दाब वाले विलयन कहलाते हैं
(a) अतिपरासरी
(b) अल्पपरासरी
(c) समपरासरी
(d) नॉर्मल।
उत्तर
(c) समपरासरी
प्रश्न 3.
IM NaOH के 10 ml को उदासीन करने के लिए IM H2SO4 के कितने ml की आवश्यकता
होगी
(a) 20ml
(b) 2.5ml
(c) 5ml
(d) 10ml.
उत्तर
(c) 5ml
प्रश्न 4.
निम्नलिखित में से कौन राउल्ट नियम से धनात्मक विचलन नहीं दर्शाता है –
(a) बेन्जीन-क्लोरोफॉर्म
(b) बेन्जीन-ऐसीटोन
(c) बेन्जीन-एथेनॉल
(d) बेन्जीन-CCl4
उत्तर
(a) बेन्जीन-क्लोरोफॉर्म
प्रश्न 5.
H2SO4 के एक घोल, जिसमें 9.8 gm H2SO4, 2 लिटर जल में घुला है, की मोलरता है –
(a) 0.1M
(b) 0.05M
(c) 0.01M
(d) 0.2M.
उत्तर
(b) 0.05M
प्रश्न 6.
साधारण नमक को जल में घोलने पर –
(a) जल का क्वथनांक घट जाता है
(b) जल का क्वथनांक बढ़ जाता है
(c) कोई परिवर्तन नहीं होता हैं
(d) कुछ कहा नहीं जा सकता।
उत्तर
(b) जल का क्वथनांक बढ़ जाता है
प्रश्न 7.
जब रक्त कोशिकाएँ, कोशिका एक से अधिक परासरण वाले विलयन में रखी जाती है, तो –
(a) वे सिकुड़ जाती हैं
(b) वे फूल जाती हैं
(c) कोई प्रभाव नहीं होता
(d) पहले सिकुड़ती हैं बाद में फूलती हैं।
उत्तर
(a) वे सिकुड़ जाती हैं
प्रश्न 8.
सभी आदर्श विलयन बनाते हैं, केवल एक नहीं –
(a)C2H5Br वC2H5Cl
(b) C6H5Cl व C6H5Br
(c) C6H6 व C6H5CH3
(d) C2H5I व C2H5OH
उत्तर
(b) C6H5Cl व C6H5Br
प्रश्न 9.
राउल्ट के नियमानुसार एक अवाष्पशील विलेय के विलयन के लिए सापेक्ष वाष्प-दाब अवनमन बराबर है –
(a) विलायक के मोल प्रभाज के
(b) विलेय के मोल प्रभाज के ।
(c) विलायक के द्रव्यमान प्रतिशत के
(d) विलेय के द्रव्यमान प्रतिशत के।
उत्तर
(b) विलेय के मोल प्रभाज के ।
प्रश्न 10.
परासरण दाब (P), आयतन (V) व ताप (T) के लिए निम्नलिखित में से कौन-सा कथन असत्य है –
(a) Pr ∝ \(\frac{1}{V}\), यदि T स्थिर है
(b) P ∝T, यदि v स्थिर है
(c) P ∝ v, यदि T स्थिर है
(d) PV, यदि T स्थिर है।
उत्तर
(c) P∝ v, यदि T स्थिर है
प्रश्न 11.
किसका क्वथनांक 1 atm दाब पर अधिकतम होगा
(a) 0.1M ग्लूकोज
(b) 0.1M BaCl2
(c) 0.1M NaCl
(d) 0.1M यूरिया।
उत्तर
(b) 0.1M BaCl2
प्रश्न 12.
अर्द्धपारगम्य झिल्ली रासायनिक रूप से है –
(a) कॉपर फेरोसायनाइड
(b) कॉपर फेरीसायनाइड
(c) कॉपर सल्फेट
(d) पोटैशियम फोरोसायनाइड।
उत्तर
(a) कॉपर फेरोसायनाइड
प्रश्न 13.
निम्नलिखित में से कौन-सा अणुसंख्यक गुणधर्म है –
(a) पृष्ठ तनाव
(b) श्यानता
(c) परासरण दाब
(d) प्रकाशीय घूर्णन।
उत्तर
(c) परासरण दाब
प्रश्न 14.
एक विद्युत्-अपघट्य का प्रायोगिक अणुभार सदैव ही इसके परिकलित मान से कम होगा, क्योंकि वाण्ट हॉफ गुणांकां का मान होता है –
(a) 1 से कम
(b) 1 से अधिक
(c) 1 के तुल्य
(d) शून्य।
उत्तर
(b) 1 से अधिक
प्रश्न 15.
“मोलल विलयन” में विलेय पदार्थ का 1 मोल घुला रहता है –
(a) 1000gm विलायक में
(b) 1 लिटर विलयन में
(c) 1 लिटर विलायक में
(d) 22.4 लिटर विलयन में।
उत्तर
(a) 1000gm विलायक में
प्रश्न 16.
यदि विलयन का क्वथनांक T, तथा विलायक का क्वथनांक T, हो, तो क्वथनांक में उन्नयन होगा
(a) T1 + T2
(b) T1 – T2
(c) T2 – T1
(d) T 1T2.
उत्तर
(b) T1 – T2
प्रश्न 17.
अणुसंख्यक गुणधर्म है –
(a) मुक्त ऊर्जा में परिवर्तन
(b) दाब में परिवर्तन
(c) वाष्पन की ऊष्मा
(d) परासरण दाब।
उत्तर
(d) परासरण दाब।
प्रश्न 18.
एक विलयन की ग्राम मोललता है –
(a) प्रति 1000ml विलायक में विलेय के अणुओं की संख्या
(b) प्रति 1000 ग्राम विलायक में विलेय के अणुओं की संख्या
(c) प्रति 1000ml विलयन में विलेय के अणुओं की संख्या
(d) प्रति 1000ml विलायक में विलेय के ग्राम तुल्यांकों की संख्या।
उत्तर
(b) प्रति 1000 ग्राम विलायक में विलेय के अणुओं की संख्या
प्रश्न 19.
एक आदर्श विलयन वह है जो –
(a) राउल्ट नियम से नकारात्मक विचलन प्रदर्शित करता है
(b) राउल्ट नियम से सकारात्मक विचलन प्रदर्शित करता है
(c) राउल्ट नियम से कोई सम्बन्ध नहीं रखता है
(d) राउल्ट नियम का पालन करता है।
उत्तर
(d) राउल्ट नियम का पालन करता है।
प्रश्न 20.
समान मोलरता वाले BaCl2 NaCl तथा ग्लूकोज विलयनों के परासरण दाब का क्रम होगा –
(a) BaCl2 > NaCl > ग्लूकोज
(b) NaCl> BaCl2 > ग्लूकोज
(c) ग्लूकोज > BaCl2 > NaCl
(d) ग्लूकोज > NaCl> BaCl2
उत्तर
(a) BaCl2 > NaCl > ग्लूकोज
प्रश्न 21.
किसी विलेय के उसके विलयन में 20 mol है तथा मोलों की पूर्ण संख्या 80 है। विलेय का मोल प्रभाज होगा
(a) 2.5
(b) 0.25
(c) 1
(d) 0.75.
उत्तर
(b) 0.25
प्रश्न 22.
एक विलयन में जल का मोल तथा एथेनॉल के मोल हैं। इसमें जल एवं एथेनॉल का एक मोल प्रभाज होगा –
(a) 0.2 जल + 0.8 एथेनॉल
(b) 0.4 जल + 0.6 एथेनॉल
(c) 0.6 जल + 0.4 एथेनॉल
(d) 0.8 जल + 0.2 एथेनॉल।
उत्तर
(a) 0.2 जल + 0.8 एथेनॉल
प्रश्न 23.
किसी घोल के अणुसंख्यक गुण आधारित हैं –
(a) विलायक की प्रकृति पर
(b) विलेय की प्रकृति पर
(c) विलेय के कणों की संख्या पर
(d) इनमें से कोई नहीं।
उत्तर
(c) विलेय के कणों की संख्या पर
प्रश्न 24.
शुद्ध जल की मोलरता है –
(a) 55.6
(b) 50
(c) 100
(d) 18.
उत्तर
(a) 55.6
प्रश्न 25.
निम्न में से कौन-सा अणुसंख्यक गुण धर्म नहीं है –
(a) परासरण दाब
(b) वाष्पदाब पर अवनमन
(c) हिमांक अवनमन
(d) क्वथनांक उन्नयन।
उत्तर
(b) वाष्पदाब पर अवनमन
प्रश्न 26.
परासरण दाब ज्ञात करने का सूत्र है
(a) \(\pi=\frac{n \mathrm{RT}}{m}\)
(b) \(\mathrm{P}=\frac{n \mathrm{RT}}{\mathrm{V} d}\)
(c)\( \pi=\frac{n \mathrm{RT}}{\mathrm{V}}\)
(d) \(P=\frac{R T}{V}\)
उत्तर
(c) \(\pi=\frac{n \mathrm{RT}}{\mathrm{V}}\)
प्रश्न 27.
अणुसंख्यक के गुण के प्रेक्षित मान तथा अणुसंख्यक गुण के सैद्धान्तिक मान के अनुपात को कहते हैं –
(a) अणुसंख्यक गुण
(b) वाण्ट हॉफ गुणांक
(c) विलयन स्थिरांक
(d) विशिष्ट स्थिरांक।
उत्तर
(b) वाण्ट हॉफ गुणांक
प्रश्न 28.
निम्नलिखित में से कौन राउल्ट नियम से धनात्मक विचलन नहीं दर्शाता है –
(a) बेन्जीन-क्लोरोफॉर्म
(b) बेन्जीन-ऐसीटोन
(c) बेन्जीन-एथेनॉल
(d) बेन्जीन-CCl4
उत्तर
(d) बेन्जीन-CCl4
प्रश्न 29.
6 ग्राम यूरिया 180 ग्राम जल में उपस्थित है तो यूरिया का मोल प्रभाज होगा –
(a) \(\frac{10}{10-1}\)
(b) \(\frac{10-1}{10}\)
(c) \(\frac{0-1}{10-1}\)
(d) \(\frac{10-1}{0-1}\)
उत्तर
(c) \(\frac{0-1}{10-1}\)
2. रिक्त स्थानों की पूर्ति कीजिए
- विलयन में विलेय की सामान्य स्थिति दर्शाने वाले वाण्ट-हॉफ गुणांक का मान एक से ………. होगा।
- वाष्पदाब में आपेक्षिक अवनमन का व्यंजक ………. है।
- 1000gm विलायक में विलेय के मोलों की संख्या ……………….. कहलाती है।
- द्रव मिश्रण जो बिना संघटक परिवर्तन किये हुए उबलता है, उसे ………………….. कहते हैं।
- अर्द्धपारगम्य झिल्ली से केवल ………………….. के अणु पार हो सकते हैं।
- ऊँचे स्थानों पर जल का क्वथनांक घट जाता है, क्योंकि ऊँचे स्थलों पर वायुमण्डलीय दाब….. हो जाता है।
- जल की मोललता ……………… होती है।
- सोडा वाटर .. ………………… विलयन है।
- एक लीटर विलयन में उपस्थित विलेय के मोलों की संख्या ………….. कहलाती है।
- H2O+ C2H5OH का 95.4% अनआदर्श विलयन ………… विचलन दर्शाता है।
उत्तर
- बराबर
- \(\frac{P_{A}^{\circ}-P_{A}}{P_{A}^{\circ}}\)
- मोललता
- एजियोट्रॉपिक द्रव मिश्रण
- विलायक
- कम
- 55.6m
- गैस का द्रव में
- मोलरता
- धनात्मक।
3. उचित संबंध जोडिए –

उत्तर
1. (c), 2. (a), 3. (b), 4. (h), 5. (1), 6. (g), 7. (d), 8. (e)
4. एक शब्द/वाक्य में उत्तर दीजिए –
- नॉर्मलता व्यक्त करने का सूत्र लिखिए।
- मोललता का मात्रक क्या होता है ?
- वाष्प दाब में आपेक्षिक अवनमन तथा विलेय का द्रव्यमान में संबंध बताने वाला सूत्र लिखिए।
- किसी भी तनु विलयन के वे गुणधर्म जो विलयन में उपस्थित विलेय की संख्या पर निर्भर करते हैं, क्या कहलाते हैं ?
- राउल्ट का नियम क्या है ?
- धनात्मक विचलन वाले अनादर्श विलयन का एक उदाहरण लिखिए।
- ऋणात्मक विचलन वाले अनादर्श विलयन का एक उदाहरण लिखिए।
- एण्टी फ्रिज यौगिक का एक उदाहरण दीजिए।
- प्रदूषण व्यक्त करने की इकाई लिखिए।
- न्यूनतम क्वथन स्थिर क्वाथी विलयन का एक उदाहरण लिखिए।
उत्तर

- मोल प्रति किलो ग्राम,
- \(\frac{\mathrm{P}_{\mathrm{A}}^{\mathrm{o}}-\mathrm{P}_{\mathrm{A}}}{\mathrm{P}_{\mathrm{A}}^{\circ}}=\frac{\mathrm{W}_{\mathrm{B}}}{\mathrm{M}_{\mathrm{B}}} \times \frac{\mathrm{M}_{\mathrm{A}}}{\mathrm{W}_{\mathrm{A}}}\)
- अणुसंख्यक गुणधर्म,
- निश्चित ताप या किसी अवाष्पशील विलेय वाले विलयन के लिए वाष्प दाब में आपेक्षिक द्रव्यमान विलेय के मोल प्रभाज के बराबर होता है,
- CH3COCH3+ C6H6
- CHCl3 + CH3COCH3,
- एथिलीन,
- P.P.M.,
- 96-4C2H5OH + 4.5 H2O.
विलयन अति लघु उत्तरीय प्रश्न
प्रश्न 1.
वाण्ट हॉफ घटक (i) को निर्धारित करने वाला सूत्र क्या है ?
उत्तर

प्रश्न 2.
वाण्ट हॉफ समीकरण लिखिए। इसकी सहायता से अणुभार ज्ञात करने का सूत्र लिखिए।
उत्तर-
वाण्ट हॉफ समीकरण, πV =nRT
या \(\pi=\frac{n \mathrm{RT}}{\mathrm{V}}\)
या \(\pi=\frac{\mathrm{WRT}}{\mathrm{MV}} \) (∵ n =\(\frac{\mathrm{W}}{\mathrm{M}}\))
∴ M = \(\frac{\mathrm{WRT}}{\pi \mathrm{V}}\)
प्रश्न 3.
ऑक्जेलिक अम्ल (तुल्यांक भार = 63) के 6.3 ग्राम 500 मिली विलयन में घुले हैं। विलयन की नॉर्मलता ज्ञात कीजिए।
उत्तर

प्रश्न 4.
फॉर्मलता की परिभाषा एवं सूत्र लिखिए।
उत्तर
फॉर्मलता (Formality) – किसी भी विलेय के ग्राम सूत्र भार की संख्या जो एक लीटर विलायक में उपस्थित हो फॉर्मलता (F) कहलाती है। यह उस विलयन में प्रयुक्त होती है, जहाँ विलेय का संगुणन होता है।

प्रश्न 5.
NaOH के 4.0 ग्राम/लीटर सांद्रता वाले विलयन की मोलरता ज्ञात कीजिये।
हल

प्रश्न 6.
ऋणात्मक विचलन वाले विलयन के दो-दो उदाहरण लिखिए। .
CHCl3 +CH3COCH3, CHCl3 +C2H5OC2H5
CHCl3 +C6H6, CH3COOH+C6H5N
ऋणात्मक विचलन प्रदर्शित करने वाले कारक हैं।
प्रश्न 7.
धनात्मक विचलन प्रदर्शित करने वाले अनादर्श विलयन के दो उदाहरण लिखिए।
उत्तर
धनात्मक विचलन प्रदर्शित करने वाले अनादर्श विलयन –
(i) CCl4 और CHCl3, का मिश्रण,
(ii) CCI और CH6CH3 (टॉलुईन) का मिश्रण।
प्रश्न 8.
नॉर्मलता की परिभाषा लिखिए।
उत्तर-नॉर्मलता (Normality)—“किसी विलयन की नॉर्मलता उसके एक लीटर विलयन में उपस्थित विलेय के ग्राम-तुल्यांकों की संख्या है।” इसे N द्वारा दर्शाते हैं। यदि किसी विलयन के एक लीटर में विलेय पदार्थ का एक ग्राम-तुल्यांक विलेय हो, तो उस विलयन की नॉर्मलता 1 N होगी। उसी प्रकार यदि किसी विलयन के 1 लीटर में 0.5 ग्राम-तुल्यांक विलेय पदार्थ विलेय हो, तो उसकी नॉर्मलता 0.5 N होगी।

प्रश्न 9.
यदि NaOH की 2 ग्राम मात्रा 250 मिली विलयन में उपस्थित है, तो विलयन की नॉर्मलता ज्ञात कीजिए।
उत्तर
NaOH का तुल्यांकी भार = 40
250 ml विलयन में उपस्थित
NaOH की मात्रा = 2 ग्राम
∴ 1000 ml विलयन में उपस्थित
NaOH = \(\frac{2 \times 1000}{250}\) = 8 ग्राम
अतः . NaOH ग्राम/ ली. सांद्रता = 8 ग्राम

प्रश्न 10.
मोलरता व मोललता में अंतर स्पष्ट कीजिए।
उत्तर
मोलरता तथा मोललता में अन्तर –

प्रश्न 11.
पार्ट्स प्रति मिलियन को परिभाषित कीजिए।
उत्तर
पार्ट्स प्रति मिलियन (ppm) – जब विलयन में विलेय का सान्द्रण बहुत कम हो तब इस इकाई का प्रयोग करते हैं। अंश या भाग आयतन या द्रव्यमान के रूप में हो सकते हैं।
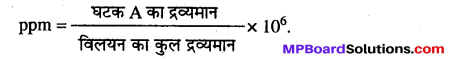
प्रश्न 12.
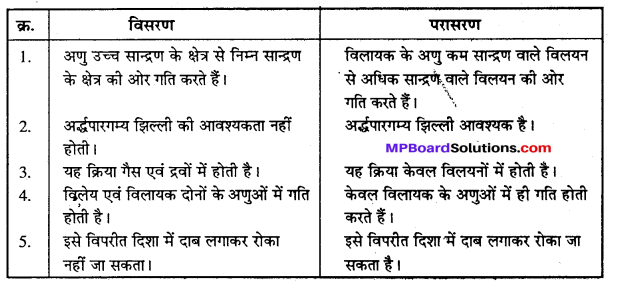
विसरण और परासरण में अंतर स्पष्ट कीजिए।
उत्तर
विसरण और परासरण में अन्तर –

प्रश्न 13.
ऋणात्मक विचलन प्रदर्शित करने वाले अनादर्श विलयन के दो उदाहरण लिखिए।
उत्तर
(i) ऐसीटोन और क्लोरोफॉर्म
(ii) जल और हाइड्रोक्लोरिक अम्ल।
प्रश्न 14.
विलयन के अणुसंख्यक गुणधर्म किस कारक पर निर्भर करते हैं ?
उत्तर
विलयन के अणुसंख्यक, विलयन में उपस्थित विलेय के अणुओं की संख्या पर निर्भर करते हैं।
प्रश्न 15.
संक्रमण ताप किसे कहते हैं ?
उत्तर
वह ताप जिस पर विलेयता की प्रकृति परिवर्तित होती है (उदाहरण-पहले बढ़ती है, फिर घटती है) संक्रमण ताप कहलाता है। सोडियम सल्फेट की जल में विलेयता 32.4 तक बढ़ती है, उसके बाद घटने लगती है। अत: 32.4°C सोडियम सल्फेट का संक्रमण ताप कहलाता है।
प्रश्न 16.
एक ऐसे ठोस विलयन का उदाहरण दीजिए, जिसमें विलेय कोई गैस है।
उत्तर-पैलेडियम (विलायक) में हाइड्रोजन (विलेय) का विलयन।।
प्रश्न 17.
ठण्डे देशों में सड़कों पर जमी बर्फ को हटाने के लिए CaCl2 का उपयोग किया जाता है। क्यों?
उत्तर
सड़कों पर जमे बर्फ पर CaCl2 या NaCl छिड़कने से जल का क्वथनांक कम हो जाता है। जिससे बर्फ पिघल जाता है एवं सड़कों पर जमी बर्फ साफ हो जाती है।
विलयन लघु उत्तरीय प्रश्न
प्रश्न 1.
राउल्ट का नियम क्या है ?
उत्तर
राउल्ट के नियमानुसार “ स्थिर ताप पर वाष्पदाब में आपेक्षिक अवनमन, विलयन में उपस्थित विलेय के मोल प्रभाज के बराबर होता है।”
गणितीय रूप में, \(\frac{P_{A}^{\circ}-P_{A}}{P_{A}^{\circ}}=X_{B}\)
जहाँ, \(\mathrm{P}_{\mathrm{A}}^{\circ}\) = शुद्ध विलायक का वाष्पदाब ,
PA= विलयन में उपस्थित विलायक का वाष्पदाब
XB = विलेय का मोल प्रभाज।
प्रश्न 2.
स्थिरक्वाथी मिश्रण (Azeotropes) किसे कहते हैं ? ये कितने प्रकार के होते हैं ?
उत्तर
स्थिर क्वाथी मिश्रण (Azeotropes)—ऐसे विलयन, जो बिना संघटन के परिवर्तन के एक ही ताप पर आसवित हो जाते हैं। स्थिर क्वथनांक या स्थिर क्वाथी मिश्रण कहलाता है। 95.6% एल्कोहॉल और 4.4% जल का मिश्रण स्थिर क्वाथी मिश्रण का उदाहरण है, जो 78.13°C पर उबलता है। स्थिर क्वाथी मिश्रण के अवयवों को आसवन द्वारा पृथक् नहीं किया जा सकता।
स्थिर क्वाथी दो प्रकार के होते हैं –
(i) निम्न क्वथन स्थिर क्वाथी मिश्रण-ऐसे विलयन, जो राउल्ट के नियम से धनात्मक विचलन प्रदर्शित करते हैं अर्थात् इनका वाष्पदाब उच्च होता है। अतः इनका क्वथनांक कम होता है।
उदाहरण – एसीटोन + CS2,C2H5 OH + n-hexane
(ii) उच्च क्वथन स्थिर क्वाथी मिश्रण-वे विलयन जो राउल्ट के नियम से ऋणात्मक विचलन प्रदर्शित करते हैं, उनका वाष्पदाब अपेक्षाकृत कम व क्वथनांक उच्च होता है। उदाहरण – एसीटोन + क्लोरोफॉर्म, ईथर + क्लोरोफॉर्म।
प्रश्न 3.
क्वथनांक के उन्नयन तथा आण्विक द्रव्यमान में सम्बन्ध दीजिए।
उत्तर
क्वथनांक के उन्नयन तथा आण्विक द्रव्यमान में सम्बन्ध-मानलो WB ग्राम अवाष्पशील विलेय WA ग्राम विलायक में घुला है तथा विलेय का मोलर द्रव्यमान MB ग्राम है।
अतः मोललता m =\(\frac{\mathrm{W}_{\mathrm{A}} / \mathrm{M}_{\mathrm{B}} \times 1000}{\mathrm{W}_{\mathrm{A}}}\) ……………..(1)
किसी अवाष्पशील विलेय के लिए,
ΔTb= Kb.m …………….(2)
समी. (1) एवं (2) से,
ΔTb = \(\frac{\mathrm{K}_{b} \times \mathrm{W}_{\mathrm{B}} \times 1000}{\mathrm{M}_{\mathrm{B}} \times \mathrm{W}_{\mathrm{A}}}\) …………..(3)
Mb = \(\frac{\mathrm{K}_{b} \times \mathrm{W}_{\mathrm{B}} \times 1000}{\Delta \mathrm{T}_{b} \times \mathrm{W}_{\mathrm{A}}}\) …………..(4)
प्रश्न 4.
वाष्प दाब में आपेक्षिक अवनमन से विलेय का आण्विक द्रव्यमान ज्ञात करने हेतु सूत्र व्युत्पन्न कीजिए।
उत्तर
वाष्पदाब में आपेक्षिक अवनमन से अवाष्पशील विलेय के आण्विक द्रव्यमान की गणनाहम जानते हैं कि जब किसी द्रव में कोई अवाष्पशील विलेय मिलाया जाता है, तब वाष्पदाब में अवनमन (P-P) होता है। राउल्ट के नियमानुसार, विलेय को विलायक में मिलाने पर वाष्पदाब में आपेक्षिक अवनमन विलेय के मोल प्रभाज के बराबर होता है। |

यदि nA और nB क्रमशः विलायक और विलेय के मोलों की संख्याएँ, WA और nB क्रमशः विलायक और विलेय के द्रव्यमान तथा MA और nb क्रमश: विलायक और विलेय के आण्विक द्रव्यमान हों तो,

समीकरण (1), (3) और (4) के आधार पर वाष्पदाब में आपेक्षिक अवनमन सम्बन्धी गणनाएँ की जाती हैं।
प्रश्न 5.
आदर्श और अनादर्श विलयन किसे कहते हैं ? उदाहरण देकर समझाइये।
उत्तर
आदर्श विलयन-आदर्श विलयन ऐने विलयन को कहते हैं, जिस पर राउल्ट का नियम विलयन की सभी सान्द्रताओं तथा सभी ताप की स्थिति में पूर्ण रूप से लागू होता है।
आदर्श विलयन बनाने की शर्ते इस प्रकार हैं –
(i) ΔVmixing = 0 (ii) ΔHmixing = 0.
उदाहरण – C2H5Br+C2H5Cl.
अनादर्श विलयन-अनादर्श विलयन ऐसे विलयन हैं, जिन पर राउल्ट का नियम विलयन की सभी सान्द्रताओं तथा तापों की स्थिति में पूर्ण रूप से लागू नहीं होता है।
इन विलयनों के लिए ΔVmixing # 0 एवं ΔHmixing # 0 होता है।
उदाहरण – बेंजीन + ऐसीटोन।
प्रश्न 6.
विसरण व परासरण में अन्तर लिखिए।
उत्तर
विसरण और परासरण में अन्तर –
प्रश्न 7.
विलयनों के अणुसंख्यक गुणों के चार उदाहरण लिखिये।
उत्तर
विलयन के ऐसे भौतिक गुण जो विलयन के एक निश्चित आयतन में घुले हुए विलेय के कणों की संख्या पर निर्भर करते हैं, अणुसंख्यक गुण-धर्म कहलाते हैं । ये निम्न हैं –
1. वाष्प दाब में अवनमन ।
2. क्वथनांक में उन्नयन ।
3.. हिमांक का अवनमन ।
4. परासरण दाब ।
सभी अणुसंख्यक गुणों के मान विलेय के सान्द्रण में वृद्धि के साथ बढ़ते हैं तथा सान्द्रण में कमी के साथ घटते हैं ।
प्रश्न 8.
वाण्ट हॉफ विलयन समीकरण स्थापित कीजिए।
उत्तर- “किसी अवाष्पशील विलेय के तनु विलयन का परासरण दाब (π), विलयन के परमताप (T) के समानुपाती होता है, जब विलयन का सान्द्रण (C) स्थिर हो।” इसे वाण्ट हॉफ नियम कहते हैं।
π ∝ T (C स्थिर है) …………(1)
व्युत्पत्ति – π परासरण दाब विलयन के मोलर सान्द्रण (C) के समानुपाती होता है।
(2)
∴ π ↓∝ C(T स्थिर है)
समी. (1) एवं समीकरण (2) से,
π ∝ CT
या π = CRT (वाण्ट हॉफ समीकरण) …………(3)
जहाँ, R = गैस स्थिरांक
c = \(\frac{1}{\mathrm{V}}\)
π = \(\frac{\mathrm{RT}}{\mathrm{V}}\)………………….(4)
या
πV = RT…………………….(5)
इसे वाण्ट हॉफ आदर्श विलयन समीकरण कहते हैं।
प्रश्न 9.
निम्न को समझाइए (1) मोलल हिमांक अवनमन स्थिरांक, (2) मोलल क्वथनांक उन्नयन स्थिरांक।
उत्तर
(1) मोलल हिमांक अवनमन स्थिरांक-किसी विलयन का मोलल हिमांक अवनमन स्थिरांक, विलयन के हिमांक में उस कमी के बराबर है, जो एक मोल अवाष्पशील विलेय को 1000 ग्राम विलायक में विलेय करने पर प्राप्त होता है।
∴ हिमांक में अवनमन ΔTf ∝ m
ΔTf = kf × m
यदि m = 1
तो ΔTf = kf
जहाँ, kf मोलल हिमांक अवनमन स्थिरांक है।
(2) मोलल क्वथनांक उन्नयन स्थिरांक-किसी विलयन का मोलल क्वथनांक उन्नयन स्थिरांक, विलयन के क्वथनांक में हुई उस वृद्धि के बराबर होता है, जो एक मोल अवाष्पशील पदार्थ को 1000 ग्राम विलायक में विलेय करने पर प्राप्त होता है।
क्वथनांक में उन्नयन ΔTb∝ m
ΔTb = kb × m
यदि m = 1
तो ΔTb = kb
जहाँ, kb मोलल हिमांक अवनमन स्थिरांक है।
प्रश्न 10.
(a) परासरण दाब क्या है ?
(b) यूरिया के एक लीटर विलयन में 6 gm यूरिया घुला है। 300 K पर यूरिया के उस विलयन का परासरण दाब ज्ञात कीजिए।(R = 0.0821 L/Atm-1mol-1) (यूरिया का अणुभार = 60)
उत्तर
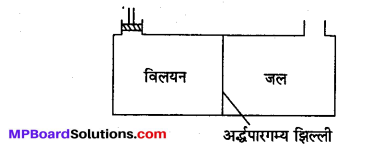
(a) परासरण दाब-किसी विलयन को विलायक से अर्द्धपारगम्य झिल्ली द्वारा अलग रखने पर परासरण को रोकने के लिए विलयन पर कम-से-कम जो बाहरी दाब लगाना पड़ता है, वह विलयन का परासरण दाब कहलाता है। परासरण दाब को π से दर्शाते हैं।
(b) हल – wB = विलेय का द्रव्यमान = 6 gm
R = विलयन का स्थिरांक = 0 . 0821 L/Atm-1mol-1
T = परम ताप = 300K
MB = विलेय का आण्विक द्रव्यमान = 60 gm
V = 1. OL
∴\(\pi=\frac{\mathrm{W}_{\mathrm{B}} \mathrm{RT}}{\mathrm{M}_{\mathrm{B}} \times \mathrm{V}}\)
= \(\frac{6 \times 0 \cdot 0821 \times 300}{60 \times 1 \cdot 0}\)
= 2.463 वायुमण्डल।
विलयन दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
स्थिर क्वाथी मिश्रण किसे कहते हैं ? आदर्श विलयन एवं अनादर्श विलयन में तीन अंतर लिखिए।
उत्तर
स्थिरक्वाथी मिश्रण-द्रवों का ऐसा मिश्रण जो एक निश्चित ताप पर बिना संघटन बदले उसी ताप पर आसवित होता है, स्थिरक्वाथी मिश्रण कहलाता है।
आदर्श विलयन एवं अनादर्श विलयन में अंतरक –

प्रश्न 2.
(a) हिमांक अवनमन से क्या तात्पर्य है ?
(b) 100gm जल में 1gm NaCl विलेय कर एक विलयन बनाया गया है।जल का मोलल अवनमन स्थिरांक 1.8544gm moL-1हो, तो NaCl के वियोजन की मात्रा ज्ञात कीजिए। NaCl विलयन के लिए हिमांक में अवनमन 0.6044 है।
उत्तर
(a) हिमांक अवनमन-किसी पदार्थ का हिमांक वह ताप है, जिस पर उसकी ठोस तथा द्रव अवस्थाओं के वाष्पदाब समान होते हैं। चूँकि विलयन का वाष्प दाब विलायक के वाष्प दाब से कम होता है, जिसके कारण विलयन का हिमांक शुद्ध विलायक के हिमांक से कम हो जाता है, इसे हिमांक में अवनमन कहते हैं।
(b) NaCl के प्रेक्षित आण्विक द्रव्यमान की गणना निम्नलिखित सूत्र से की जाती है –
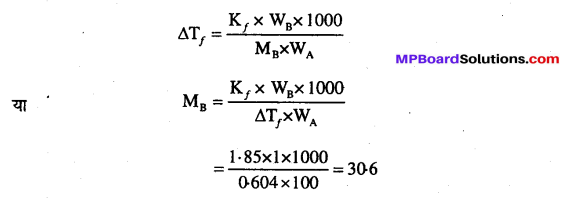
अतः प्रेक्षित आण्विक द्रव्यमान (Observed molecular mass) = 30.6
सोडियम क्लोराइड का सामान्य आण्विक द्रव्यमान = 58.5
माना NaCl के वियोजन की मात्रा α है (अर्थात् 1 मोल NaCl में से α मोल वियोजित होता है)

प्रश्न 3.
धनात्मक विचलन वाले विलयन व ऋणात्मक विचलन वाले विलयन में पाँच अंतर लिखिए।
उत्तर
धनात्मक विचलन वाले विलयन व ऋणात्मक विचलन वाले विलयन में अंतर –
प्रश्न 4.
परासरण दाब मापन की बर्कले एवं हार्टले विधि का संक्षिप्त वर्णन कीजिए तथा इस विधि के लाभ बताइये।
उत्तर
बर्कले औरहार्टले की विधि (Berkley and Hartley Method)-उपकरण में दो समकेन्द्रिक नलियाँ होती हैं, जिनमें भीतरी नली संरन्ध्र होती है। भीतरी संरन्ध्र नली पर विद्युत् विधि से कॉपर फेरोसायनाइड की अर्द्धपारगम्य झिल्ली बना दी जाती है। इसके एक सिरे पर केशिका नली (Capillary tube) तथा दूसरे सिरे पर टोंटीदार कीप लगाते हैं। संरन्ध्र नली को घेरे हुए गन मेटल की बनी बाहरी नली होती है। इसमें जलरोधक पिस्टन लगा होता है. जिससे विलयन की सतह पर दाब डाला जाता है।
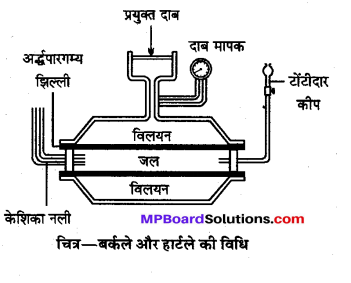
भीतरी नली में आसुत जल भर दिया जाता है, जो केशिका नली में एक निशान तक होता है। बाहरी नली में वह विलयन भरते हैं, जिसका परासरण दाब ज्ञात करना होता है । परासरण के कारण भीतरी नली से झिल्ली द्वारा जल का प्रवाह विलयन की ओर होता है और केशिका नली में जल-स्तर नीचे आने लगता है। अब पिस्टन द्वारा विलयन पर दाब डालकर केशिका नली में जल-स्तर पूर्व निशान पर स्थिर रखा जाता है। स्थायी स्थिति आने पर पिस्टन द्वारा, जो दाब लगाया जाता है वह विलयन का परासरण दाब होता है।
लाभ – इस विधि के निम्नांकित लाभ हैं –
(i) परासरण दाब निकालने में समय कम लगता है।
(ii) विलयन की सान्द्रता न बदलने से परिणाम सही मिलते हैं।
(iii) अर्द्धपारगम्य झिल्ली पर अधिक दाब न पड़ने से वह टूटती नहीं।
(iv) उच्च परासरण दाब का मापन किया जा सकता है।
प्रश्न 5.
फीनॉल को बेन्जीन में घोलने पर उसके दो अणु संगुणित होकर एक बड़ा अणु बना लेते हैं। जब 2gm फीनॉल को 100gm बेन्जीन में घोला जाता है, तब हिमांक में 0.69°C की कमी होती है। फीनॉल की संगुणन की मात्रा ज्ञात कीजिए। (Kb = 5.12 g mol-1)
उत्तर

या
\(\frac{94}{1484}\)=\(\frac{1-\frac{x}{2}}{1}\)
0.63 =1 – 1-\(\frac{x}{2}\)
0.63 = \( \frac{2-x}{2}\)
0.63 × 2 = 2 – x
1.26 =2 – x
x = 2 – 1.26
संगुणन की मात्रा = 0.74
संगुणन की % मात्रा = 74%.
प्रश्न 6.
वाण्ट हॉफ गुणांक से आप क्या समझते हैं ? इसकी उपयोगिता को लिखिए।
उत्तर
वाण्ट हॉफ गुणांक (Van’t Hoff’s Factor)-विलयन में विलेय के अणुओं का संगुणन या वियोजन होने पर विलेय के आण्विक द्रव्यमान के सामान्य मान और प्रेक्षित मान का अनुपात वाण्ट हॉफ गुणांक कहलाता है। इसे । से प्रदर्शित करते हैं।

विलयन में विलेय के अणुओं का संगुणन होने पर कणों की प्रभावी संख्या कम हो जाती है एवं वियोजन होने पर कणों की प्रभावी संख्या बढ़ जाती है। चूंकि अणुसंख्यक गुण विलयन में प्रभावी कणों की वास्तविक संख्या पर आधारित है तथा आण्विक द्रव्यमान के व्युत्क्रमानुपाती है, अतः प्रेक्षित मान संगुणन या वियोजन होने पर सामान्य मानों से क्रमशः अधिक या कम होते हैं । वाण्ट हॉफ गुणांक i द्वारा अणुसंख्यक गुणों के समीकरण संशोधित कर लिये जाते हैं, जिनसे विलेय का सही आण्विक द्रव्यमान प्राप्त होता है।
क्वथनांक में उन्नयन ΔTb = iKbm
हिमांक का अवनमन ΔTf = iKfm
परासरण दाब
π = iCRT
i के मान से संगुणन की कोटि एवं वियोजन की मात्रा ज्ञात करने में सहायता मिलती है। का मान –
(a) एक हो तो अणुओं का संगुणन या वियोजन न होना प्रदर्शित होता है।
(b) एक से कम हो तो अणुओं का संगुणन होता है, जैसे-बेंजीन में बेंजोइक अम्ल का विलयन।
(c) एक से अधिक हो तो अणुओं का वियोजन होता है, जैसे-जल में NaCl का विलयन ।

प्रश्न 7.
असामान्य अणुसंख्यक गुणों के मान असामान्य होने के कारण आण्विक द्रव्यमान असामान्य होते हैं,,कारण लिखिए।
उत्तर
इसके प्रमुख दो कारण हैं(1) विलेय के अणुओं का संगुणन, (2) विलेय के अणुओं का वियोजन।
(1) विलेय के अणुओं का संगुणन-किसी भी विलेय को विलायक में विलेय करने पर उसका संगुणन हो जाता है, तो विलयन में विलेय के कणों की संख्या सामान्य रूप में प्राप्त होने वाले अणुओं की संख्या से कम हो जाती है। इसके कारण अणुसंख्यक गुणों के मान कम प्राप्त होते हैं । इस प्रकार आण्विक द्रव्यमान की गणना करने पर प्राप्त मान विलेय के सामान्य आण्विक द्रव्यमान से अधिक होता है क्योंकि हम जानते हैं कि अणुसंख्यक गुण विलेय के आण्विक द्रव्यमान के व्युत्क्रमानुपाती होता है। एसीटिक अम्ल एवं बेंजीन का उदाहरण ले तो हम पायेंगे कि एसीटिक अम्ल को बेंजीन में विलेय करने पर उसका आण्विक द्रव्यमान 120 प्राप्त होगा जबकि सामान्य आण्विक द्रव्यमान 60 है।
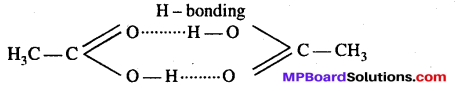
(2) विलेय के अणुओं का वियोजन-कुछ विद्युत्-अपघट्य पदार्थ जैसे-BaCI, KCI आदि के विलयन में उनके अणुओं का दो या दो से अधिक कण जो आयन के रूप में विद्यमान है का वियोजन होता है। जिससे विद्युत्-अपघट्य पदार्थों के विलयनों में कणों या आयनों की संख्या विलेय के अणुओं की संभावित संख्या से अधिक हो जाती है। इस प्रकार ऐसे विलयनों के लिए अणुसंख्यक का मान अधिक मिलेगा जैसा कि हम जानते हैं अणुसंख्यक गुण आण्विक द्रव्यमान के व्युत्क्रमानुपाती होते हैं। इस प्रकार ऐसे यौगिकों के लिए अणुसंख्यक गुण के आधार पर ज्ञात किए आण्विक द्रव्यमान के मान सामान्य आण्विक द्रव्यमान के मान से हमेशा कम ही होते हैं।
इस प्रकार हम कह सकते हैं कि विलेय के संगुणन या वियोजन के कारण पदार्थ के प्रेक्षित आण्विक द्रव्यमान सामान्य आण्विक द्रव्यमान से अधिक या कम होते हैं।
प्रश्न 8.
मोलल हिमांक अवनमन स्थिरांक क्या है? एक जलीय विलयन का हिमांक -0.385°C है यदि
Kf = 3.85 Kkg mol-1
तथा
kb = 0.712 Kgmol-1
हो, तो इसके क्वथनांक में उन्नयन ज्ञात कीजिए।
उत्तर
मोलल हिमांक अवनमन स्थिरांक – 1 ग्राम विलेय पदार्थ को 1000 ग्राम विलायक में घोलने पर विलयन के हिमांक में जो कमी होती है, उसे मोलल हिमांक अवनमन स्थिरांक कहते हैं। इसे Kf से दर्शाते हैं।
दिया है-विलयन का हिमांक = 0.385°C
∴ ΔTf = T1 – T2
=0 – (-0.385)
= 0.385°C Kg = 3.85 K Kgmol-1
Kb = 0.712 K Kgmol-1
मोललता m=\(\frac{\Delta \mathrm{T}_{f}}{\mathrm{K}_{f}}\) = \(\frac{0.385}{3.85}\) =0.1
क्वथनांक में उन्नयन = ΔTb
ΔTb=Kb× m .
= 0.712 × 0-1
= 00712°C.
प्रश्न 9.
क्वथनांक में उन्नयन क्या है ? अवाष्पशील पदार्थ के मिलाने से विलयन का क्वथनांक क्यों बढ़ जाता है ? ग्राफ की सहायता से समझाइये।
उत्तर
क्वथनांक में उन्नयन-“किसी द्रव का क्वथनांक वह ताप है, जिस पर उसके वाष्पदाब का मान वायुमण्डलीय दाब के बराबर हो जाता है।”
हमें यह भी ज्ञात है कि किसी विलयन का वाष्पदाब शुद्ध विलायक के वाष्पदाब से कम होता है। अत: वह ताप जिस पर किसी विलयन का वाष्पदाब वायुमण्डलीय दाब के बराबर हो जाता है (अर्थात् विलयन का क्वथनांक), उस ताप से अधिक होगा जिस पर शुद्ध विलायक का F वाष्पदाब वायुमण्डलीय दाब के बराबर हो जाता है (अर्थात् शुद्ध विलायक का क्वथनांक)। कहने का तात्पर्य यह है कि शुद्ध विलायक में कोई विलेय मिला देने पर उसका क्वथनांक बढ़ जाता है।
Tb, , का मान \(\mathrm{T}_{b}^{\circ}\) के मान से अधिक है, अतः विलयन का क्वथनांक विलायक के क्वथनांक से अधिक है। दूसरे शब्दों में, शुद्ध विलायक की अपेक्षा विलयन उच्च ताप पर उबलता है। अतः विलेय को विलायक में घोलने से उसके क्वथनांक में होने वाली वृद्धि को क्वथनांक का उन्नयन (Elevation of boiling point) कहते हैं । उसे ΔTb, से प्रदर्शित करते हैं, अतः \(\Delta \mathrm{T}_{b}=\mathrm{T}_{b}-\mathrm{T}_{b}^{0}\)
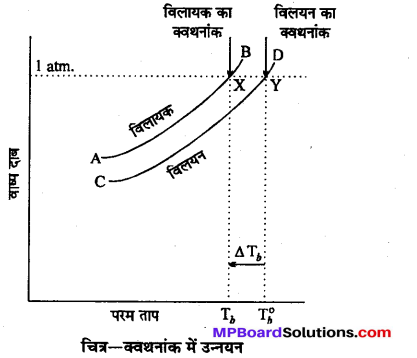
प्रश्न 10.
सिद्ध कीजिए कि किसी विलयन का आपेक्षिक वाष्पदाब अवनमन, विलयन में उपस्थित विलेय के मोल प्रभाज के बराबर होता है।
अथवा
राउल्ट का नियम क्या है ? इसका गणितीय स्वरूप स्पष्ट कीजिए।
उत्तर
राउल्ट का नियम (अवाष्पशील विलेय के लिए)-जब किसी वाष्पशील द्रव में कोई अवाष्पशील विलेय मिला दिया जाये तो विलायक का वाष्पदाब कम हो जाता है। विलयन में उपस्थित विलायक का वाष्पदाब विलयन में विलायक के मोल प्रभाज के समानुपाती होता है।
व्यंजक प्राप्त करना – चूँकि विलयन में उपस्थित विलेय अवाष्पशील है, अतः विलयन का वाष्पदाब (P), विलयन में विलायक के वाष्पदाब (PA) के बराबर होगा। अतः

आधार पर राउल्ट नियम की दूसरी परिभाषा दी जा सकती है, जिसके अनुसार –
अवाष्पशील विलेय वाले विलयन के लिए किसी निश्चित ताप पर वाष्पदाब में आपेक्षिक अवनमन विलयन में विलेय के मोल प्रभाज के बराबर होता है।
समीकरण (8) से स्पष्ट है कि वाष्पदाब में आपेक्षिक अवनमन का मान विलेय के मोलर सान्द्रण पर निर्भर करता है, विलेय की प्रकृति पर नहीं, अत: वाष्पदाब में आपेक्षिक अवनमन एक अणुसंख्यक गुण है।
प्रश्न 11.
मोलल हिमांक अवनमन स्थिरांक क्या है ? मोलल हिमांक अवनमन में संबंध प्रदर्शित करने के लिए सूत्र की व्युत्पत्ति कीजिए।
अथवा हिमांक अवनमन क्या है ? इसका विलेय के आण्विक द्रव्यमान के साथ सम्बन्ध स्थापित कीजिये।
उत्तर
किसी विलायक में अवाष्पशील विलेय पदार्थ मिलाने पर प्राप्त विलयन का वाष्प दाब शुद्ध विलायक के वाष्प दाब से कम होता है, जिसके कारण हिमांक ताप में कमी आ जाती है अर्थात् वाष्प दाब अवनमन के कारण विलयन का हिमांक शुद्ध विलायक के हिमांक से कम हो जाता है। इस प्रकार, विलायक और विलयन के हिमांकों का अन्तर हिमांक का अवनमन (ΔT<sub<f) कहलाता है।
हिमांक में अवनमन द्वारा विलेय का आण्विक द्रव्यमान ज्ञात करना-हिमांक में अवनमन (ΔT<sub<f) का प्रायोगिक निर्धारण करके अवाष्पशील विलेय का आण्विक द्रव्यमान ज्ञात किया जा सकता है। . किसी अवाष्पशील विलेय के विलयन के लिए,
ΔTf = Kf× m ……………(1)
मानलो WB ग्राम अवाष्पशील विलेय WA ग्राम विलायक में घुला है तथा विलेय का आण्विक (मोलर) द्रव्यमान MB ग्राम है।
atah
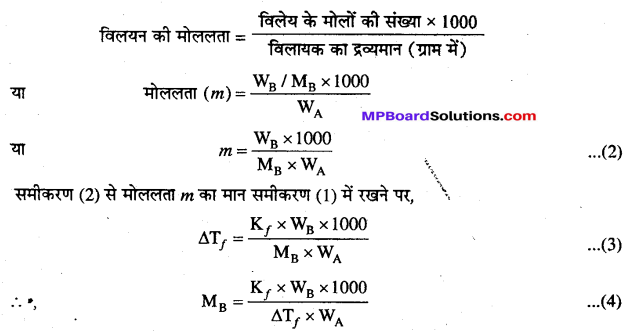
समीकरण (4) से शेष अन्य राशियों के मान ज्ञात होने पर विलेय के आण्विक द्रव्यमान M की गणना की जा सकती है।
विलयन आंकिक प्रश्न
प्रश्न 1.
सोडियम कार्बोनेट के 1.325 ग्राम 250 ml विलयन में विलेय है। विलयन की सन्दता ग्राम / लीटर में ज्ञात कीजिए ।
हल

Na2CO3 का भार = 1.325 ग्राम .
विलयन का आयतन = 250 ml
सोडियम कार्बोनेट की ग्राम प्रति लीटर सान्द्रता =\(\frac{1 \cdot 325}{250} \times 1000\) = 5.3 ml
प्रश्न 2.
4gm कॉस्टिक सोडा (NaOH) 500 ml जलीय विलयन में घुले हैं। घोल की नॉर्मलता ज्ञात कीजिए।
हल
जबकि 500 ml विलयन में 4 gm NaOH घुला है।
∴ 1000 ml में \(\frac{4 \times 1000}{500}=8 \mathrm{gm}\)

= \(\frac { 8 }{ 40 }\)
= \(\frac { 1 }{ 5 }\) = 0.2N.
प्रश्न 3.
ग्लूकोज के 5% विलयन के 25°C पर परासरण दाब की गणना कीजिए। ग्लूकोज का आण्विक द्रव्यमान = 180, R = 0.0821 लीटर वायुमण्डल।
हल- ∵ 5 ग्राम ग्लूकोज 100 मिली में घुला है
∴ 180 ग्राम ग्लूकोज होगा \(\frac{100}{5} \times 180\) = 3600 लीटर
= 3.6 लीटर में
हम जानते हैं, PV = RT
∴P × 3.6 = 0.0821 × (25 + 273) = 0.0821 × 298
या
P = \(\frac{0.0821 \times 298}{3.6}\) = 6.80 वायुमण्डल।
प्रश्न 4.
12.5 ग्राम यूरिया के 170 ग्राम जल में विलयन के क्वथनांक में उन्नयन 0.63 K पाया गया है। जल के लिये Kb = 0.52 Km-1 है, तो यूरिया के आण्विक द्रव्यमान ज्ञात कीजिए।
उत्तर
हल-
सूत्र- MB = \(\mathrm{K}_{b} \times \frac{\mathrm{W}_{\mathrm{B}} \times 1000}{\Delta \mathrm{T}_{b} \times \mathrm{W}_{\mathrm{A}}}\)
दिया है, WA = 170 gm, WB = 12.5 gm, ΔTb= 0.63 K, Kb= 0.52 Km-1 सूत्र में मान रखने पर,
MB = \(\frac{0 \cdot 52 \times 12 \cdot 5 \times 1000}{0 \cdot 63 \times 170}\)
= 60.7 gm mol-1.