MP Board Class 12th Chemistry Solutions Chapter 1 ठोस अवस्था
ठोस अवस्था NCERT पाठ्यनिहित प्रश्नोत्तर
प्रश्न 1.
ठोस कठोर क्यों होते हैं ?
उत्तर
संगठनात्मक कणों के बीच प्रबल अन्तःआण्विक बल की उपस्थिति के कारण ठोस कठोर होते हैं।
प्रश्न 2.
ठोस का आयतन निश्चित क्यों होता है ?
उत्तर
संरचनात्मक कणों के स्थिर होने के कारण ठोस कठोर होते हैं। इस कारण इनका आयतन . निश्चित होता है।
प्रश्न 3.
निम्नलिखित को अक्रिस्टलीय तथा क्रिस्टलीय ठोसों में वर्गीकृत कीजिये –
पॉलियूरिथेन, नैफ्थेलीन, बेन्जोइक अम्ल, टेफ्लॉन, पोटैशियम नाइट्रेट, सेलोफेन, पॉलीविनाइल क्लोराइड, रेशकॉच, ताँबा।
उत्तर
अक्रिस्टलीय ठोस – पॉलियूरिथेन, टेफ्लॉन, सेलोफेन, पॉलिविनाइल क्लोराइड।
क्रिस्टलीय ठोस – बेन्जोइक अम्ल, पोटैशियम नाइट्रेट, कॉपर।
प्रश्न 4.
काँच को अतिशीतित द्रव क्यों माना जाता है ?
उत्तर
द्रव के समान काँच की प्रवृत्ति भी बहने की होती है, परन्तु बहुत धीमी, इसलिये इसे अतिशीतित द्रव कहते हैं।
प्रश्न 5.
एक ठोस के अपवर्तनांक का सभी दिशाओं में समान मान प्रेक्षित होता है। इस ठोस की प्रकृति पर टिप्पणी कीजिए। क्या यह विचलन गुण प्रदर्शित करेगा?
उत्तर
ठोस अक्रिस्टलीय होते हैं, क्योंकि अक्रिस्टलीय ठोस आइसोट्रोपिक प्रकृति के होते हैं। नहीं, ये विदलन गुण नहीं प्रदर्शित करते हैं।
प्रश्न 6.
उपस्थित अंतरा-आण्विक बलों की प्रकृति के आधार पर निम्नलिखित ठोसों को विभिन्न संवर्गों में वगीकृत कीजिए- पोटैशियम सल्फेट, टिन, बेन्जीन, यूरिया, अमोनिया, जल, जिंक सल्फाइड, ग्रेफाइट, रूबिडियम, ऑर्गन, सिलिकन कार्बाइड।
उत्तर
पोटैशियम सल्फेट- आयनिक, टिन-धात्विक, बेंजीन आण्विक (अध्रुवीय) यूरिया-आण्विक (ध्रुवीय), अमोनिया-आण्विक (H-बंधित), पानी-आण्विक (H-बंधित), जिंक सल्फेट-आयनिक, ग्रेफाइटसहसंयोजी या नेटवर्क, रूबिडियम-धात्विक, आर्गन-आण्विक (अध्रुवीय), सिलिकन कार्बाइड – सहसंयोजी या नेटवर्क।
प्रश्न 7.
ठोस A, अत्यधिक कठोर तथा ठोस एवं गलित दोनों अवस्थाओं में विद्युत्रोधी है और अत्यंत उच्च ताप पर पिघलता है। यह किस प्रकार का ठोस है ?
उत्तर –
सहसंयोजी ठोस।
प्रश्न 8.
आयनिक ठोस गलित अवस्था में विद्युत् चालक होते हैं परन्तु ठोस अवस्था में नहीं। व्याख्या कीजिये।
उत्तर –
ठोस अवस्था में आयन स्वतंत्र नहीं होते, अत: आयनिक ठोस अच्छे चालक नहीं होते हैं। जबकि गलित अवस्था में आयन मुक्त रहते हैं अत: विद्युत् धारा प्रवाहित होती है या विद्युत् के चालक होते हैं।
प्रश्न 9.
किस प्रकार के ठोस विद्युत् चालक, आघातवर्ध्य और तन्य होते हैं ?
उत्तर
धात्विक ठोस, विद्युत् के चालक उनमें उपस्थित मुक्त इलेक्ट्रॉनों के कारण होते हैं।
प्रश्न 10.
जालक बिन्दु के महत्व दीजिए।
उत्तर
प्रत्येक जालक बिन्दु ठोस का एक संघटनात्मक कण होता है। ये रचनात्मक कण एक परमाणु एक अणु (परमाणुओं का समूह) या एक आयन होता है।
प्रश्न 11.
एकक कोष्ठिका को अभिलक्षणित करने वाले पैरामीटरों के नाम बताइए।
उत्तर
एक एकक कोष्ठिका अभिलक्षणित होती है –
(i) तीन किनारे के आयामों के साथ, जिन्हें a, b तथा c द्वारा प्रदर्शित किया जाता है।
(ii) किनारे या कोने के बीच के कोण, जिन्हें α , β तथा γ द्वारा प्रदर्शित करते हैं । कोण α, b तथा c के बीच का कोण, β, a तथा c के बीच का और γ, a तथा b के बीच का कोण होता है।
प्रश्न 12.
निम्नलिखित में विभेद कीजिए –
(1) षट्कोणीय और एकनताक्ष एकक कोष्ठिका।
(ii) फलक केन्द्रित और अंत्य-केन्द्रित एकक कोष्ठिका।
उत्तर
- षट्कोणीय एकक कोष्ठिका के लिये a = b ≠ c, α = β = 90°, γ = 120° एकनताक्ष एकक सेल के लिये a ≠b ≠c, α = γ = 90°, β= 90°
- फलक केन्द्रित एकक सेल में किनारों पर बिन्दु के साथ-साथ प्रत्येक फलक के केन्द्र पर भी बिन्दु होता है। इसमें प्रत्येक एकक सेल में 4 परमाणु होते हैं।
अंत्य-केन्द्रित एकक कोष्ठिका में प्रत्येक किनारों पर तथा कोई दो विपरीत फलकों के केन्द्र पर भी बिन्दु होता है। इसमें प्रत्येक एकक सेल में 2 परमाणु होते हैं।
प्रश्न 13.
स्पष्ट कीजिए कि एक घनीय एकक कोष्ठिका के – (i) कोने और (ii) अंतःकेन्द्र पर उपस्थित परमाणु का कितना भाग सन्निकट कोष्ठिका से सहभाजित होता है।
उत्तर
- कोने पर स्थित एक परमाणु का 1/8 भाग सन्निकट कोष्ठिका से सहभाजित होता है।
- एक घनीय एक सेल का अंतः केन्द्र पर उपस्थित परमाणु किसी भी दूसरी एकक कोष्ठिका या सेल से सहभाजित नहीं होता है। अत: यह पूर्णतः एकक सेल के साथ होता है।
प्रश्न 14.
एक अणु की वर्ग-निविड संकुलित परत में द्विविमीय उपसहसंयोजन संख्या क्या है ?
उत्तर
4.
प्रश्न 15.
एक यौगिक षट्कोणीय निविड संकुलित संरचना बनाता है। इसके 0.5 मोल में कुल रिक्तियों की संख्या कितनी है ? उनमें से कितनी रिक्तियाँ चतुष्फलकीय हैं ?
उत्तर
एक परमाणु की षट्कोणीय निविड संकुलित संरचना में तीन रिक्तियाँ एक अष्टफलकीय तथा दो चतुष्फलकीय होती हैं।
0.5 मोल में परमाणु की संख्या = 0.5 × 6.022 × 1023
= 3.011 × 1023
कुल रिक्तियों की संख्या = 3 × 3.011 × 1023
= 9.033 × 1023
चतुष्फलकीय रिक्तियों की संख्या = 2 × 3.011 × 1023
= 6.022 × 1023
प्रश्न 16.
एक यौगिक दो तत्वों M और Nसे बना है। तत्व N, ccp संरचना बनाता है और M के परमाणु चतुष्फलकीय रिक्तियों के 1/3 भाग को अध्यासित करते हैं। यौगिक का सूत्र क्या है ?
उत्तर
चूँकि ccp संरचना के N रूप में प्रत्येक एकक सेल में 4 परमाणु होते हैं।
इकाई सेल में N परमाणुओं की संख्या = 4
प्रत्येक परमाणु के लिये यहाँ दो चतुष्फलकीय रिक्तिका है। अत: यहाँ प्रति एकक सेल 8 चतुष्फलकीय रिक्तिका होगी।
∴ M परमाणु की संख्या =\(\frac{1}{3} \times 8=\frac{8}{3}\)
सूत्र M8/3N4 या M2N3
प्रश्न 17.
निम्नलिखित में से किस जालक में उच्चतम संकुलन क्षमता है –
(1) सरल घनीय
(ii) अंतः केन्द्रित घन और
(iii) षट्कोणीय निविड संकुलित जालक।
उत्तर
संकुलन क्षमता होती है –
सरल घनीय = 52.4 %
अंतः केन्द्रित घन = 68 %
षट्कोणीय निविड संकुलित जालक = 74%
∴षट्कोणीय निविड संकुलित जालक में उच्चतम संकुलन क्षमता होती है।
प्रश्न 18.
एक तत्व का मोलर द्रव्यमान 2.7 x 102 kg मोल -1 है, यह 405 pm लम्बाई की भुजा वाली घनीय एकक कोष्ठिका बनाता है। यदि उसका घनत्व 2.7 x 103 kg M3 है तो घनीय एकक कोष्ठिका की प्रकृति क्या है ?
उत्तर
हम जानते हैं –
Z = \(\frac{a^{3} \times \mathrm{N}_{\mathrm{A}} \times d}{\mathrm{M}}\) जहाँ, a = 405 PM .
= 405 x 10-10 cm
d = 2.7 x 103 किलोग्राम m-3= 2.7 ग्राम सेमी -3
M = 2.7 x 10-2kg मोल -1 = 27 ग्राम मोल -1
NA = 6.023 x 1023
Z = \(\frac{\left(405 \times 10^{-10}\right)^{3} \times 2.7 \times 6023 \times 10^{23}}{27}\)
Z = 4
∴ तत्व fcc (ccp) एकक सेल होगा।
प्रश्न 19.
जब एक ठोस को गर्म किया जाता है, तो किस प्रकार का दोष उत्पन्न हो सकता है, इससे कौन-से भौतिक गुण प्रभावित होते हैं और किस प्रकार ?
उत्तर
जब ठोस को गर्म करते हैं, तो रिक्तिका दोष उत्पन्न होता है। क्योंकि गर्म करने पर कुछ परमाणु या आयन जालक सतह को पूर्णतः छोड़ देते हैं। इस कारण पदार्थ का घनत्व घटता है।
प्रश्न 20.
निम्नलिखित किस प्रकार का स्टॉइकियोमीट्री दोष दर्शाते हैं –
(i) ZnS,
(ii) AgBr.
उत्तर
(i) ZnS, फ्रेंकेल दोष आयनों के आकार में बड़ा अन्तर होने के कारण प्रदर्शित करते हैं।
(ii) AgBr, फ्रेंकेल तथा शॉट्की दोनों दोष दर्शाता है।
प्रश्न 21.
समझाइए कि एक उच्च संयोजी धनायन को अशुद्धि की तरह मिलाने पर आयनिक ठोस में रिक्तिकाएँ किस प्रकार प्रविष्ट होती हैं ?
उत्तर
जब आयनिक ठोस में एक उच्च संयोजकता वाला केटायन अशुद्धि के रूप में मिलाया जाता है, तब मूल केटायन की कुल सतह उच्च संयोजकता वाले केटायन द्वारा घिर जाती है। उदाहरण के लिये – NaCl में Sr+2, प्रत्येक Sr+2 दो Na+ आयनों को प्रतिस्थापित करता है। ये एक Na+ आयन के एक साइट को घेरता तथा दूसरा साइट हमेशा खाली रहता है। इस प्रकार बनी केटायन रिक्तिका Sr+2 आयन की संख्या के बराबर होती है।
प्रश्न 22.
जिन आयनिक ठोसों में धातु-आधिक्य दोष के कारण ऋणात्मक रिक्तिका होती है, वे रंगीन होते हैं। इसे उपयुक्त उदाहरण की सहायता से समझाइए।
उत्तर
आयनिक ठोसों में धातु आधिक्य दोष के कारण बनी ऋणायनिक रिक्तिका विद्युतीय उदासीनता बनाये रखने के लिये मुक्त इलेक्ट्रॉनों द्वारा भरी जाती है। क्रिस्टल पर पड़ने वाले दृश्य प्रकाश की ऊर्जा को इन इलेक्ट्रॉनों द्वारा ग्रहण करके उत्तेजित अवस्था में जाने के कारण से रंगीन हो जाते हैं। उदाहरण के लिये – जब NaCl को सोडियम वाष्प की उपस्थिति में गर्म करने पर, Na+ आयन अधिकता में होते हैं, Cl–आयन उनके सामान्य स्थान को छोड़कर सतह पर आ जाते हैं । ऐनायन का खाली स्थान इलेक्ट्रॉन द्वारा भर जाता है तथा F-केन्द्र का निर्माण होता है। ये दृश्य प्रकाश से ऊर्जा अवशोषित कर पूरक रंगों का विकिरण करते हैं।
प्रश्न 23.
वर्ग-14 के तत्व कोn-प्रकार के अर्धचालक में उपयुक्त अशुद्धि द्वारा अपमिश्रित करके रूपांतरित करना है। यह अशुद्धि किस वर्ग से संबंधित होनी चाहिये ?
उत्तर
n-प्रकार के अर्धचालक उच्चतम समूह की अशुद्धियों के डोपिंग करने से प्राप्त होते हैं । अतः वर्ग 14 के तत्वों को n-प्रकार अर्धचालक में बदलने के लिये उनमें समूह-15 के तत्वों की डोपिंग की जाती है।
प्रश्न 24.
किस प्रकार के पदार्थों से अच्छे स्थायी चुम्बक बनाये जा सकते हैं ? लौह चुम्बकीय अथवा फेरीचुम्बकीय। अपने उत्तर को सत्यापित या सही सिद्ध कीजिए।
उत्तर
फेरोमैग्नेटिक पदार्थ फेरीमैग्नेटिक पदार्थों की तुलना में ज्यादा स्थायी चुम्बक बनाते हैं क्योंकि फेरोमैग्नेटिक ठोस में अयुग्मित इलेक्ट्रॉनों का चुम्बकीय आघूर्ण उन्हें समान दिशा में सीधे स्वतः प्रवर्तिता द्वारा
आता है। जबकि फेरीमैग्नेटिक ठोस में डोमेन का चुम्बकीय आघूर्ण एक सीध में समानान्तर या असमानान्तर दिशा में असमान संख्या में होता है।
ठोस अवस्था NCERT पाठ्य-पुस्तक प्रश्नोत्तर
प्रश्न 1.
‘अक्रिस्टलीय’ पद को परिभाषित कीजिए।अक्रिस्टलीय ठोसों के कुछ उदाहरण दीजिए।
उत्तर
एक ठोस अक्रिस्टलीय कहलाता है, यदि उसके संरचनात्मक कण अव्यवस्थित रूप से होते हैं या बेतरतीब रूप से व्यवस्थित होता है, बिना किसी व्यवस्था के।
उदाहरण के लिये – प्लास्टिक, काँच, रबर।
प्रश्न 2.
काँच, क्वार्ट्स जैसे ठोस से किस प्रकार भिन्न है ? किन परिस्थितियों में क्वार्ट्स को काँच में रूपांतरित किया जा सकता है ?
उत्तर
क्वार्ट्ज़ क्रिस्टलीय ठोस होता है, जबकि काँच एक अक्रिस्टलीय ठोस होता है। क्वार्ट्स को काँच में इसे गलाकर या तेजी से ठंडा करके बदला जा सकता है।
प्रश्न 3.
निम्नलिखित ठोसों का वर्गीकरण आयनिक, धात्विक, आण्विक, सहसंयोजक या अक्रिस्टलीय में कीजिए।
(i) टेट्राफॉस्फोरस डेकॉक्साइड (P4O10)
(ii) अमोनियम फॉस्फेट, (NH4)3 PO4
(iii) SiC
(iv) I2
(v) P4
(vi) प्लास्टिक
(vii) ग्रेफाइट
(viii) पीतल
(ix) Rb
(x) LiBr
(xi) Si.
उत्तर –
आयनिक – (NH4)3 PO4, LiBr
धात्विक – पीतल, Rb
आण्विक – P4O10, I2, P4, ठोस CO2
सहसंयोजक – ग्रेफाइट, SiC, Si
क्रिस्टलीय – प्लास्टिक।
प्रश्न 4.
(i) उपसहसंयोजन संख्या का क्या अर्थ है ?
(ii) निम्नलिखित परमाणुओं की उपसहसंयोजन संख्या क्या होती है –
(a) एक घनीय निविड संकुलित संरचना।
(b) एक अंत:केन्द्रित घनीय संरचना।
उत्तर
(i) एक कण में उसके घनीय पैकिंग (संकुलन) में निकटतम पड़ोसियों की संख्या को उसका उपसहसंयोजन संख्या कहते हैं।
(ii) (a) 12, (b) 8.
प्रश्न 5.
यदि आपको किसी अज्ञात धातु का घनत्व एवं एकक कोष्ठिका की विमाएँ ज्ञात हैं, तो क्या आप उसके परमाण्विक द्रव्यमान की गणना कर सकते हैं ? स्पष्ट कीजिए।
उत्तर

या
\(\mathrm{M}=\frac{d \times \mathrm{N}_{\mathrm{A}} \times a^{3}}{Z}\)
प्रश्न 6.
‘किसी क्रिस्टल की स्थिरता उसके गलनांक के परिमाण द्वारा प्रकट होती है’, टिप्पणी कीजिए। किसी आँकड़ा पुस्तक से जल, एथिल ऐल्कोहॉल, डाइएथिल ईथर तथा मेथेन के गलनांक एकत्र करें। इन अणुओं के मध्य अंतर-आण्विक बलों के बारे में आप क्या कह सकते हैं ?
उत्तर –
क्रिस्टल का स्थायित्व आकर्षण बल पर निर्भर करता है। इसलिये क्रिस्टल का गलनांक जितना अधिक होगा, उतना ही अधिक अन्त:आण्विक आकर्षण बल तथा क्रिस्टल का स्थायित्व उतना ही अधिक होगा।

H2O, C2H5OH डाइ ईथाइल ईथर तथा मेथेन का गलनांक नीचे दिया गया है।
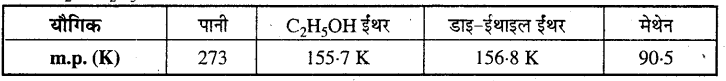
गलनांक के आधार पर इन अणुओं के बीच अंत:आण्विक बल की प्रबलता का क्रम निम्न होगा – पानी > डाइ-ईथाइल ईथर > ईथाइल एल्कोहॉल > मेथेन
प्रश्न 7.
निम्नलिखित युग्मों के पदों में कैसे विभेद करेंगे –
(i) षट्कोणीय निविड संकुलन एवं घनीय निविड संकुलन
(ii) क्रिस्टल जालक एवं एकक कोष्ठिका
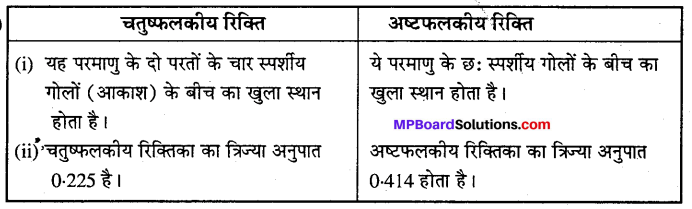
(iii) चतुष्फलकीय रिक्ति एवं अष्टफलकीय रिक्ति।
उत्तर
(i) NCERT पाठ्य-पुस्तक देखिए। क्रिस्टल जालक
(ii)

(iii)
प्रश्न 8.
निम्नलिखित जालकों में से प्रत्येक की एकक कोष्ठिका में कितने जालक बिन्दु होते हैं – (i) फलक-केन्द्रित घनीय, (ii) अंत:केन्द्रित चतुष्कोणीय, (iii) अंत:केन्द्रित।
उत्तर
(a) फलक-केन्द्रित घनीय व्यवस्था में जालक बिन्दुओं की संख्या = 8 (कोने पर) + 6 (फलक केन्द्रों पर) प्रति एकक कोष्ठिका में जालक बिन्दु = \(8 \times \frac{1}{8}+6 \times \frac{1}{2}\) = 4
(b) फलक-केन्द्रित चतुष्कोणीय व्यवस्था में जालक बिन्दुओं की संख्या = 8 (कोने पर) +6 (फलक केन्द्रों पर)
प्रति एकक कोष्ठिका में जालक बिन्दु = \(8 \times \frac{1}{8}+6 \times \frac{1}{2}\) = 4
अंतः केन्द्रित व्यवस्था में जालक, बिन्दुओं की संख्या = 8 (कोनों पर) + 1 या केन्द्रों पर)
प्रति एकक कोष्ठिका में जालक बिन्दु
= \(8 \times \frac{1}{8}+1\)
= 2.
प्रश्न 9.
समझाइए –
(i) धात्विक एवं आयनिक क्रिस्टलों में समानता एवं विभेद का आधार।
(ii) आयनिक ठोस कठोर एवं भंगुर होते हैं।
उत्तर
(i) धात्विक तथा आयनिक क्रिस्टल –
(a) धात्विक तथा आयनिक ठोसों दोनों का गलनांक उच्च होता है।
(b) आयनिक ठोस कठोर तथा भंगुर होते हैं परन्तु धात्विक ठोस कठोर परन्तु भंगुर नहीं होते हैं। धातु आघातवर्धनीय व तन्य होते हैं।
(c) आयनिक ठोस कुचालक परन्तु गलित अवस्था तथा विलयन में अच्छे चालक (सुचालक) होते हैं। धात्विक ठोस, ठोस तथा द्रव व वाष्प अवस्था में भी सुचालक होते हैं।
(d) आयनिक ठोसों में संरचनात्मक (संघटक) इकाई केटायन तथा ऐनायन होते हैं। धात्विक ठोसों में संघटक इकाई करनैल (धनावेशित आयन) जो चारों ओर से विस्थानीकृत इलेक्ट्रॉनों के समृद्ध द्वारा घिरे होते हैं।
(ii) आयनिक ठोस विपरीत आवेशित आयनों के बीच प्रबल स्थिरवैद्युतीय आकर्षण बल होने के कारण कठोर होते हैं । ये भंगुर होते हैं क्योंकि आयनिक बंध अदिशात्मक होता है।
प्रश्न 10.
निम्नलिखित के लिए धातु के क्रिस्टल में संकुलन क्षमता की गणना कीजिए – (i) सरल घनीय, (ii) अंत:केन्द्रित घनीय, (iii) फलक-केन्द्रित घनीय। (यह मानते हुए कि परमाणु एक-दूसरे के सम्पर्क में हैं।)
एक परमाणु का आयतन
उत्तर –
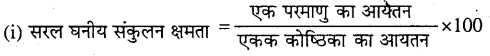
\(=\frac{\frac{4}{3} \pi r^{3}}{8 r^{3}} \times 100\)
(ii) अंतः केन्द्रित घनीय में संकुलन क्षमता

\(=\frac{2 \times \frac{4}{3} \pi r^{3}}{(4 / \sqrt{3}) r^{3}} \times 100\)
\(=\frac{(8 / 3) \pi r^{3}}{64 /(\sqrt{3}) r^{3}} \times 100=68 \%\)
(iii) फलक केन्द्रित घनीय में संकुलन क्षमता

\(=\frac{4 \times \frac{4}{3} \pi r^{3}}{(2 / \sqrt{2}) r^{3}} \times 100\)
प्रश्न 11.
चाँदी का क्रिस्टलीकरण fcc जालक में होता है। यदि इसकी कोष्ठिका के कोरों की लम्बाई 4.07 10-8cm तथा घनत्व 10.5 g cm-3 हो, तो चाँदी का परमाण्विक द्रव्यमान ज्ञात कीजिए।
उत्तर

प्रश्न 12.
एक घनीय ठोस दो तत्वों P एवं Q से बना है। घन के कोनों पर Q परमाणु एवं अंतः केन्द्र पर P परमाणु स्थित हैं। इस यौगिक का सूत्र क्या है ? P एवं Q की उपसहसंयोजन संख्या क्या है ?
उत्तर
परमाणु Q घन के 8 कोनों पर उपस्थित होता है, अतः इकाई सेल Q के परमाणुओं की संख्या = 8 × \(\frac{1}{8}\)=1
परमाणु P काया केन्द्र पर उपस्थित होता है, अतः प्रति इकाई सेल में P परमाणुओं की संख्या = 1
∴ यौगिक का सूत्र = PQ
प्रत्येक P तथा Q की समन्वयन संख्या = 8
प्रश्न 13.
नियोबियम का क्रिस्टलीकरण अंत:केन्द्रित घनीय संरचना में होता है। यदि इसका घनत्व 8:55 g cm-3 हो, तो इसके परमाण्विक द्रव्यमान 93 u का प्रयोग करके परमाणु त्रिज्या की गणना कीजिए।
हल –
घनत्व = 8.55 ग्राम सेमी -3
माना कि कोर की लम्बाई = a cm
प्रति इकाई सेल में परमाणुओं की संख्या = 2(bcc)
परमाण्वीय भार (M) = 93 ग्राम मोल -1
घनत्व \(d=\frac{\mathrm{Z} \times \mathrm{M}}{a^{3} \times \mathrm{N}_{\mathrm{A}}}\)

अब काया-केन्द्रित घन की त्रिज्या r =\(\frac{\sqrt{3}}{4} a\)
= \(\frac{\sqrt{3} \times 3306 \times 10^{-10}}{4}\)
= 1.431 x 10-10 M
= 0.143 nm.
प्रश्न 14.
यदि अष्टफलकीय रिक्ति की त्रिज्या हो तथा निविड संकुलन में परमाणुओं की त्रिज्या R हो, तोr एवं R में संबंध स्थापित कीजिए।
हल – अष्टफलकीय रिक्ति को ढंकने वाले ऊपर और नीचे की ओर स्थित परमाणुओं को चित्र में नहीं दर्शाया गया है। अष्टफलकीय रिक्ति का केन्द्र C है तथा उसकी त्रिज्या r के बराबर है। रिक्ति को घेरे हुए जो परमाणु स्थित है, उनकी त्रिज्या R है।
चित्रानुसार,
रिक्ति को घेरने वाले परमाणु की त्रिज्या BA = R
BC = रिक्ति की त्रिज्या + बाह्य परमाणु की त्रिज्या
= R+r
∠ABC = 45°
समकोण त्रिभुज ABC से, \(\frac{\mathrm{AB}}{\mathrm{BC}}\) = cos45° =\(\frac{1}{\sqrt{2}}\) = 0.707
या \(\frac{\mathrm{R}}{\mathrm{R}+r}=0 \cdot 707\)
या 0.707R + 0.707r = R
या 0.293R = 0.707r
\(\frac{r}{\mathrm{R}}=\frac{0 \cdot 293}{0 \cdot 707}\) = 0.414
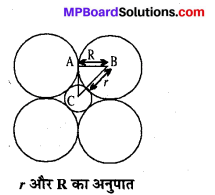
प्रश्न 15.
कॉपर fcc जालक रूप में क्रिस्टलीकृत होता है, जिसके कोर की लम्बाई 3.61 x 10-6 cm है। यह दर्शाइए कि गणना किए गए घनत्व के मान तथा मापे गए घनत्व 8.92 g cm-3 में समानता है।
हल – हम जानते हैं कि

ये मान अंकित मान के बहुत करीब है।
प्रश्न 16.
विश्लेषण द्वारा ज्ञात हुआ कि निकिल ऑक्साइड का सूत्र Ni0.98O1-100 है। निकिल आयनों का कितना अंश Ni2+ और Ni+ के रूप में विद्यमान है ?
हल – माना कि यहाँ Ni2+ के x आयन तथा (0.98 -X) आयन Ni3+ के हैं। यौगिक के विद्युतीय उदासीनता के लिये
Ni3+ तथा Ni3+ आयनों द्वारा कुल धनावेशित
आयनों का योगदान = O-2 आयनों द्वारा कुल ऋणावेश का योगदान
= (+2 × x) + (+3 × (0.98-x) = 2
2x + 2.94 – 3x = 2
x = 0.94
अत: Ni2+ का प्रभाज = \(\frac{0.94}{0.98}\) = 0.96 या 96%
0.98
Ni3+ का प्रभाज = (1 – 0.96) = 0.04 या 4%
प्रश्न 17.
अर्धचालक क्या होते हैं ? दो मुख्य अर्धचालकों की प्राप्ति कीजिए एवं उनकी चालकताक्रियाविधि में विभेद कीजिए।
उत्तर
अर्धचालक – अर्धचालक वे ठोस पदार्थ हैं, जिनकी विद्युत् चालकता चालकों व विद्युत्रोधी पदार्थों के बीच की होती है। इनकी चालकता 10-6 से 10 ohm-im-1 के बीच की होती है। इन पदार्थों में विद्युत् का संचालन अशुद्धियों के उपस्थिति के कारण होती है।
अर्धचालक निम्नलिखित दो प्रकार के होते हैं –
(i) n-प्रकार अर्धचालक-सिलिकॉन और जर्मेनियम में चार संयोजन इलेक्ट्रॉन होते हैं। क्रिस्टलों में इनका प्रत्येक परमाणु अपने निकटस्थ परमाणुओं के साथ चार सहसंयोजन बंध बनाता है। जब 15- वर्ग के तत्व जैसे P अथवा As जिसमें 5 सहसंयोजन इलेक्ट्रॉन होते हैं को अपमिश्रित किया जाता है तो यह सिलिकॉन अथवा जर्मेनियम के क्रिस्टल में कुछ जालक स्थलों में आ जाता है। P व As के पाँच में से चार इलेक्ट्रॉनों का उपयोग चार निकटस्थ Si अथवा Ge परमाणुओं के साथ चार सहसंयोजक बंध बनाने में होता है। पाँचवाँ अतिरिक्त इलेक्ट्रॉन विस्थापित हो जाता है। यह विस्थापित इलेक्ट्रॉन अपमिश्रित सिलिकॉन की चालकता में वृद्धि करता है। यह वृद्धि ऋणावेशित इलेक्ट्रॉन के कारण होती है। इसलिए इसे n-प्रकार का अर्धचालक कहा जाता है।
(ii) p-प्रकार अर्धचालक-सिलिकॉन अथवा जर्मेनियम को वर्ग-13 के तत्व B, AI, Ga के साथ भी अपमिश्रित किया जा सकता है। जिनमें केवल 3 संयोजक इलेक्ट्रॉन होते हैं। वर्ग-14 के तत्वों की तुलना में इनमें एक संयोजक इलेक्ट्रॉन की कमी होती है। वर्ग-13 के तत्व केवल तीन सहसंयोजक बंध बनाता है तथा चौथे इलेक्ट्रॉन के स्थान पर एक छिद्र उत्पन्न होता है जिसे इलेक्ट्रॉन छिद्र कहते हैं। यह छिद्र एक धनावेशित आवेश के समान गमन करके विद्युत् का संचालन करता है इसलिए इन्हें p-प्रकार का अर्धचालक कहा जाता है।
प्रश्न 18.
नॉनस्टॉइकियोमीट्री क्यूप्रस ऑक्साइड, Cu2O, प्रयोगशाला में बनाया जा सकता है। इसमें कॉपर तथा ऑक्सीजन का अनुपात 2 : 1 से कुछ कम है। क्या आप इस तथ्य की व्याख्या कर सकते हैं कि यह पदार्थ p-प्रकार का अर्धचालक है ?
उत्तर
Cu2O में 2 : 1 से कम का अनुपात होना, यह दर्शाता है कि कुछ क्यूप्रस आयन (Cu+) क्यूप्रिक आयन (Cu2+) द्वारा प्रतिस्थापित हो जाते हैं । विद्युतीय उदासीनता बनाये रखने के लिये प्रति दो Cu+ आयनों का एक Cu+2 आयन द्वारा प्रतिस्थापन होने पर एक छेद (होल) बन जाता है। क्योंकि चालकता इन्हीं धनावेशित होल की उपस्थिति के कारण होती है, इसलिये ये एक p-प्रकार का अर्धचालक है।
प्रश्न 19.
फेरिक ऑक्साइड, ऑक्साइड आयन के षट्कोणीय निविड संकुलन में क्रिस्टलीकृत होता है जिसकी तीन अष्टफलकीय रिक्तियों में से दो पर फेरिक आयन होते हैं। फेरिक ऑक्साइड का सूत्र ज्ञात कीजिए।
हल – ऑक्साइड आयनों की संख्या = n
अष्टफलकीय रिक्तियों की संख्या = n
Fe+3 आयनों की संख्या =\(\frac { 2 }{ 3 }\)n
Fe+3.O-2 = \(\frac { 2 }{ 3 }\) n:n
= 2 : 3
सूत्र
Fe3O3
प्रश्न 20.
निम्नलिखित को p-प्रकार या n-प्रकार के अर्धचालकों में वर्गीकृत कीजिए(i) In से डोपित Ge, (ii) B से डोपित Si..
उत्तर
(i) Ge समूह-14 का सदस्य है तथा In समूह-13 का। अतः एक इलेक्ट्रॉन-न्यून होल बनेगा। अत: यह n-प्रकार का अर्धचालक है।
(ii) B समूह 13 तथा Si समूह-14 का सदस्य है। अत: यहाँ एक इलेक्ट्रॉन मुक्त होगा। अत: यह nप्रकार का अर्धचालक होगा।
प्रश्न 21.
सोना ( परमाणु त्रिज्या = 0.144 nm) फलक-केन्द्रित एकक कोष्ठिका में क्रिस्टलीकृत होता है। इसकी कोष्ठिका के कोर की लम्बाई ज्ञात कीजिए।
हल – प्रश्नानुसार, r = 0.144 nm
fcc संरचना के लिये,
कोर लम्बाई (a) = 2√2 x परमाणु की त्रिज्या
=2 x 1.414 x 0.144
= 0.407 nm.
प्रश्न 22.
बैंड सिद्धान्त के आधार पर (i) चालक एवं रोधी, (ii) चालक एवं अर्धचालक में क्या अन्तर होता है ?
उत्तर
(i) एक कुचालक में संयोजी बैंड तथा चालन बैंड के बीच का ऊर्जा का अन्तर बहुत ज्यादा होता है, जबकि सुचालक में ऊर्जातर या तो बहुत कम या यहाँ संयोजी बैंड व चालन बैंड के बीच अतिव्यापन होता है।
(ii) सुचालक में संयोजी बैंड तथा चालन बैंड में ऊर्जातर बहुत कम या यहाँ संयोजी बैंड व चालन बैंड के बीच अतिव्यापन होता है। परन्तु अर्धचालक में इनके बीच हमेशा थोड़ा ऊर्जातर रहता ही है।
प्रश्न 23.
उचित उदाहरणों द्वारा निम्नलिखित पदों को परिभाषित कीजिए – (i) शॉट्की दोष, (ii) फ्रेंकेल दोष, (iii) अंतराकाशी, (iv) F-केन्द्र।
उत्तर
(i) शॉट्की त्रुटि (Schottky defect)—इस प्रकार की त्रुटि में क्रिस्टल जालक से कोई धनायन अपना स्थान छोड़कर लुप्त हो जाता है, अर्थात् वह क्रिस्टल 2 से बाहर हो जाता है । इसके परिणामस्वरूप दो घटनाएँ होती हैं – (i) उस आयन का स्थान रिक्त रह जाता है और (ii) सम्पूर्ण क्रिस्टल की विद्युत् उदासीनता को बनाये रखने के लिए एक अथवा अधिक (संयोजकतानुसार) ऋणायन भी क्रिस्टल से अपना स्थान छोड़कर बाहर निकल जाते हैं । अतः उनका स्थान भी रिक्त रह जाता है । इन दोनों घटनाओं से क्रिस्टल का घनत्व कम हो जाता है । यह त्रुटि मुख्यत: उच्च को-ऑर्डिनेशन संख्या वाले यौगिकों तथा ऐसे यौगिकों से में जिनके धनायन तथा ऋणायन के आकार लगभग बराबर होते हैं, पायी जाती है। उदाहरण-NaCl. CSCl आदि।
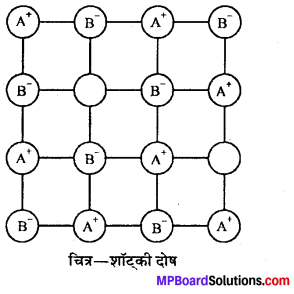
(ii) फ्रेन्केल त्रुटि (Frenkel defect)-आयनिक क्रिस्टलों में कोई (A धनायन अपना स्थान छोड़कर क्रिस्टल में ही कहीं रिक्त स्थान में चला जाये तो यह फ्रेन्केल दोष कहलाता है । इसमें किसी आयन के अनुपस्थित न होने (B से क्रिस्टल के घनत्व में कोई अन्तर नहीं आता । अवयवी धनायन और ऋणायन के आकार में अधिक अन्तर होने पर यह पाया जाता है; जैसे – ZnS, AgC] आदि।
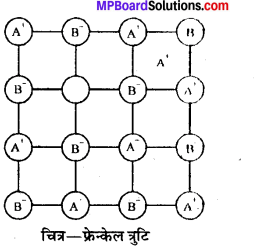
(iii) अन्तराकाशी-अन्तराकाशी परमाणु अथवा आयन जो क्रिस्टल (B) (A)-(B)(A) के समान्यतः रिक्त अन्तराकाशी स्थान को ग्रहण करते हैं, अन्तराकाशी . चित्र-फ्रेन्केल त्रुटि कहलाते हैं।
(iv) F-केन्द्र-अयुग्मित इलेक्ट्रॉनों द्वारा भरी ऋणायनिक रिक्तिका को F-केन्द्र कहते हैं। F = Farthe जो जर्मन शब्द है, जिसका अर्थ रंग होता है। अतः यह F-केन्द्र क्रिस्टलों को रंग प्रदान करता है। यह रंग इलेक्ट्रॉनों द्वारा क्रिस्टल पर पड़ने वाले प्रकाश से ऊर्जा अवशोषित करके उत्तेजित होने के परिणामस्वरुप दिखता है। उदाहरण-यदि सोडियम की आधिक्य को क्लोरीन के वातावरण में गर्म किया जाये तो F-केन्द्र के कारण यह पीला रंग उत्पन्न करता है।
प्रश्न 24.
ऐल्युमिनियम घनीय निविड संकुलित संरचना में क्रिस्टलीकृत होता है। इसका धात्विक अर्ध-व्यास 125 pm है।
(i) एकक कोष्ठिका के कोर की लम्बाई ज्ञात कीजिए।
(ii) 1.0 cm3 ऐल्युमिनियम में कितनी एकक कोष्ठिकाएँ होंगी?
हल –
(i) घनीय निविड संकुलित संरचना के लिये एकक कोष्ठिका के कोर की लम्बाई त्रिज्या से संबंधित होगी –
r = \(\frac{a}{2 \sqrt{2}}\)
या
a =r × 2√2
= 125 ×2 × 1.414 pm
= 353.5 pm
(ii) इकाई सेल का आयतन = (353.5 × 10-10 सेमी)3
= 4.42 × 10-23 सेमी’
1 सेमी3 में एकक कोष्ठिका की संख्या = \(\frac{1}{4.42 \times 10^{-23}} \)
= 2.26 × 1022 इकाई सेल या एकक कोष्ठिका।
प्रश्न 25.
यदि NaCl को SrCl2 के 10-3 मोल % से डोपित किया जाए, तो धनायनों की रिक्तियों का सांद्रण क्या होगा?
हल – हम जानते हैं कि SrCI2 की NaCl में डोपिंग में 2Na+ आयन प्रत्येक Sr+2 आयन द्वारा प्रतिस्थापित होते हैं। परन्तु प्रत्येक Sr+2 केवल एक एकक कोष्ठिका घेरता है। जिससे एक धनावेश रिक्तिका बनती है।
अत: NaCl में 100 मोलों को SrCl2 के 10-3 मोल द्वारा डोपिंग की गई है। .
अत: NaCl धनावेश रिक्तिका बनायेगा = 10-3 मोल
∵ 100 मोल NaCl की डोपिंग के बाद केटायन रिक्तिका = 10-3मोल
∴ 1 मोल NaCl की डोपिंग पर केटायन रिक्तिका होगी
=\(\frac{10^{-3}}{100}\) = 10-5
डोंपिग के बाद कुल केटायनिक रिक्तिका = 10-5 × NA
= 10-5 × 6.023 × 1023
= 6.023 × 1018 रिक्तिका।
प्रश्न 26.
निम्नलिखित को उचित उदाहरणों से समझाइए –
(i) लौहचुम्बकत्व, (ii) अनुचुम्बकत्व, (ii) फेरीचुम्बकत्व, (iv) प्रतिलौहचुम्बकत्व, (v) 12-16 और 13-15 वर्गों के यौगिक।
उत्तर
पदार्थों को उनके चुम्बकीय क्षेत्र के प्रति व्यवहार के आधार पर निम्न श्रेणियों में बाँटा जा सकता है
(i) प्रति तुम्बकीय पदार्थ (Diamagnetic)-वे पदार्थ जो बाह्य चुम्बकीय क्षेत्र द्वारा प्रतिकर्षित होते हैं, प्रति चुम्बकीय पदार्थ कहलाते हैं। इन पदार्थों के परमाणु, अणुओं या आयनों में सभी इलेक्ट्रॉन युग्मित होते हैं । उदाहरण-TiO2, NaCl आदि।

(ii) अनुचुम्बकीय पदार्थ (Paramagnetic)-वे पदार्थ जो चुम्बकीय क्षेत्र के द्वारा आकर्षित होते हैं, अनुचुम्बकीय पदार्थ कहलाते हैं। इन पदार्थों के परमाणुओं, अणुओं या आयनों में कुछ अयुग्मित (unpaired) इलेक्ट्रॉन होते हैं । चुम्बकीय क्षेत्र से पृथक् करने पर अपना चुम्बकत्व खो देते हैं।
उदाहरण-Cu+2, Fe+3, TiO, CuO, O2 आदि।
![]()
(iii) लौह चुम्बकीय पदार्थ (Ferromagnetic)-वे पदार्थ जो चुम्बकीय क्षेत्र द्वारा तीव्रता से आकर्षित होते हैं, लौह चुम्बकीय पदार्थ कहलाते हैं, इन पदार्थों को चुम्बकीय क्षेत्र से हटा लेने पर भी स्थायी चुम्बकत्व बनाए रखते हैं। उदाहरण- Fe, Co, Ni आदि। इनमें अयुग्मित इलेक्ट्रॉनों की संख्या अधिक तथा संरेखण एक ही दिशा में होता है।

(iv) प्रति लौह चुम्बकीय पदार्थ (Anti ferromgnetic)-ऐसे पदार्थ जिनमें आधे इलेक्ट्रॉन चक्रण एक प्रकार से पंक्तिबद्ध तथा आधे इलेक्ट्रॉन चक्रण दूसरे प्रकार से (विपरीत) पंक्तिबद्ध होते हैं, प्रति लौह
चुम्बकीय पदार्थ कहलाते हैं। इन पदार्थों में चुम्बकीय आघूर्ण नहीं होता तथा चुम्बकीय क्षेत्र में अनुचुम्बकीय व्यवहार प्रदर्शित नहीं करते।
उदाहरण-Cr2O3, MnO2, MnO आदि।
![]()
(v) लघु लौह चुम्बकीय पदार्थ (Ferimagnetic)-ऐसे पदार्थ जो बहुत अधिक अनुचुम्बकीय गुण प्रदर्शित करते हैं, फेरीचुम्बकीय कहलाते हैं। जैसे-Fe3o4 तथा फेराइट। इनका एक नेट चुम्बकीय आघूर्ण होता है।
(vi) वर्ग-12, 16 और 13-15 वर्ग के यौगिक-वर्ग- 13 एवं 15 अथवा वर्ग- 12 तथा 16 के तत्वों के सम्मिश्रण से अनेक प्रकार के ठोस पदार्थ बनाए गए है। जिनकी औसत संयोजकता Ge या Si के समान 4 है। इनमें से वर्ग 13-15 के विशिष्ट यौगिक InSb, AIP तथा GaAs है। गैलियम आर्सेनाइड अर्धचालक त्वरित प्रतिसंवेदी होते हैं। इन्होंने अर्धचालक युक्तियों के निर्माण में क्रांतिकारी हलचल ला दी है। ZnS, Cds, SdSe तथा HgTe वर्ग-12-16 यौगिकों के उदाहरण हैं । इन यौगिकों में बंध पूर्णतः सहसंयोजक नहीं होते तथा इनके आयनिक गुण इनमे उपस्थित दोनो तत्वों के विद्युत् ऋणात्मकता पर निर्भर करते हैं।
ठोस अवस्था अन्य महत्वपूर्ण प्रश्नोत्तर
ठोस अवस्था वस्तुनिष्ठ प्रश्न
1. सही विकल्प चुनकर लिखिए
प्रश्न 1.
फ्रेन्केल दोष के कारण आयनिक ठोसों का घनत्व –
(a) घटता है
(b) बढ़ता है
(c) परिवर्तित नहीं होता है
(d) परिवर्तित होता है।
उत्तर
(c) परिवर्तित नहीं होता है
प्रश्न 2.
CsCl में प्रत्येक Cl कितने Cs से संकुलित है –
(a) 8
(b) 6
(c) 4
(d) 2
उत्तर
(a) 8
प्रश्न 3.
फ्रेन्केल दोष प्रदर्शित नहीं करता है
(a) AgBr
(b) AgCl
(c) KBr
(d) ZnS.
उत्तर
(c) KBr
प्रश्न 4.
NaCI क्रिस्टल में समान दूरी पर स्थित विरोधी आवेश वाले आयनों की संख्या होती है –
(a) 8
(b) 6
(c) 4
(d) 2.
उत्तर
(b) 6
प्रश्न 5.
विद्युत् का सबसे अच्छा सुचालक है –
(a) हीरा
(b) ग्रेफाइट
(c) सिलिकॉन
(d) कार्बन (अक्रिस्टलीय)।
उत्तर
(b) ग्रेफाइट
प्रश्न 6.
NaCl क्रिस्टल में किस प्रकार का बिन्दु दोष पाया जाता है
(a) फ्रेन्केल दोष
(b) शॉट्की दोष
(c) रैखिक दोष
(d) अशुद्धि दोष।
उत्तर
(b) शॉट्की दोष
प्रश्न 7.
विभिन्न क्रिस्टल तन्त्रों से कुल कितने त्रिविम जालक (ब्रेविस जालक ) प्राप्त होते हैं –
(a) 7
(b) 14
(c) 32
(d) 230.
उत्तर
(b) 14
प्रश्न 8.
हीरा है एक –
(a) H बन्ध युक्त ठोस
(b) आयनिक ठोस
(c) सहसंयोजक ठोस
(d) काँच।
उत्तर
(c) सहसंयोजक ठोस
प्रश्न 9.
फ्लुओराइड संरचना में Ca+2 आयनों की कोऑर्डीनेशन संख्या होती है –
(a) 4
(b) 6
(c) 8
(d) 3.
उत्तर
(c) 8
प्रश्न 10.
किस यौगिक से 8 : 8 समन्वय अंक पाया जाता है –
(a) MgO
(b) Al2O3
(c) CsCl
(d) इन सभी में।
उत्तर
(c) CsCl
प्रश्न 11.
काय केन्द्रित घनीय जालक की समन्वय संख्या होती है –
(a) 8
(b) 12
(c) 6
(d) 4
उत्तर
(a) 8
प्रश्न 12.
यूनिट सेल का घनत्व है
(a) \(\frac{\mathrm{ZM}}{a^{3} \mathrm{N}}\)
(b) \(\frac{\mathrm{ZN}}{a^{3} \mathrm{M}} \)
(c) \(\frac{\mathrm{Na}^{3}}{\mathrm{Z}}\)
(d) \(\frac{z}{M N}\)
उत्तर
(a) \(\frac{\mathrm{ZM}}{a^{3} \mathrm{N}}\)
प्रश्न 13.
एक बंद घनीय संकुलित इकाई कोशिका में उपस्थित चतुष्फलकीय रिक्तियों की संख्या होती है –
(a) 4
(b) 8
(c) 6
(d) 2
उत्तर
(b) 8
प्रश्न 14.
सीजियम क्लोराइड क्रिस्टल की अन्तरा आयनिक दूरी होगी –
(a) 1
(b) \(\frac { a }{ 2 }\)
(c) \(\frac{\sqrt{3} a}{2}\)
(d) \(\frac{2 a}{\sqrt{3}}\)
उत्तर
(c) \(\frac{\sqrt{3} a}{2}\)
प्रश्न 15.
अंत: केन्द्रित घनीय यूनिट सेल में परमाणुओं की संख्या होती है –
(a) 1
(b) 2
(c) 3
(d) 4.
उत्तर
(b) 2
प्रश्न 16.
निम्नलिखित में कौन-सा ब्रेग समीकरण है –
(a) nλ = 2θ sinθ
(b) nλ = 2d sinθ
(c) nλ = sinθ
(d) \(\frac{n}{2}=\frac{d}{2} \sin \theta\)
उत्तर
(b) nλ = 2d sinθ
प्रश्न 17.
सहसंयोजक क्रिस्टल का रचक घटक है –
(a) परमाणु
(b) अणु
(c) आयन
(d) उपर्युक्त सभी।
उत्तर
(a) परमाणु
प्रश्न 18.
NaCl क्रिस्टल की इकाई कोशिका में उपस्थित Na परमाणुओं की संख्या है –
(a) 1
(b) 2
(c) 3
(d) 4.
उत्तर
(d) 4.
प्रश्न 19.
Fe, CO, Ni किस प्रकार के चुम्बकीय पदार्थ है –
(a) अनुचुम्बकीय
(b) लौहचुम्बकीय
(c) प्रतिचुम्बकीय
(d) प्रतिलौहचुम्बकीय।
उत्तर
(b) लौहचुम्बकीय
प्रश्न 20.
“फ्रेंकेल दोष” का सही उदाहरण है –
(a) NaCl
(b) CsCI
(c) KC
(d) AgCl.
उत्तर
(d) AgCl.
प्रश्न 21.
शुष्क बर्फ (ठोस CO2) है –
(a) आयनिक क्रिस्टल
(b) सहसंयोजी क्रिस्टल
(c) आण्विक क्रिस्टल
(d) धात्विक क्रिस्टल।
उत्तर
(c) आण्विक क्रिस्टल
प्रश्न 22.
CsCl की संरचना में Cs की समन्वयन संख्या है –
(a) Cl के समान अर्थात् 6 है
(b) Cl के समान अर्थात् 8 है
(c) Cl के असमान अर्थात् 8 है
(d) Cl के असमान अर्थात् 6 है।
उत्तर
(b) Cl के समान अर्थात् 8 है
प्रश्न 23.
NaCl क्रिस्टल की संरचना है –
(a) द्विसमलम्बाक्ष
(b) घनीय
(c) विषमलम्बाक्ष
(d) एकनताक्ष ।
उत्तर
(b) घनीय
प्रश्न 24.
NaCl क्रिस्टल में प्रत्येक Na’ आयन घिरा हुआ है –
(a) तीन Cl– आयनों से
(b) आठ Cl– आयनों से
(c) चार Cl– आयनों से
(d) छ: Cl– आयनों से।
उत्तर
(d) छ: Cl– आयनों से।
प्रश्न 25.
क्रिस्टल में विद्युत् चालकता उत्पन्न करने हेतु अशुद्धि मिलाने की क्रिया कहलाती है –
(a) शॉट्की त्रुटि
(b) फ्रेन्केल त्रुटि
(c) डोपिंग
(d) इलेक्ट्रॉनिक अपूर्णता ।
उत्तर
(c) डोपिंग
प्रश्न 26.
KCl क्रिस्टल में किस प्रकार का जालक पाया जाता है
(a) फलक केन्द्रित घनाकृति
(b) अन्त:केन्द्रित घनाकृति
(c) साधारण घनाकृति
(d) साधारण चतुष्कोण।
उत्तर
(a) फलक केन्द्रित घनाकृति
प्रश्न 27.
एकपरमाण्विक पदार्थ के अन्तः केन्द्रित घनीय यूनिट सेल में परमाणुओं की संख्या होगी –
(a) 1
(b) 2
(c) 3
(d) 4.
उत्तर
(b) 2
प्रश्न 28.
समचतुष्फलक सममिति के लिए त्रिज्या अनुपात की सीमा है –
(a) 0.155
(b) 0.414
(c) 0.732
(d) 0.225.
उत्तर
(d) 0.225.
प्रश्न 29.
क्रिस्टल जालक में से एक धनायन एवं एक ऋणायन अनुपस्थित होने पर उत्पन्न दोष को कहते –
(a) शॉट्की दोष
(b) फ्रेन्केल दोष
(c) क्रिस्टल दोष
(d) आयनिक दोष।
उत्तर
(a) शॉट्की दोष
प्रश्न 30.
CsCl में यदि Cs+की को-ऑर्डिनेशन संख्या 8 हो तो, Cl– आयन की को-ऑर्डिनेशन संख्या होगी –
(a) 8
(b) 4
(c) 6
(d) 12.
उत्तर
(a) 8
2. एक शब्द/वाक्य में उत्तर दीजिए –
- धात्विक क्रिस्टल के दो उदाहरण दीजिए।
- सहसंयोजी क्रिस्टल के दो उदाहरण दीजिए।
- आयनिक क्रिस्टल के दो उदाहरण दीजिए।
- CaF2 में F आयन की समन्वय संख्या का मान होता है।
- SiC किस प्रकार का ठोस है ?
- षट्भुजीय संकुलित संरचना में समन्वय संख्या का क्या मान होता है ?
- त्रिज्या अनुपात का सूत्र लिखिए।
- NaCl क्रिस्टल की संरचना किस तरह की होती है ?
- अन्त:केन्द्रित घनीय सेल का एक उदाहरण लिखिए।
- ऐसे यौगिक का उदाहरण दीजिए जिसमें शॉट्की एवं फ्रेंकेल दोनों प्रकार के दोष होते हैं।
- आभासी ठोस या अक्रिस्टलीय ठोस के दो उदाहरण दीजिए।
- ड्रग समीकरण लिखिए।
- शॉट्की त्रुटि से पदार्थ या क्रिस्टल के घनत्व पर क्या प्रभाव होता है ?
- CsCl की संरचना का केवल चित्र बनाइए।
- CsCl व NaCl की समन्वय संख्या बताइए।
- दो अतिचालक पदार्थों के सूत्र लिखिए।
- फ्रेन्केल त्रुटि का एक उदाहरण दीजिए।
- अतिचालक का एक उदाहरण दीजिए।
- चतुष्फलकीय रिक्तिका का त्रिज्या अनुपात होता है।
उत्तर
- कॉपर, निकिल
- हीरा, ग्रेफाइट
- NaCl, NaNO3
- चार
- सहसंयोजी ठोस
- 12
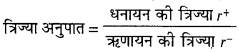
- घनीय
- CsCl,
- AgBr,
- काँच, प्लास्टिक,
- nλ = 2d sinθ
- शॉटकी त्रुटि के कारण पदार्थ का घनत्व कम हो जाता है,
- CsCl की समन्वय संख्या 8 : 8, NaCl की समन्वय संख्या 6 : 6,
- (i) γBa2Cu3O7, (ii) Bi2Ca2Sr2Cu3O10
- AgCl
- Ba0.7K0.3BiO3
- 0.225.
3. रिक्त स्थानों की पूर्ति कीजिए –
- क्रिस्टल जालक में से एक धनायन व एक ऋणायन अनुपस्थित होने पर उत्पन्न त्रुटि को …………………. कहते हैं।
- यदि ठोस क्रिस्टल जालक में एक धनायन अपने स्थान से हटकर अन्तराकाशी स्थान पर उपस्थित हो तो उस त्रुटि को …………………. कहते हैं।
- पिघली अवस्था में NaCl के विद्युत् का सुचालक होने का कारण …………………. है।
- …………………. त्रुटि के कारण क्रिस्टल का घनत्व कम हो जाता है।
- कुल …………………. प्रकार के क्रिस्टल तंत्र होते हैं।
- सर्वप्रथम …………………. ने ‘परमाणु’ की अवधारणा प्रस्तुत की थी।
- किसी क्रिस्टल में उपस्थित धन आयन तथा ऋण आयन की त्रिज्याओं के अनुपात को …………………. कहते हैं।
- किसी तत्व या यौगिक में अशुद्धियों की अल्प मात्रा मिलाने की क्रिया को …………… कहते हैं।
- कुल 14 प्रकार की विभिन्न एकक सेलें होती हैं। जिन्हें ………………. कहते हैं।
- NaCl क्रिस्टल संरचना में Na+ तथा Cl– दोनों आयनों की उप-सहसंयोजन संख्या …………………. होती है।
- ZnS एवं AgCl के क्रिस्टल में ………….. दोष पाया जाता है।
- शॉट्की त्रुटि के कारण पदार्थ का घनत्व ………… हो जाता है।
- धात्विक ठोसों में चालकता …………….की उपस्थिति के कारण होती है।
- बिन्दु दोष ……………… क्रिस्टलों में पाये जाते हैं।
- चुम्बकीय क्षेत्र द्वारा आकर्षित होने वाला पदार्थ ………………….. कहलाता है।
- किसी इकाई सेल के लिए r = a/√8 हो, तो वह ……………… प्रकार का इकाई सेल होगा।
- ताप बढ़ाने पर अर्द्धचालकों की चालकता में …………………. होती है।
उत्तर-
- शॉट्की त्रुटि
- फ्रेंकेल दोष
- स्वतंत्र आयन
- शॉट्की
- सात
- कणाद
- त्रिज्या अनुपात
- डोपिंग
- ब्रेविस जालक
- छ:
- फ्रेंकेल
- कम
- मुक्त इलेक्ट्रॉन
- आयनिक
- अनुचुम्बकीय पदार्थ
- fcc
- वृद्धि।
4. उचित संबंध जोडिए –
I.

उत्तर
1. (b), 2. (d), 3. (c), 4. (a).
II.

उत्तर
1. (c), 2. (d), 3. (a), 4. (b).
III.

उत्तर
1. (d), 2. (c), 3. (b), 4. (a).
IV.

उत्तर
1. (c), 2. (d), 3. (a), 4. (b).
ठोस अवस्था अति लघु उत्तरीय प्रश्न
प्रश्न 1.
क्रिस्टलीय ठोस किसे कहते हैं ? क्रिस्टलीय ठोस कितने प्रकार के होते हैं ? –
उत्तर
क्रिस्टलीय ठोस (Crystalline solids)-वे ठोस जिनमें अवयवी कणों (जैसे-परमाणु, अणु या आयन) का नियमित क्रम होता है, इनकी निश्चित ज्यामिति होती है। क्रिस्टलीय ठोस कहलाते हैं। क्रिस्टलीय ठोस चार प्रकार के होते है
- आयनिक क्रिस्टल
- सहसंयोजी क्रिस्टल
- आण्विक क्रिस्टल
- धात्विक क्रिस्टल।
प्रश्न 2.
यूनिट सेल के घनत्व का सूत्र लिखिए ।
उत्तर

\(=\frac{\mathrm{Z} \times \mathrm{M}}{a^{3} \times \mathrm{N}}\)
प्रश्न 3.
क्रिस्टल जालक किसे कहते हैं ?
उत्तर
किसी क्रिस्टल की वह ज्यामिती जिसमें इकाई कोशिका क्रमबद्ध रूप से व्यवस्थित है, तथा इकाई कोशिका की आकृति के सामान क्रिस्टल बनाती है, क्रिस्टल जालक कहलाती है।
प्रश्न 4.
इकाई कोशिका किसे कहते हैं ? .
उत्तर
इकाई कोशिका-किसी क्रिस्टल में उसके संघटक कणों परमाणु, अणु, आयनों के क्रमबद्ध रूप से व्यवस्थित रहने पर जो सूक्ष्मतम इकाई बनती है, उसे क्रिस्टल की इकाई कोशिका कहते हैं। .
प्रश्न 5.
निम्नलिखित के दो-दो उदाहरण लिखिए –
(i) प्रतिचुम्बकीय पदार्थ (Diamagnetic)
(ii) अनुचुम्बकीय पदार्थ (Paramagnetic)
(iii) लौह चुम्बकीय पदार्थ (Ferromagnetic)
(iv) लघु लौह चुम्बकीय पदार्थ (Ferromagnetic).
उत्तर
(i) TiO2, NaCl
(ii) Cu+2, Fe3+
(iii) Fe, Co
(iv) Fe3O4, फेराइट।
प्रश्न 6.
निम्नलिखित के संरचना व को-ऑर्डिनेशन संख्या लिखिए –
(a) CSCl
(b) NaCI
(c) Zn.
उत्तर
(a) CSCl सरंचना व्यवस्था-घनीय (Cubic)
को-ऑर्डिनेशन संख्या-8
(b) NaCl संरचना व्यवस्था – अष्टफलकीय
को-ऑर्डिनेशन संख्या-6
(c) Zn संरचना व्यवस्था — चतुष्फलकीय
को-ऑर्डिनेशन संख्या-4.
प्रश्न 7.
क्रिस्टल ज्यामिति के आधार पर सात मूल प्रकार के क्रिस्टल कौन-कौन से हैं ? .
उत्तर
- घनीय (Cubic)
- द्विसमलम्बाक्ष (Teragonal)
- विषम लम्बाक्ष (Orthorhombic)
- एकनताक्ष (Mono clinic)
- षट्कोणीय (Hexagonal)
- त्रिसमनताक्ष (Rhombohedral)
- त्रिनताक्ष (Triclinic)।
प्रश्न 8.
समचतुर्भुजीय जालक के प्रकारों के नाम लिखिए ।
उत्तर
घनीय अथवा समचतुर्भुजीय क्रिस्टलों के प्रकार
- सरल घनीय (Simple cubic)
- काय केन्द्रित / अंतः केन्द्रित घनीय (Body centred cubic)
- फलक केन्द्रित घनीय (Face centred cubic) ।
प्रश्न 9.
NaCl की संरचना में Na+ और Cl–आयनों की को-ऑर्डिनेशन संख्या क्या है ?
उत्तर
NaCl की संरचना में Na+ आयन की को-ऑर्डिनेशन संख्या = 6 तथा Cl– आयन की कोऑर्डिनेशन संख्या = 6 है ।
अर्थात् प्रत्येक Na+ आयन 6 Cl– आयनों से व प्रत्येक CI–आयन, 6 Na+आयनों से घिरा रहता है।
प्रश्न 10.
को-ऑर्डिनेशन संख्या क्या है ? को-ऑर्डिनेशन संख्या पर ताप व दाब का क्या प्रभाव पड़ता है ?
उत्तर
“किसी क्रिस्टल जालक में किसी संघटक कण के चारों तरफ पड़ोसी आयनों या परमाणुओं की संख्या उस कण की को-ऑर्डिनेशन संख्या कहलाती है।” उच्च दाब पर को-ऑर्डिनेशन संख्या में वृद्धि होती है एवं उच्च ताप पर को-ऑर्डिनेशन संख्या में कमी होती है ।
प्रश्न 11.
क्रिस्टलों के X- किरण विवर्तन अध्ययन से क्या जानकारी मिलती है ?
उत्तर
क्रिस्टल के X-किरण विवर्तन अध्ययन से ज्ञात होता है कि क्रिस्टल के संघटक कण समान दूरी पर एक सुक्रमित क्रम में पुनरावृत्त होकर पास-पास स्थित समतलों में स्थित रहते हैं ।
प्रश्न 12.
पुरानी बिल्डिंग के विंडो ग्लास दूधिया दिखाई पड़ते हैं, क्यों ?
उत्तर
दिन में काँच गर्म हो जाता है तथा रात में ठण्डा हो जाता है। इस प्रकार एनीलिंग की क्रिया होती है। एनीलिंग के कारण कई वर्षों में काँच में क्रिस्टलीय गुण उत्पन्न हो जाता है तथा विंडो ग्लास दूधिया रंग के दिखाई पड़ते हैं।
प्रश्न 13.
साधारण नमक कभी-कभी रंगहीन के स्थान पर पीला दिखता है, क्यों?
उत्तर
साधारण नमक में धातु अधिक्य त्रुटि के कारण ऋणायन Cl– अपने नियत जालक बिंदु से गायब हो जाता है। किन्तु एक इलेक्ट्रॉन वहाँ छोड़ जाता है। जिससे क्रिस्टल विद्युत् उदासीन रहता है । ऋणायन के रिक्त स्थान पर एक छिद्र बनता है। इस छिद्र को F केन्द्र कहते हैं। इस कारण NaCl पीला दिखता है।
प्रश्न 14.
ताप बढ़ने के साथ अर्धचालकों की विद्युत् चालकता बढ़ जाती है क्यों?
उत्तर
अर्धचालको के संयोजक बैण्ड एवं चालक बैण्ड के मध्य अंतराल कम होता है। अतः कुछ इलेक्ट्रॉन ताप बढ़ने पर संयोजक बैण्ड को लाँघ कर चालक बैण्ड में चले जाते है। जिसके कारण ताप बढ़ने के साथ अर्धचालाकों की विद्युत् चालकता बढ़ जाती है।
ठोस अवस्था लघु उत्तरीय प्रश्न
प्रश्न 1.
आयनिक त्रिज्या अनुपात क्या है ?
उत्तर-
आयनिक त्रिज्या अनुपात-किसी क्रिस्टल में उपस्थित धन आयन तथा ऋण आयन की त्रिज्याओं का अनुपात होता है –

जैसे – Na+ आयन की त्रिज्या 95 pm और Cl– आयन की त्रिज्या 181 pm है, तो NaCl क्रिस्टल में Na+और Cl– का त्रिज्या अनुपात 95 / 181 = 0.52 होगा । क्रिस्टल में अन्य बलों के कारण वास्तविक त्रिज्या अनुपात का प्रेक्षित मान कुछ कम आता है I NaCl क्रिस्टल में यह मान 0.52 न होकर 0.414 आता है ।
प्रश्न 2.
सीजियम क्लोराइड क्रिस्टल की संरचना का संक्षेप में वर्णन कीजिए।
उत्तर
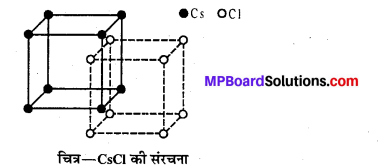
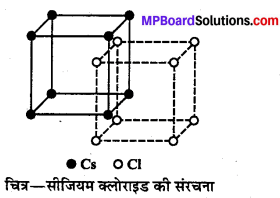
यह AB प्रकार का अन्त:केन्द्रित घनीय (bcc) आयनिक क्रिस्टल है। इसमें Cs+ आयन घन के केन्द्र पर तथा Cl– आयन घन के कोनों पर (या इसके विपरीत) स्थित होते हैं । इसकी को-ऑर्डीनेशन संख्या 8 : 8 होती है तथा Cs+ तथा Cl– की त्रिज्या का अनुपात 0.732 होता है। CsCl के यूनिट सेल में एक Cs+ आयन और एक Cl– आयन होता है –
Cs+ = 1 (अन्तः केन्द्र पर) × 1 = 1
Cl–= 8 (कोनों पर) × 1/8 = 1.
प्रश्न 3.
एकक सेल के घनत्व की गणना कीजिए।
उत्तर
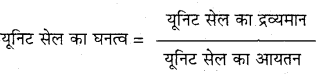
यदि एकक सेल के कणों (परमाणु, अणु, आयनों) की संख्या 2 हो एवं प्रत्येक कण का द्रव्यमान हो तब
एकक सेल का द्रव्यमान = m x 2 ……..1
यदि पदार्थ का मोलर द्रव्यमान M हो तब प्रत्येक कण का द्रव्यमान
m =\(\frac{\mathrm{M}}{\mathrm{N}}\) (N0 ऐवोगैड्रो संख्या है)
समी. (1) में m का मान रखने पर
एकक सेल का द्रव्यमान = \(\frac{M}{N_{0}} \times 2\) ……………….2
यदि घनीय एकक सेल के किनारे की लम्बाई a हो तब
एकक सेल का आयतन = a 3 …….. 3
समी. (2) को समी. (3) से विभाजित करने पर एकक सेल का घनत्व (P) प्राप्त होता है।
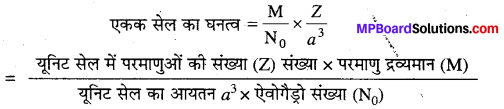
प्रश्न 4.
दो तत्व A तथा B से बना यौगिक घनीय संरचना प्रदर्शित करता है, जिसमें सभी A परमाणु घन के शीर्षों पर तथा B परमाणु घन के फलक के केन्द्रों पर व्यवस्थित हैं। यौगिक का सूत्र क्या होगा?
उत्तर
घन के शीर्षों पर स्थित 8A परमाणु 8 घनों से भागीदारी करते हैं । अत: एकक सेल में,
A परमाणुओं की संख्या = 8 \(\times \frac{1}{8}\) = 1
इसी प्रकार B परमाणु घन के छ: फलकों के केन्द्र पर हैं तथा प्रत्येक फलक दो घनों से भागीदारी करता है । अतः एकक सेल में,
B परमाणुओं की संख्या = 6 \(\times \frac{1}{2}\) = 3.
अतः यौगिक का अणु सूत्र AB3 होगा ।
प्रश्न 5.
सिद्ध करो कि फलक केन्द्रित घनीय संरचना के एकक सेल में चार परमाणु होते हैं ।
उत्तर
फलक केन्द्रित घनीय सेल (Face Centred Cubic Cell) – इसमें घन के कोनों पर स्थित प्रत्येक फलक (छ:) पर एक-एक परमाणु होते हैं, जिनका समीपवर्ती दो फलकों द्वारा साझा होता है । इस
प्रकार –
fcc सेल के प्रति यूनिट सेल में परमाणुओं की संख्या
=\(8 \times \frac{1}{8}\) – (आठों कोनों पर )+ 6 \(\times \frac{1}{2}\) (छ: फलकों के केन्द्र पर होती है)
=1 + 3 = 4.
प्रश्न 6.
बॅग समीकरण लिखिए ।
उत्तर
बॅग समीकरण निम्न है –
2d sinθ= nλ
जहाँ d = क्रिस्टल में दो क्रमागत तलों के बीच की दूरी, θ =X-किरण पुंज का आपतन कोण, N = सरल पूर्णांक और λ = x-किरणों का तरंगदैर्घ्य होते हैं । इससे क्रिस्टल के तलों के बीच की दूरी d ज्ञात की जाती है।
ठोस अवस्था दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
क्रिस्टलीय तथा अक्रिस्टलीय ठोस में क्या अन्तर है ?
उत्तर-
क्रिस्टलीय तथा अक्रिस्टलीय ठोस में अन्तर –
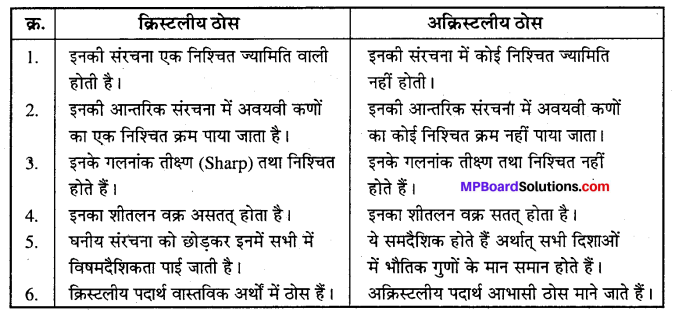
प्रश्न 2.
फ्रेन्केल त्रुटि और शॉट्की त्रुटि में अन्तर लिखिए ।
उत्तर
फ्रेन्केल त्रुटि और शॉट्की त्रुटि में प्रमुख अन्तर –
- क्रिस्टल जालक में किसी धनायन का अपने स्थान से हटकर जालक में ही किसी अन्य स्थान पर उपस्थित रहने पर फ्रेन्केल त्रुटि उत्पन्न होती है, जबकि शॉट्की त्रुटि में एक-एक धनायन और ऋणायन अनुपस्थित रहते हैं । क्रिस्टल जालक में ये स्थान रिक्त पड़े रहते हैं ।
- फ्रेन्केल त्रुटि के कारण पदार्थ के घनत्व पर कोई प्रभाव नहीं पड़ता, लेकिन शॉट्की त्रुटि के कारण पदार्थ का घनत्व कम हो जाता है ।
- फ्रेन्केल त्रुटि से पदार्थ में विद्युत् चालकता आ जाती है, किन्तु शॉट्की त्रुटि में ऐसा नहीं होता ।
- फ्रेन्केल त्रुटि ऐसे पदार्थों में पायी जाती है, जिनमें केटायन का आकार ऐनायन की तुलना में बहुत छोटा होता है, जबकि शॉट्की त्रुटि उन क्रिस्टलों में पाई जाती है जिनमें केटायनं तथा ऐनायन के आकार लगभग समान होते हैं ।
प्रश्न 3.
क्रिस्टलों में अपूर्णता से क्या समझते हो? इसके क्या कारण हैं ?
उत्तर
क्रिस्टलों की संरचना से ऐसा प्रतीत होता है कि उनमें उनके अवयवी कणों की व्यवस्था पूर्णतः नियमित होती है, किन्तु वास्तविक क्रिस्टलों में ऐसा नहीं होता (क्योंकि एक सम्पूर्ण क्रिस्टल प्राप्त करना लगभग असम्भव है) तथा उनकी संरचना में अपूर्णताएँ होती हैं। क्रिस्टलों में अपूर्णताएँ निम्नलिखित कारणों से होती हैं –
- ताप–0 K पर क्रिस्टलों की ऊर्जा न्यूनतम होती है । ऐसे क्रिस्टल जिनमें अपूर्णताएँ नहीं होती हैं, आदर्श क्रिस्टल कहलाते हैं । 0 K से अधिक ताप पर क्रिस्टलों की नियमित व्यवस्था से विचलन आरम्भ हो जाता है, जिससे अपूर्णताएँ निर्मित होती हैं ।
- अशुद्धियों की उपस्थिति—कभी-कभी अशुद्धियों की उपस्थिति के कारण क्रिस्टलों की क्रमबद्ध व्यवस्था अव्यवस्थित हो जाती है, जिससे अपूर्णता या दोष उत्पन्न हो जाते हैं ।
प्रश्न 4.
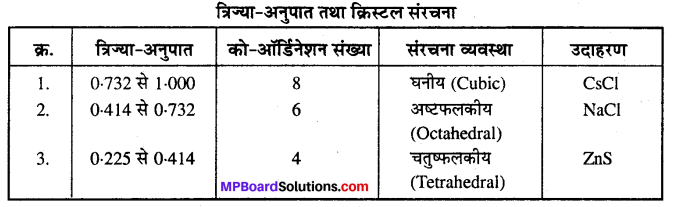
क्रिस्टल संरचना में त्रिज्या-अनुपात का महत्व बताइए ।
उत्तर
क्रिस्टल संरचना में आयनिक त्रिज्या का महत्व-क्रिस्टल की संरचना में त्रिज्या-अनुपात का संबंध को-ऑर्डिनेशन संख्या से है, जिसकी सहायता से क्रिस्टल की ज्यामिति का निर्धारण किया जा सकता है।
प्रश्न 5.
एक ठोस AB की संरचना NaCL जैसी है। यदि धनायन A की त्रिज्या 100 pm है तो ऋणायन की त्रिज्या ज्ञात कीजिए।
हल – NaCl के लिए त्रिज्या अनुपात \(\frac{r^{+}}{r^{-}}\) का मान 0.414 से 0.732 के बीच होना चाहिए। धनायन की त्रिज्या 100 pm है।
अतः ऋणायन की त्रिज्या r =\(\frac{r^{+}}{0 \cdot 414}\) से \(\frac{r^{+}}{0 \cdot 732}\) होगी।
= \(\frac{100}{0 \cdot 414}\) से \(\frac{100}{0.732}\)
= 241.6 से 236.6 pm के बीच होगी।
प्रश्न 6.
Na तथा CI की आयनिक त्रिज्या क्रमश: 95 pm तथा 181 pm है। Na की संयोजन संख्या क्या होगी?
अथवा
A तथा B का अर्द्धव्यास क्रमशः 0.95Ā एवं 1.81 Ā है। A+ की संयोजन संख्या ज्ञात कीजिए।
हल – Na+ की त्रिज्या = 95 pm
Cl– की त्रिज्या = 181 pm
त्रिज्या अनुपात =\(\frac{r^{+}}{r^{-}}=\frac{95}{181}\) = 0.524
त्रिज्या अनुपात 0.414 और 0.732 के मध्य है। अत: Na+ अथवा A+ की संयोजन संख्या 6 होगी।
प्रश्न 7.
एक तत्व के फलक केन्द्रित घनीय क्रिस्टल की इकाई लम्बाई 400 pm है। तत्व के घनत्व की गणना कीजिए। तत्व का परमाणु द्रव्यमान 60 है।
हल – d =\(\frac{\mathrm{Z} \times \mathrm{M}}{\mathrm{N}_{0} \times a^{3}}\)
“ Noxa? यहाँ
d = तत्व का घनत्व = ?
Z= कणों की संख्या = 4
M = परमाणु द्रव्यमान = 60
No = ऐवोगेड्रो संख्या = 6-023 x 1023
a = इकाई कोशिका के किनारे की लम्बाई = 400 pm
d=\(\frac{4 \times 60}{\left(400 \times 10^{-10} \mathrm{cm}\right)^{3} \times 6 \cdot 023 \times 10^{23}}\)
= 6.2 gmcm-3
प्रश्न 8.
एक फलक केन्द्रित घन (fcc) वाले तत्व का परमाणु द्रव्यमान 60g mor-‘ है तथा उसके फलक की लम्बाई (Face edge) 400 pm है। उस तत्व का घनत्व ज्ञात कीजिए।
हल – सेल के फलक की लम्बाई = 400 pm = 400 × 10-12m ( ∴1pm = 10-12m)
∴ यूनिट सेल का आयतन (a)3 = (फलक की लम्बाई)3 .
= (400 × 10-12m)3= 64 × 10-30m3
= 64 × 10-30 (102 cm)3 = 64 × 10-24 cm3
fcc सेल में परमाणुओं की संख्या (Z) =4
सूत्र-यूनिट सेल का घनत्व = \(\frac{\mathrm{Z} \times \mathrm{M}}{a^{3} \times \mathrm{N}_{\mathrm{A}}}\)

प्रश्न 9.
यौगिक CuCI की Zns के समान घनीय संरचना होती है। यदि CuCI का घनत्व 3-4g cm हो, तो उसके यूनिट सेल के फलक की लम्बाई ज्ञात कीजिए।
हल- ZnS की fcc संरचना होती है, अत: यही संरचना CuCl की होगी। यदि यूनिट सेल के फलक की लम्बाई a, fcc में परमाणुओं की संख्या Z, आण्विक द्रव्यमान M तथा ऐवोगेड्रो संख्या NA हो, तो

a=\(\left[\frac{4 \times 99 \mathrm{g}}{6 \cdot 02 \times 10^{23} \times 3 \cdot 4}\right]^{1 / 3}\)
athah
= (193 . 47x 10-24 cm3)1/3
= 5.78 x 10-8cm = 578pm.