MP Board Class 11th Chemistry Solutions Chapter 7 साम्यावस्था
साम्यावस्था (Equilibrium) NCERT अभ्यास प्रश्न
प्रश्न 1.
स्थिर ताप पर बंद पात्र में एक दव अपनी वाष्प के साथ साम्यावस्था में है तथा अचानक पात्र का आयतन बढ़ जाता है
(a) वाष्पदाब परिवर्तन में क्या प्रभाव पड़ा?
(b) प्रारंभिक वाष्पन तथा संघनन दर में क्या परिवर्तन हुआ ?
(c) क्या होता है जब अंत में पुनः साम्यावस्था आती है तथा अंतिम वाष्पदाब क्या होगा?
उत्तर:
(a) प्रारंभ में वाष्पदाब घटता है, क्योंकि समान मात्रा की वाष्प बड़े स्थान पर बँट जाती है।
(b) प्रारंभ में वाष्पन की दर बढ़ती है क्योंकि ज्यादा स्थान उपलब्ध होता है परन्तु इकाई आयतन में उपस्थित वाष्प घटती है आयतन बढ़ने पर, इसलिये संघनन की दर प्रारंभ में घटती है।
(c) अंत में साम्यावस्था फिर से स्थापित हो जाती है, जब अग्र क्रिया तथा प्रतीप क्रिया की दर बराबर हो जाती है। अतः वाष्पदाब नहीं बदलता क्योंकि ये ताप पर निर्भर करता है, पात्र के आयतन पर निर्भर नहीं।
प्रश्न 2.
निम्न रासायनिक साम्य के लिये K. का मान ज्ञात कीजिए जबकि साम्यावस्था में सान्द्रण है – [SO2] = 0.60M, [O2] = 0.82 M एवं [SO3] = 1.90 M.
2SO2(g + O2(g)) ⇄ 2SO3(g)
हल:
अभिक्रिया 2SO2(g) + O2(g) ⇄ 2SO3(g) के लिये,

प्रश्न 3.
108 Pa दाब तथा निश्चित ताप पर I2 वाष्य में 40% आयतन के माप पर I परमाणु है –
I2(g) ⇄ I2(g)
साम्य पर Kp की गणना कीजिए।
हल:
I2 व I के मोल का अनुपात है 60 : 40 या 3 : 2
अतः इस अनुपात पर I2 का अंश प्रभाज = \(\frac { 3 }{ 5 }\)
I का अंश प्रभाज == \(\frac { 2 }{ 5 }\)

प्रश्न 4.
निम्न अभिक्रियाओं के लिये साम्य स्थिरांक K. के लिये व्यंजक लिखिए –
1. 2NOCl(g) ⇄ 2NO(g) + Cl2(g)
2. 2Cu(NO3)2(s) ⇄ 2CuO(s) + 4NO2(g) + O2(g)
3. CH3COOC2H5(aq) + H2O(l) ⇄ CH3 – COOH(aq) + C2H5OH(aq)
4. Fe(aq)+3 + 3OH(aq)– ⇄ Fe(OH)3(s)
5. I2(s) + 5F2 ⇄ 2IF5
![]()
उत्तर:
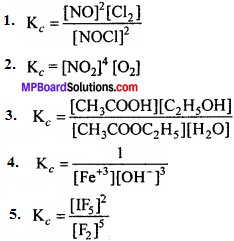
प्रश्न 5.
निम्न रासायनिक साम्यों हेतु K के मान ज्ञात कीजिए जबकि K, के मान दिये हुए हैं –
1. 2NOCl(g) ⇄ 2NO(g) + Cl2(g), [Kp = 1.8 x 10-2 (at 500 K)]
2. CaCO3(s) ⇄ CaO(s) + CO2(g), [Kp = 167 (at 1073 K)]
हल:
1. ∆ng = 3 – 2 = 1,
Kp = \(\mathrm{K}_{p}=\mathrm{K}_{c}(\mathrm{RT})^{\Delta n_{g}}\),
1.8 x 10-2 = Kc × 500 × 0.082
Kc = 4.38 × 10-4mol L-1.
2. ∆n = 1, क्योंकि, ठोस पर विचार नहीं किया गया।
Kp =Kc (RT)∆n
167 = Kc × 0.0821 × 1073 या Kc = 1.9 मोल / लीटर।
प्रश्न 6.
निम्न साम्य के लिये K. = 6.3 x 10-3 (at 1000 K) NO(g)+ O(g) ⇄ NO2 + O2(g))
अग्र – प्रतीप क्रिया (साम्यावस्था) में तत्वीय द्वि-आण्विक अभिक्रिया है, तो प्रतीप क्रिया (विपरीत क्रिया) के लिये K. क्या होगा?
हल:
उत्क्रमणीय (उल्टी) क्रिया के लिये,
\(\frac { 1 }{ { K }_{ c } } \) = \(\frac { 1 }{ 6.3\times { 10 }^{ -3 } } \) = 0.159 ×103 = 159
प्रश्न 7.
शुद्ध द्रव व ठोस साम्य स्थिरांक, व्यंजक लिखते समय क्यों नहीं लिखते हैं ?
उत्तर:
[शुद्ध द्रव] या [शुद्ध ठोस]

स्थिर ताप पर शुद्ध द्रव या ठोस का घनत्व व अणुभार स्थिर होता है, इसलिये उनकी मोलर सान्द्रता स्थिर होती है, जो साम्य स्थिरांक में शामिल होता है।
प्रश्न 8.
N2 व O(g) के बीच रासायनिक अभिक्रिया निम्नानुसार होती है –
2N2(g) + O2(g) ⇄ 2N2O(g) यदि 0.482 मोल N2 एवं 0.933 मोल O2 को 10 लीटर के अभिक्रिया पात्र में किसी नियत ताप में रखकर N2O बनने दिया जाता है, जिसके लिये Kc= 2.0 × 10-37 है। साम्य पर साम्य मिश्रण का संघटन बताइए।
हल:
2N2(g) + O2(g) ⇄ 2N2O(g)
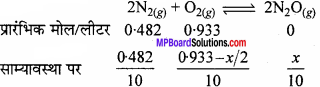
Kc= 2.0 × 10-37 का मान अत्यधिक कम है अर्थात् अभिकारक की कम मात्रा क्रिया करती है। अतः x अत्यधिक कम होता है और उसे उपेक्षित कर देते हैं।
[N2] = 0.0482 मोल लीटर’-1, [O2] = 0.0933 मोल लीटर-1, [N2O] = 0.1x
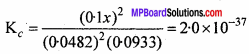
हल करने पर, यह देता है, x = 6.6 × 10-20.
[N2O] = 0.1 × 6.6 × 10-20 = 6.6 × 10-21 मोल लीटर-1
प्रश्न 9.
नाइट्रिक ऑक्साइड, Br, से अभिक्रिया कर नाइट्रोसिल ब्रोमाइड बनाता है, जिसकी रासायनिक अभिक्रिया निम्न है –
2NO(g)+ Br(g) ⇄ 2NOBr(g)
जब 0.087 मोल NO एवं 0.0437 मोल Br2 को स्थिर ताप पर एक बन्द पात्र में मिलाया जाता है तो 0.0518 मोल NOBr साम्यावस्था में प्राप्त होता है। साम्य पर NO एवं Br2 की मात्राएँ ज्ञात कीजिए।
हल:
0.0581 मोल NOBr का 0.0518 मोल NO और 0.518/2 = 0.0259 Br2 का मोल
साम्यावस्था पर NO की मात्रा = 0.087 – 0.0518 = 0.0352 मोल
Br2की मात्रा =0.0437 – 0:0259 = 0.0178 मोल।
![]()
प्रश्न 10.
450 K पर K, = 2.0 × 1010/bar की साम्यावस्था अभिक्रिया के लिये 2SO2(g) + O2(g) ⇄ 2SO3(g) इस ताप पर K. का क्या मान होगा?
हल:
दी गई अभिक्रिया में ∆n = 2 – 2 – 1 = -1,
Kp = Kc (RT)-1

प्रश्न 11.
एक HI(g) का सैम्पल 0.2 वायुमण्डल दाब पर फ्लास्क में रखा गया। साम्यावस्था पर HI(g) का आंशिक दाब 0.04 वायुमण्डल पाया गया। दिये गये साम्य के लिये Kp का मान ज्ञात कीजिए।
2HI(g) ⇄ H2(g) + I2(g)
हल:
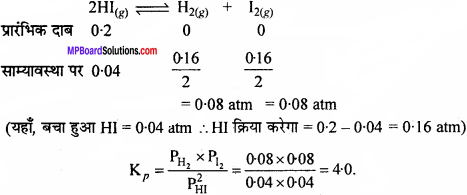
प्रश्न 12.
1.57 मोल N2 1.92 मोल H2 तथा 8.13 मोल NH3 को 20 लीटर के पात्र में 500 K पर रखा है। इस ताप पर अभिक्रिया N2(g)+ 3H2(g) → 2NH3(g) के लिये Kc = 1.7 × 102है। तो क्या अभिक्रिया मिश्रण साम्यावस्था पर है ? यदि नहीं तो नेट क्रिया की दिशा बताइए।
हल:
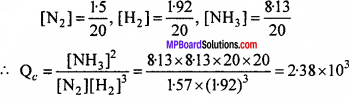
Qc < Kc इसलिये अभिक्रिया प्रतीप दिशा में चलेगी।
प्रश्न 13.
गैस अभिक्रिया के लिये साम्य स्थिरांक व्यंजक है –
![]()
इस व्यंजक के लिये संबंधित संतुलित रासायनिक समीकरण लिखिए।
उत्तर:
साम्य स्थिरांक के व्यंजक के अनुसार अभिक्रिया होगी –
4NO(g) + 6H2O(g) ⇄ 4NH3(g) + 502(g).
प्रश्न 14.
एक मोल H2O व एक मोल CO को 10 लीटर के पात्र में लेकर 725 K तक गर्म किया गया। साम्यावस्था पर भारानुसार 40% जल CO से निम्नानुसार अभिक्रिया करता है –
H2 O(g) + Co(g) ⇄ H2(g) + CO2(g) अभिक्रिया के लिये साम्य स्थिरांक की गणना कीजिए।
हल:
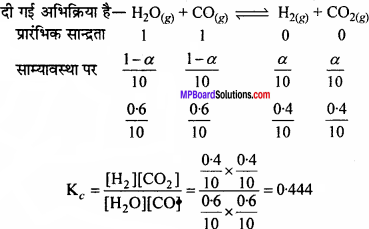
![]()
प्रश्न 15.
700 Kताप पर अभिक्रिया H2(g) + I2(g) ⇄ 2HI2(g) के लिये साम्य स्थिरांक 54.8 है। यदि साम्यावस्था पर 0.5 mol L-1 HI(g) इसी ताप पर उपस्थित हो तो H2(g) व I2(g) के सान्द्रण क्या होंगे ? अभिक्रिया को प्रारम्भिक रूप में HI(g) लेकर प्रारम्भ की गयी तथा 700 K तक साम्य स्थापित हुआ है।
हल:

प्रश्न 16.
साम्यावस्था पर प्रत्येक पदार्थ का सान्द्रण क्या होगा, जबकि ICI का प्रारम्भिक सान्द्रण 0.78 M था –
2ICI(g) ⇄ I2(g) + Cl2(g), Kc = 0.14
हल:

[I2] [Cl2] = 0.167 M तथा [ICI] = 0.78 – 2 × 0.167 = 0.446 M.
प्रश्न 17.
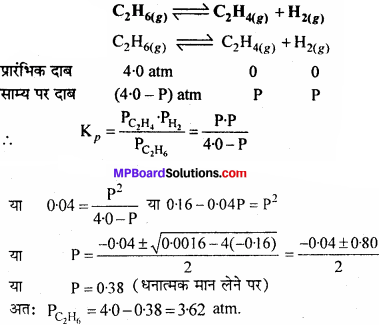
नीचे दी गयी साम्य के लिये 899 K पर Kp, = 0.04 atm है। C2H6 का साम्य सान्द्रण क्या होगा, जबकि इसे 4.0 atm दाब पर फ्लास्क में साम्य स्थापित होने तक रखा गया है –
C2H6(g) ⇄ CH2 + H4(g) + H2(g)
हल:
यहाँ, Kp= 0.04 atm, C2H6 का प्रारंभिक दाब = 4 atm, साम्यावस्था पर C2H6 का दाब = ?

उपर्युक्त समीकरण में मान रखकर हम C2H6 का साम्यावस्था दाब की गणना करते हैं –

प्रश्न 18.
एथेनॉल एवं ऐसीटिक अम्ल की अभिक्रिया से एथिल ऐसीटेट बनाया जाता है एवं साम्य को इस प्रकार दर्शाया जा सकता है –
CH3COOH(l) + C2H5OH(l) ⇄ CH2COOC5H5(l) + H2O(l)
इस अभिक्रिया के लिए सांद्रता अनुपात (अभिक्रिया – भागफल) Q.लिखिए (टीप-यहाँ पर जल आधिक्य में नहीं है एवं विलायक भी नहीं है –
यदि 293 K पर 1.00 मोल ऐसीटिक अम्ल एवं 0.18 मोल एथेनॉल प्रारंभ में लिये जाएँ तो अंतिम साम्य मिश्रण में 0.171 मोल एथिल ऐसीटेट है। साम्य स्थिरांक की गणना कीजिए। 0.5 मोल एथेनॉल एवं 1.0 मोल ऐसीटिक अम्ल से प्रारंभ करते हुए 293 K ताप पर कुछ समय पश्चात् एथिल ऐसीटेट के 0.214 मोल प्राप्त किया जाए तो क्या साम्य स्थापित हो गया ?
हल:

क्योंकि, Qc का मान Kc से कम है, अतः साम्यावस्था नहीं आई है तथा अभिक्रिया अग्र दिशा में चलेगी।
प्रश्न 19.
PCI5 के एक शुद्ध सैम्पल को एक खाली पात्र में 473 K पर रखा गया। साम्यावस्था स्थापित हो जाने पर PCl,5 का सान्द्रण 0.5 x 10.1 मोल/लीटर पाया गया। यदि साम्य स्थिरांक Kc= 8.3 × 10-3 हो, तो साम्य पर PCl3 एवं CI2 के सागण बताइए।
PCl5(g) ⇄ PCl3(g) + Cl2(g).
हल:

![]()
प्रश्न 20.
लौह अयस्क से स्टील बनाने की प्रक्रिया में आयरन (II) ऑक्साइड का अपचयन CO द्वारा होता है, जिसमें आयरन धातु व CO2 बनते हैं –
FeO(s) + CO(g) ⇄ Fe(s) + CO2(g), Kp = 0.265 atm (at 1050 K)
यदि प्रारम्भिक आंशिक दाब Pco = 1.4 atm एवं \({ P }_{ { CO }_{ 2 } }\) = 0.80 atm हो, तो CO व CO2 के साम्य आंशिक दाब क्या होंगे?
हल:
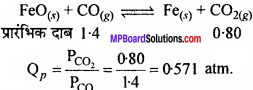
क्योंकि, Qp>Kp इसलिये क्रिया प्रतीप दिशा में चलेगी।
प्रश्न 21.
अभिक्रिया N2(g) + 3H2(g)) ⇄ 2NH3(g) के लिये Kc 500 K पर 0.061 है। संघटन मिश्रण में 3.0 mol L-1 N2, 2.0 मोल L-1H2 तथा 0.5 mol L-1 NH3 हो, तो क्या अभिक्रिया साम्य में है, यदि नहीं तो साम्यावस्था के लिये अभिक्रिया किस दिशा में जायेगी?
हल:
N2(g) + 3H2(g)) ⇄ 2NH3(g)
किसी समय पर सान्द्रण, [N2] = 3.0 mol L-1,[H2] = 2.0 mol L-1,[NH3] = 0.5
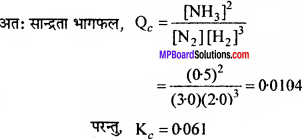
अतः उस समय पर अभिक्रिया साम्य स्थिति में नहीं है क्योंकि Qc का मान Kc के बराबर नहीं है। (Kc>Qc)
चूँकि Qc का मान साम्य स्थिरांक, K. से कम है अतः साम्यावस्था प्राप्त करने हेतु अभिक्रिया अग्र दिशा में अग्रसर होगी।
प्रश्न 22.
BrCI वियोजन द्वारा Br2 तथा CI2 देकर साम्यावस्था पर पहुँचती है। 2BrCl(g) ⇄ Br2(g) + CL2(g) के लिये, Kc = 32, 500K ताप पर है। प्रारंभ में शुद्ध BrCI की सान्द्रता 3.3 × 10-3 मोल L-1है, तो साम्यावस्था पर मिश्रण में इसकी मोलर सान्दता क्या होगी?
हल:

प्रश्न 23.
1127 K एवं 1 वायुमण्डलीय दाब पर CO एवं CO2 का गैसीय मिश्रण इस प्रकार साम्य में है कि कार्बन भारानुसार 90-55% CO में है –
C(s) + CO2(g) ⇄ 2CO(g)
इस ताप पर अभिक्रिया के लिये K. की गणना कीजिए।
हल:
माना, गैसीय मिश्रण का कुल भार 100g है।
अत: CO का भार = 90.55 g
तथा CO2 का भार = 100 – 90.55 = 9.45g

प्रश्न 24.
NO और O2 से NO2 बनने में साम्य स्थिरांक व ∆G° की गणना 298K पर कीजिए –
NO(g) + \(\frac { 1 }{ 2 }\) O2(g) ⇄ NO(g)
जबकि \({ \triangle G° }_{ { NO }_{ 2 } }\) = 52.0 kJ/mol, ∆fG°NO(NO)= 87.0 kJ/mol एवं ∆fG° (O2) = 0 k.J / mol.
हल:

![]()
प्रश्न 25.
निम्न रासायनिक साम्यों में अभिक्रिया के क्रियाफलों के मोलों की संख्या बढ़ेगी, घटेगी या समान रहेगी, जब आयतन बढ़ाते हुए दाब कम कर दिया जाये –
(a) PCl5(g) ⇄ PCl3(g) + Cl2(g)
(b) CaO(s) + CO2(g) ⇄ CaCO3(g)
(c) 3Fe(s) + 4H2O(g) ⇄ Fe3O4(s) + 4H2(g)
उत्तर:
(a) अभिक्रिया अग्र दिशा में चलती है – उत्पाद के मोलों की संख्या बढ़ती है।
(b) अभिक्रिया प्रतीप दिशा में चलती है- अभिकारक के मोलों की संख्या बढ़ती है।
(c) कोई प्रभाव नहीं, गैसों के मोलों की संख्या दोनों तरफ समान है।
प्रश्न 26.
निम्न में कौन-सी क्रिया दाब बढ़ाने पर प्रभावित होती है तथा बताइए कि क्या परिवर्तन से क्रिया अग्र या प्रतीप दिशा में जायेगी
- COCl2(g) ⇄ CO(g)+ Cl2(g)
- CH4(g) + 2S2(g) ⇄ CS2(g) + 2H2S(g)
- CO2(g) + C(s) ⇄ 2CO(g)
- 2H2(g) + CO(g) ⇄ CH3OH(g)
- CaCO3(s) ⇄ CaO(s) + CO2(g)
- 4NH3(g) + 5O2(g) ⇄ 4NO(g) + 6H2O(g).
उत्तर:
- ∆n(g), = 2 – 1 = 1, ∆n(g) > 0 दाब बढ़ाने पर प्रतीप दिशा में
- ∆n(g), = 3 – 3 = 0, दाब का कोई प्रभाव नहीं
- ∆n(g), = 2 – 1 = 1, ∆n(g) > 0 दाब बढ़ाने पर प्रतीप दिशा में
- ∆n(g), = 1 – 3 = -2, ∆n(g) < 0 दाब बढ़ाने पर अग्र दिशा में
- ∆n(g), = 1, ∆n(g) > 0 दाब बढ़ाने पर प्रतीप दिशा में
- ∆n(g), = 10-93 1, ∆n(g) > 0 दाब बढ़ाने पर प्रतीप दिशा में जायेगी।
प्रश्न 27.
निम्न अभिक्रिया के लिये साम्य स्थिरांक 1024 K पर 1.6 × 105 है –
H2(g) + Br2(g) ⇄ 2HBr(g)
यदि HBr को 10.0 बार दाब पर एक सीलबन्द पात्र में लिया गया हो तो सभी गैसों के लिये साम्य दाब की गणना कीजिए।
हल:

प्रश्न 28.
निम्न ऊष्माशोषी क्रिया से प्राकृतिक गैस के आंशिक ऑक्सीकरण से डाइहाइड्रोजन गैस मिलती है –
CH4(g) + H2O(g) ⇄ CO(g) + 3H2(g)
- उपर्युक्त क्रिया का Kpके लिये व्यंजक लिखिए।
- Kpका मान तथा साम्य मिश्रण का संघनन किस तरह प्रभावित होगा –
- दाब बढ़ने पर
- ताप बढ़ने पर
- उत्प्रेरक के उपयोग द्वारा।
उत्तर:
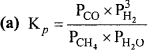
(b) ∆n(g) = 4 – 2 = 2 ∆n(g) > O
- ली-शातेलिए सिद्धांतानुसार अभिक्रिया साम्य प्रतीप दिशा में विस्थापित होती है।
- अभिक्रिया ऊष्माशोषी है, अतः साम्य अग्र दिशा में विस्थापित होती है।
- साम्य संघटन में कोई व्यवधान नहीं होता क्योंकि साम्य बहुत जल्दी स्थापित हो जाता है।
प्रश्न 29.
प्रभाव को समझाइए –
- H2के योग का,
- CH3OH के योग का,
- CO के निष्कासन का,
- CH3OH के निष्कासन का निम्न अभिक्रिया की साम्यावस्था पर –
2H2(g)+ CO(g) ⇄ CH3OH(g).
उत्तर:
- साम्य अग्र दिशा में विस्थापित हो जाती है।
- साम्य प्रतीप दिशा में विस्थापित हो जाती है।
- साम्य प्रतीप दिशा में विस्थापित हो जाती है।
- साम्य अग्र दिशा में विस्थापित हो जाती है।
![]()
प्रश्न 30.
473 K पर PCI5 के विघटन के लिये साम्य स्थिरांक (Kc) 8.3 x 10-3 है।
PCI5(g) ⇄ PCl3(g) + Cl2(g) AH° = 124.0 kJ mol-1
(i) अभिक्रिया में Kc के लिये व्यंजक लिखिए।
(ii) इसी ताप पर विपरीत अभिक्रिया के लिये Kc का मान क्या होगा ?
उत्तर:

प्रश्न 31.
हैबर विधि में प्रयुक्त हाइड्रोजन को प्राकृतिक गैस से प्राप्त मेथेन को उच्च ताप की भाप से क्रिया कर बनाया जाता है। दो पदों वाली अभिक्रिया में प्रथम में Co और अधिक भाप से अभिक्रिया करती है। CO(g) + H2O(g) ⇄ CO2(g) + H2(g)यदि 400°C पर अभिक्रिया पात्र में CO एवं भाप का सममोलर मिश्रण इस प्रकार लिया जाए कि PCO = \({ P }_{ { H }_{ 2 }O }\) = 4.0 bar, H2 का साम्यावस्था पर आंशिक दाब क्या होगा ? (400°C पर Kp= 10.1.)
हल:

प्रश्न 32.
बताइये निम्न में से किस रासायनिक अभिक्रिया में अभिकारकों व क्रियाफलों की सान्द्रता तुलनात्मक रूप से अधिक है –
(a) Cl2(g) ⇄ 2Cl(g); Kc= 5 x 10-39
(b) Cl2(g) + 2NO(g) ⇄ 2NOCl(g); Kc = 3.7 × 108
(c) Cl2(g) + 2NO2(g) ⇄ 2NO2Cl(g); Kc= 1.8.
उत्तर:
Kc = 1.8. यहाँ अभिकारक व उत्पाद की सान्द्रता पर्याप्त है।
प्रश्न 33.
अभिक्रिया 3O2(g) ⇄ 2O3(g) के लिये Kc का मान 2.0 x 10-50 25°C पर है। यदि O2 का 25°C पर साम्य सान्द्रता 1.6 × 10-2 है, तो O3 की सान्द्रता क्या होगी?
हल:
अभिक्रिया 3O2(g) ⇄ 2O2(g) में

प्रश्न 34.
अभिक्रिया CO(g) + 3H2(g) ⇄ CH4(g) + H2O(g), 1 लीटर फ्लास्क में साम्य में है। इस फ्लास्क में 0.30 मोल CO, 0.10 मोल H2, 0.02 मोल H2O तथा CH4 का अज्ञात आयतन भी है तो मिश्रण में CH4 की सान्द्रता ज्ञात कीजिए। दिये गये ताप Kc का मान 3.90 है।
हल:
अभिक्रिया है – CO(g) + 3H22(g) ⇄ CH4(g) + H2O(g) .
आयनिक साम्यावस्था (Ionic Equilibrium) NCERT अभ्यास प्रश्न
प्रश्न 1.
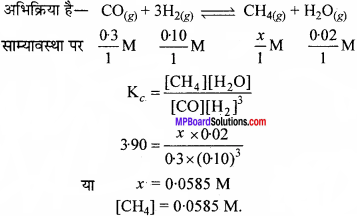
संयुग्मी अम्ल-क्षार युग्म का क्या अर्थ है ? निम्नलिखित स्पीशीज के लिए संयुग्मी अम्ल / क्षार बताइए –
HNO2, CN–, HCIO4, F–, OH–, Co2-3– एवं S2-.
उत्तर:
अम्ल एवं क्षार के वे युग्म जिनमें केवल एक प्रोटॉन H+ का अन्तर होता है, संयुग्मी अम्ल-क्षार युग्म कहलाते हैं।
प्रश्न 2.
निम्नलिखित में से कौन-सा लुईस अम्ल है –
H2O, BF3, H+‘ एवं NH+4.
उत्तर:
BF3, H+ और NH+4 (लुईस अम्ल इलेक्ट्रॉन-न्यून होते हैं)।
प्रश्न 3.
निम्नलिखित ब्रॉन्स्टेड अम्लों के लिए संयुग्मी क्षारकों के सूत्र लिखिए –
HF, H2SO4 एवं HCO3–.
उत्तर:
संयुग्मी अम्ल ⇄ संयुग्मी क्षार + H+
या संयुग्मी क्षार = संयुग्मी अम्ल – H+
अतः दिये गये अम्लों के संयुग्मी क्षार F–, HSO4–, CO32- हैं।
![]()
प्रश्न 4.
ब्रॉन्स्टेड क्षारकों NH3, NH2, तथा HCOO– के संयुग्मी अम्ल लिखिए।
उत्तर:
NH3, NH4+, HCOOH.
प्रश्न 5.
स्पीशीज H2O, HCO3–, HSO4–, तथा NH3, ब्रॉन्स्टेड अम्ल तथा क्षारक दोनों की भाँति व्यवहार करते हैं। प्रत्येक के संयुग्मी अम्ल तथा क्षारक बताइए।
उत्तर:
संयुग्मी अम्ल:
H3O+, H2CO3, H2SO4, NH4+
संयुग्मी क्षारक:
OH–, CO2-4 , SO2-4 , NH–2.
प्रश्न 6.
निम्नलिखित स्पीशीज को लुईस अम्ल तथा क्षारक में वर्गीकृत कीजिए तथा बताइए कि ये किस प्रकार लुईस अम्ल-क्षारक के समान कार्य करते हैं –
- OH–
- F–
- H+
- BCI3
उत्तर:
- OH– एक लुईस क्षार है क्योंकि यह एक इलेक्ट्रॉन युग्म दाता की तरह व्यवहार करता है।
- F– भी लुईस क्षार है।
- H+ एक लुईस अम्ल है क्योंकि यह इलेक्ट्रॉन युग्म ग्राही की तरह व्यवहार करता है।
- BCI3 एक इलेक्ट्रॉन – न्यून यौगिक है अत: यह एक इलेक्ट्रॉन युग्म ग्राही होगा। अत: यह एक लुईस अम्ल है।
प्रश्न 7.
एक मृदु पेय के नमूने में हाइड्रोजन आयन की सांद्रता 3.8 x 10-3 M है। उसकी pH परिकलित कीजिए।
हल:
pH = – log [H+] = – log [3.8 x 10-3] = 2.42.
प्रश्न 8.
सिरके के एक नमूने की pH, 3.76 है, इसमें हाइड्रोजन आयन की सांद्रता ज्ञात कीजिए।
हल:
[H’] = Anti log [- pH]
= Anti log [- 3.76]
= 1.737 × 10-4M.
![]()
प्रश्न 9.
HF, HCOOH तथा HCN का 298 K पर आयनन स्थिरांक क्रमशः 6.8 × 10-4, 1.8 × 10-4 तथा 4.8 × 10-9 है। इनके संयुग्मी क्षारकों के आयनन स्थिरांक ज्ञात कीजिए। हल-यदि अम्ल एवं उनके संयुग्मी क्षारों के आयनन स्थिरांक Ka, एवं Kb, हो, तो
Ka × Kb= Kw
HCN – Ka = 4.8 × 10-9
4.8 × 10-9 × Kb = 10-14
.:. Kb = 2.083 × 10-6.
HCOOH – Ka = 1.8 x 10-4
1.8 x 10-4 × Kb = 10-10
∴ Kb = 5.55 × 10-11
HF – Ka = 6.8 × 10-4
6.8 × 10-4 × Kb = 10-14
∴ Kb= 1.47 × 10-11 .
प्रश्न 10.
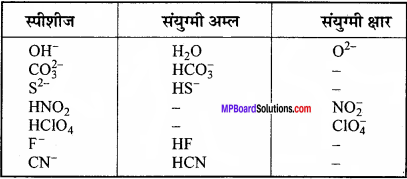
फीनॉल का आयनन स्थिरांक 1.0 × 10-10 है। 0.05 M फीनॉल के विलयन में फीनोलेट आयन की सांद्रता तथा 0.01 M सोडियम फीनोलेट विलयन में उसके आयनन की मात्रा ज्ञात कीजिए।
हल:
फीनॉल का आयनन निम्नानुसार होगा –
0.01 M सोडियम फीनोलेट की उपस्थिति में आयनन की कोटि की गणना इस प्रकार की जा सकती है
C6H5O– Na+ → C6H5O– + Na+
[C6H5O–] = 0.01 = Cα
सोडियम फीनोलेट प्रबल विद्युत् अपघट्य है। इसलिए इसके फीनोलेट आयन, फीनॉल के फीनोलेट आयन सान्द्रण को कम करता है।
Kα = Cα2
= Cα × α
10-10 = 0.01 × α
α= 10-8.
प्रश्न 11.
H2S का प्रथम आयनन स्थिरांक 9.1 × 10-8 है। इसके 0.1 M विलयन में HS– आयनों की सांद्रता की गणना कीजिए तथा बताइए कि यदि इसमें 0.1 M HCI भी उपस्थित हो, तो सांदता किस प्रकार प्रभावित होगी ? यदि H2S का द्वितीय वियोजन स्थिरांक 1.2 × 10-13 हो, तो सल्फाइड S2-आयनों की दोनों स्थितियों में सांद्रता की गणना कीजिए।
हल:
H2S का आयनन निम्न प्रकार होगा –

0.1 M HCl की उपस्थिति में [H+] का सान्द्रण 0.1 M है, क्योंकि HCl, H2S से प्रबल अम्ल है।

H2S का कुल वियोजन स्थिरांक है –
\({ K }_{ a }={ K }_{ { a }_{ 1 } }\times { K }_{ { a }_{ 2 } }\)
= 9.1 × 10-8 × 1.2 × 10-13
= 1.092 × 10-20

0.1M HCl की उपस्थिति में
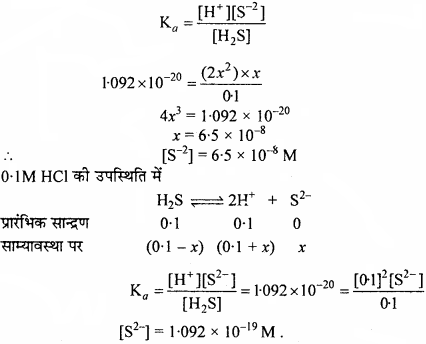
![]()
प्रश्न 12.
एसीटिक अम्ल का आयनन स्थिरांक 1.74 × 10-5 है। इसके 0.05 M विलयन में वियोजन की मात्रा, ऐसीटेट आयन सांद्रता तथा pH का परिकलन कीजिए।
हल:
CH3COOH ⇄ CH3COO– + H+
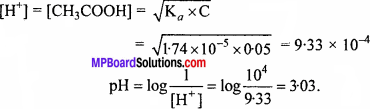
प्रश्न 13.
0.01 M कार्बनिक अम्ल (HA) के विलयन की pH, 4.15 है। इसके ऋणायन की सांदता, अम्ल का आयनन स्थिरांक तथा pKa मान परिकलित कीजिए।
हल:

[H+ ] [A– ] = 7.08 × 10-5 M
pKa = – log Ka = – log 5 × 10-7 = 6.3.
प्रश्न 14.
पूर्ण वियोजन मानते हुए निम्नलिखित विलयनों के pH ज्ञात कीजिए –
1. 0.003 M HCl
2. 0.005 M NaOH
3. 0.002 M HBr
4. 0.002 M KOH.
हल:
1. [H+] = [HCl] = 0.003 M
pH = -log[H+] = – log( 3 × 10-3)= 2.52.
2. [OH–] = [NaOH] = 0.005 M
pOH = -log 5 × 10-3 = 2.301
pH = 14 – 2.301 = 11.699.
3. [H+] = [HBr] = 0.002 M
pH = -logH+ = -log(2 × 10H-3)= 2.6989.
4. [OH–] = [KOH] = 0.002 M
POH = -log[OH– ] = -log(2 × 10-3)= 2.6989
pH = 14 – 2.6989 = 11.3011.
प्रश्न 15.
निम्नलिखित के pH की गणना कीजिये –
(a) 2 ग्राम TiOH जल में घोलकर 2 लीटर विलयन बनाया जाए।
(b) 0.3 ग्राम Ca(OH)2 को जल में घोलकर 500 ml विलयन बनाया जाए।
(c) 0.3 ग्राम NaOH को जल में घोलकर 200 ml विलयन बनाया जाए।
(d) 13.6 M HCI के 1ml का जल से तनुकरण करके कुल आयतन 1 लीटर विलयन बनाया जाए।
हल:
(a) मोलरता
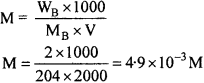
Ti(OH)(aq) → Ti+ + OH–(aq)
[OH– ] = 4.9 × 10-3M, POH = -log(OH–)
= – log(4.9 × 10-3 M) = 2.309
pH = 14 -2.309 = 11.691.
![]()
Ca(OH)2 → Ca2+ + 2OH–(aq)
[OH–] = 2 x 8.1 × 1-3 = 0.0162 M
POH = – log[OH– ] = -log(1.62 × 10-2‘) = 1.79
pH = 14 – 1.79 = 12.21.
![]()
NaOH → Na+(aq) + OH–(aq)
[OH–] = 0.0375 M, POH = -log[OH–]
= – log [3.75 × 10-2] = 1.426
pH = 14 – 1.426 = 12.574.
(d) M1V1 (तनुकरण से पहले) = M2V2 (तनुकरण के बाद)
13.6 x 1 = M2 × 1000
M2 = 0.0136 M, HCl(aq) → H+(aq) + Cl–(aq)
[H+] = 0.0136 M, pH = -log(1.36 × 10-2) = 1.866.
![]()
प्रश्न 16.
ब्रोमोएसीटिक अम्ल के आयनन की मात्रा 0.132 है। 0.1 M अम्ल की pH तथा pKa का मान ज्ञात कीजिए।
हल:
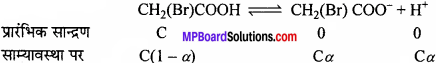
[H+] = Ca = 0.1 ×- 0.132 = 1.32 × 10-2
pH = -log(1.32 × 10-2) = 1.88
[H+] =\(\sqrt { { K }_{ a }×C } \) या 1.32 × 10-2 = \(\sqrt { { K }_{ a }×0.1 } \)
Ka = 1.74 × 10-3
pKa = -log Ka = -log(1.74 × 10-3) = 2.76.
प्रश्न 17.
0.005 M कोडीन (CH18H21NO3) विलयन की pH 9.95 है। इसका आयनन स्थिरांक एवं pKb ज्ञात कीजिए।
हल:
कोडीन + H2O ⇄ कोडीन H+ + OH–
pH = 9.95
pOH = 14 – 9.95 = 4.05
या – log [OH– ] = 4.05 या log [OH–] = – 4.05
[OH–] = Anti log [- 4.05] = 8.913 × 10-5M
![]()
= 1:59 × 10-6
pKb= – log (1.59 × 10-6) = 6 – 0.1987 = 5.8.
प्रश्न 18.
0.001 M एनिलीन विलयन का pH क्या है? एनिलीन का आयनन स्थिरांक 4.27 = 10-10 है। इसके संयुग्मी अम्ल का आयनन स्थिरांक ज्ञात कीजिए।
हल:
एनिलीन एक दुर्बल क्षार है जो निम्नानुसार आयनन होगा –
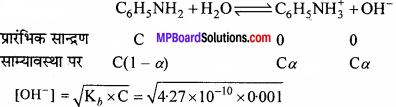
= 6.53 × 10-7
pOH = – log [OH– ] = – log (6.53 × 10-7) = 6.19
∴ pH = 14 – 6.19 = 7.81
[OH– ] = Cα या 6.53 × 10-7 = 0.001 × α
या α = 6.53 × 10-4
संयुग्मित अम्ल के लिए,
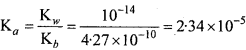
प्रश्न 19.
यदि 0.05 M ऐसीटिक अम्ल के pK, का मान 4.74 है, तो आयनन की मात्रा ज्ञात कीजिए। यदि इसे (a) 0.01 M, (b) 0-1 M HCI विलयन में डाला जाए, तो वियोजन की मात्रा किस प्रकार प्रभावित होती है ?
हल:
pKα = – log Kα = 4.74
Kα = Antilog (-4.74)
= 1.82 × 10-5
α की गणना निम्नानुसार की जा सकती है –
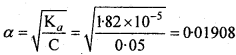
(a) 0.01 M HCl की उपस्थिति में,
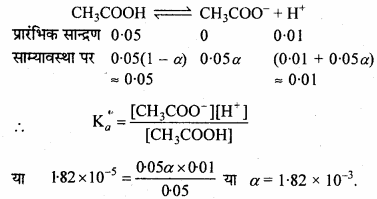
(b) 0.1 M HCl की उपस्थिति में
HCl → H+ + Cl–
[H+] = 0.1 M
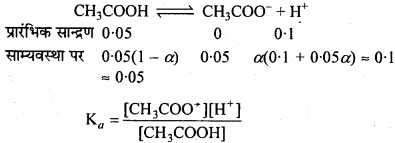
या 1.82 – 10-5 = latex]\frac { 0.05α × 0.1 }{ 0.01 }[/latex]
α = 1.82 × 10-4
![]()
प्रश्न 20.
डाइमेथिल एमीन का आयनन स्थिरांक 5.4 × 10-4 है। इसके 0.02 M विलयन की आयनन की मात्रा की गणना कीजिए। यदि यह विलयन NaOH प्रति 0.1 M हो, तो डाइमेथिल एमीन का प्रतिशत आयनन क्या होगा?
हल:
![]()
प्रबल क्षार NaOH की उपस्थिति में डाइमेथिल ऐमीन का आयनन समायन प्रभाव के कारण घट जाता है। यदि डाइमेथिल एमीन का वियोजन x हो, तो
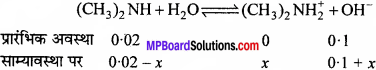

या 0.54% = वियोजित।
प्रश्न 21.
निम्नलिखित जैविक द्रवों, जिनमें pH दी गई है, की हाइड्रोजन आयन सांद्रता परिकलित कीजिए –
- मानव पेशीय द्रव, 6.83
- मानव उदर द्रव, 1.2
- मानव रुधिर, 7.38
- मानव लार, 6.4.
हल:
- [H+] = Anti log [-PH] = Anti log (-6.83) = -479 × 10-7M
- [H+] = Anti log (-1.2] = 0.063 M
- [H+] = Anti log (-1.38] = 4.168 × 10-8M
- [H+] = Anti log [- 6.4] = 3.98 × 10-7 M.
प्रश्न 22.
दूध, काली कॉफी, टमाटर रस, नीबू रस तथा अंडे की सफेदी के pH का मान क्रमशः 6.8, 5.0, 4-2, 2-2 तथा 7.8 हैं। प्रत्येक के संगत H+ आयन की सान्द्रता ज्ञात कीजिए।
हल:
दूध (Milk) [H+] = Antilog [-pH]
= Anti log [6.8]
= 1.58 × 10-7M
काली कॉफी (Black Coffee) [H+] = Antilog [-pH]
= Anti log[-5] = 10-5M
टमाटर का रस (Tomato Juice) [H+] = Antilog [-pH]
= Anti log [-4.2] = 6.3 × 10-5M
नीबू का रस (Lemon Juice) [H+] = Anti log [-pH] –
= Anti log [-2.2] = 6.309 × 10-3M
अण्डे की सफेदी (White Egg) [H+] = Anti log [-pH]
= Anti log [-7.8] = 1.584 × 10-8M.
प्रश्न 23.
298 K पर 0.561g, KOH जल में घोलने पर प्राप्त 200 mL विलयन की है, पोटैशियम, हाइड्रोजन तथा हाइड्रॉक्सिल आयनों की सांद्रताएँ ज्ञात कीजिए।
हल:

प्रश्न 24.
298K पर Sr(OH)2 विलयन की विलेयता 19.23 gm/L है।स्ट्राँशियम तथा हाइड्रॉक्सिल आयन की सांद्रता तथा विलयन की pH ज्ञात कीजिए।
हल:
Sr(OH)2 का अणुभार = 87.6 + 34 = 121.6 g mol-1
![]()
Sr(OH)2 → Sr+2 + 2OH–
[Sr+2 ] = 0.1581, [OH– ] = 2 × 0.1581 = 0.3162
pOH = – log [0.3162] = 0.5
pH = 14 – pOH = 14 – 0.5 = 13.5
![]()
प्रश्न 25.
प्रोपेनोइक अम्ल का आयनन स्थिरांक 1:32 × 10-5 है। 0.05 M अम्ल विलयन के आयनन की मात्रा तथा pH ज्ञात कीजिए। यदि विलयन में 0.01 M HCl मिलाया जाए तो उसके आयनन की मात्रा ज्ञात कीजिए।
हल:
![]()
HCl उपस्थिति में प्रोपेनोइक अम्ल का वियोजन कम होता है। मानलो x मोल वियोजित होता है।
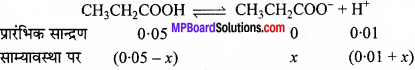
जहाँ x बहुत कम (0.05 – x) है इसलिये इसे 0.05 लेने पर और 0.1 – x = 0.1
Kα \(\frac { x × 0.01 }{0.05 }\) =132 × 10-5
या x = 6.60 × 10-5
![]()
या 0.132% वियोजित हुआ।
प्रश्न 26.
यदि साइनिक अम्ल (HCNO) के 0.1M विलयन की pH 2.34 हो, तो अम्ल के आयनन स्थिरांक तथा आयनन की मात्रा ज्ञात कीजिए।
हल:
HCNO एक दुर्बल अम्ल है। अत: निम्नानुसार आयनित होगा –
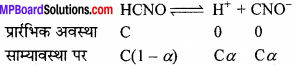
Cα = Anti log [- pH].
या 0.1 × α = Anti log [-2.34]
α = 0.0457
![]()
प्रश्न 27.
यदि नाइट्रस अम्ल का आयनन स्थिरांक 4.5 × 10-4है, तो 0.04 M सोडियम नाइट्राइट विलयन की pH तथा जलयोजन की मात्रा ज्ञात कीजिए।
हल:
यह दुर्बल अम्ल एवं प्रबल क्षार का लवण है –
![]()
= 1.06 × 10-8
अब pH = – log [H+ ] = – log (1.06 × 10-8 ) = 7.97

प्रश्न 28.
यदि पिरिडीनियम हाइड्रोजन क्लोराइड के 0.02 M विलयन का pH 3.44 है, तो पिरिडीन का आयनन स्थिरांक ज्ञात कीजिए।
हल:
पिरिडीनियम हाइड्रोक्लोराइड एक प्रबल अम्ल एवं दुर्बल क्षार से बना लवण है।
pH = 3.44
[H+ ] = Anti log [-pH]
[H+ ] = Anti log [-3.44] = 3.63 × 10-4M
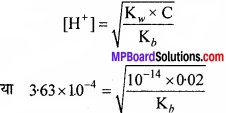
प्रश्न 29.
निम्नलिखित लवणों के जलीय विलयनों के उदासीन, अम्लीय तथा क्षारीय होने की प्रागुक्ति कीजिए –
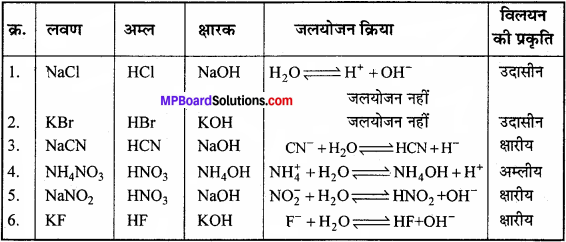
NaCl, KBr, NaCN, NH4NO3, NaNO2, तथा KE.
उत्तर:
NaCN, NaNO2 एवं KF के विलयन क्षारीय होंगे, क्योंकि ये दुर्बल अम्ल एवं प्रबल क्षार से बने लवण हैं। NaCl एवं KBr के विलयन उदासीन होंगे, क्योंकि ये लवण प्रबल अम्ल एवं प्रबल क्षार से बने हैं। NH4NO3 का विलयन अम्लीय होगा, क्योंकि यह प्रबल अम्ल एवं दुर्बल क्षार से बने लवण का विलयन है।
![]()
प्रश्न 30.
क्लोरोएसीटिक अम्ल का आयनन स्थिरांक 1.35 × 10-3 है। 0.1 M अम्ल तथा इसके 0.1 M सोडियम लवण की pH ज्ञात कीजिए।
हल:
0.1 M अम्ल का pH:
![]()
pH = – log (1.16 × 10-2) = 1.94
0.1 M सोडियम लवण का pH = ये दुर्बल अम्ल का प्रबल क्षार का लवण है।

= 1.16 × 10-8 या pH = -log[H+] = -log[1.16 × 10-8] = 7.94.
प्रश्न 31.
310 K पर जल का आयनिक गुणनफल 2.7 × 10-14 है। इसी तापक्रम पर उदासीन जल की pH ज्ञात कीजिए।
हल:

प्रश्न 32.
निम्नलिखित मिश्रणों की pH परिकलित कीजिए –
(a) 0.2 M Ca(OH)2 का 10 mL+ 0-1 M HCI का 25 mL
(b) 0.01 M H2SO4. का 10 mL + 0.01 M Ca(OH)2 का 10 mL
(c) 0.1 M H2SO4 का 10 mL + 0.1 M KOH का 10 mL.
हल:
(a) Ca(OH)2 के मोलों की संख्या = \(\frac { MV }{ 1000 }\) = \(\frac { 0.2×10 }{ 1000 }\) =0.002
HCl के मोलों की संख्या = \(\frac { MV }{ 1000 }\) = \(\frac { 0.1 × 25 }{ 1000 }\) =0.0025
OH– के मोलों की संख्या
अर्थात् nOH = 2 × 0.002 = 0.004
तथा \({ n }_{ { H }^{ + } }\) = 0.0025
उदासीनीकरण के बाद बचे OH– आयन = 0.004 – 0.0025 = 0.0015
![]()
=0.0428
pOH = -log[OH–] = -log[4.28 × 10-2] = 1.368
pH = 14 – 1.368 = 12.64.
![]()
OH मोलों की संख्या \({ n }_{ { H }^{ + } }\) = 2 × Ca(OH)2 के मोलों की संख्या
H+, OH– दोनों बराबर हैं। अतः विलयन उदासीन होगा।
(c) H के मोलों की संख्या, \({ n }_{ { H }^{ + } }\) = 2 × H2SO4 के मोलों की संख्या
![]()
OH– के मोलों की संख्या, \({ n }_{ { OH }^{ – } }\) = KOH के मोलों की संख्या
![]()
उदासीनीकरण के बाद बचे H* मोलों की संख्या = 2 × 10-3 – 1 × 10-3 = 1 × 10-3 मोललता या [H+] का सान्द्रण –
pH = -log (5 × 10-2) = 1.301.
प्रश्न 33.
सिल्वर क्रोमेट, बेरियम क्रोमेट, फेरिक हाइड्रॉक्साइड, लेड क्लोराइड तथा मर्पूरस आयोडाइड विलयन की विलेयता गुणनफल स्थिरांक की सहायता से विलेयता ज्ञात कीजिए तथा प्रत्येक आयन की मोलरता भी ज्ञात कीजिए।
हल:
यदि सभी लवणों की विलेयता 5 मोल/लीटर है।
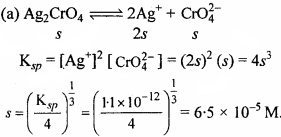
[Ag+] = 2 × 6.5 × 10-5 = 13 × 10-5M
[Cro2-4] = s = 6.5 × 10-5M.
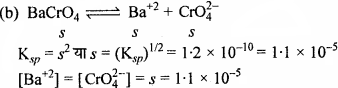
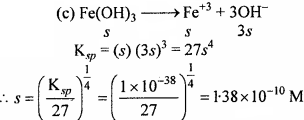
[Fe+3] = s = 1.38 × 10-10 M
[OH–] = 3 × 1. 38 × 10-10= 4.14 × 10-10 M.
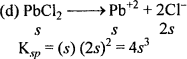
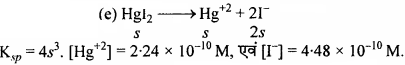
प्रश्न 34.
Ag2Cro4 तथा Ag Br का विलेयता गुणनफल स्थिरांक क्रमशः 1.1 × 10-12 तथा 5.0 × 10-13 है। उनके संतृप्त विलयन की मोलरता का अनुपात ज्ञात कीजिए।
हल:
Ag2CrO4 का Ksp = 4s3 = 1.1 × 10-12 या s = 6.5 × 10-5
AgBr का Ksp = s2 = 5 × 10-13 या s = 7.07 × 10-7
अनुपात = \(\frac { 6.5 × 10-5 }{ 7.07 × 10-7 }\) = 91.9
![]()
प्रश्न 35.
यदि 0.002 M सांद्रता वाले सोडियम आयोडेट तथा क्यप्रिक क्लोरेट विलयन के समान आयतन को मिलाया जाए, तो क्या कॉपर आयोडेट का अवक्षेपण होगा? (कॉपर आयोडेट के लिए K = 7.4 × 1-8).
हल:
2NalO3 + CuCrO4 – Na2CrO4 + Cu(IO3)2
मिश्रित करने के पश्चात् [NalO3] = [IO3– ] = \(\frac { 2\times { 10 }^{ -3 } }{ { 2 } } \) = 10-3M
[CuCrO4] = [Cu+2] = \(\frac { 2\times { 10 }^{ -3 } }{ { 2 } } \) = 10-3 M
Cu(IO3)2 का आयनिक गुणनफल = [Cu+2] [IO–3]2
= (10-3) (10-3)2
= 10-9
चूँकि आयनिक गुणनफल का मान Ksp से कम है। अतः अवक्षेपण प्रारंभ नहीं होगा।
प्रश्न 36.
बेन्जोइक अम्ल का आयनन स्थिरांक 6.46 × 10-5 तथा सिल्वर बेन्जोएट का Ksp2.5 × 10-13 है। 3.19 pH वाले बफर विलयन में सिल्वर बेन्जोएट जल की तुलना में कितना गुना विलेय होगा?
हल:
मानलो, सिल्वर बेन्जोएट की विलेयता s है।
C6H5COOAg ⇄ C6H5COO– + Ag+
[Ag+] = [C6H5COO–] =s, Ksp = s2, s = \(\sqrt { { K }_{ sp } } \) s = \(\sqrt { 12-5\times { 10 }^{ -13 } } \) = 5 × 10-7 मोल L-1
बफर में विलेयता [H+], बफर = Anti log [-3.19]
C6H5COOH ⇄ C6H5COO– + H+ = 6.45 × 10-4M
H+, C6H5COO– मिलकर C6H5COOH बनाते हैं, विलयन बफर है इसलिये H+ स्थिर होगा। दिया है –
Kα = 6.46 × 10-5

[C6H5COOH) = 10 × [C6H5COO”]
मानलो, बफर विलयन में सिल्वर बेन्जोएट की घुलनशीलता = × mol L-1 है।
अधिकतर C6H5COO– , C6H5COOH में बदल जाते हैं।
[Ag+] = × = C6H5COOH + C6H5COO–
= 10C6H5COO– + C6H5COO–
= 11C6H5COO–
[C6H5COO–] = \(\frac { x }{ 11 }\)[Ag+] =x
Ksp = [C6H5COO– ] [Ag+]
या 2.5 × 10-13 = \(\frac { x × x }{ 11 }\) या x = 1.66 × 10-6
![]()
प्रश्न 37.
फेरस सल्फेट तथा सोडियम सल्फाइड के सममोलर विलयनों की अधिकतम सान्द्रता बताइए जब उनके समान आयतन मिलाने पर आयरन सल्फाइड अवक्षेपित न हो (आयरन सल्फाइड के लिए Ksp = 6.3 × 10-18)
हल:
मानलो, प्रत्येक FeSO4 व Na2S की सान्द्रता C मोल L-1 है। दोनों के बराबर आयतन मिलाने पर,
[FeSO4] = [Na2S] = \(\frac {C }{ 2 }\)M
अर्थात् [Fe2+] = [S-2] \(\frac {C }{ 2 }\)
Ksp [FeS के लिये] = [Fe2+] [S-2] = 6.3 × 10-18 = \(\frac {C }{ 2 }\) × \(\frac {C }{ 2 }\)
या C2 = 25.2 × 10-18 या C = 5.02 x 10-9M.
प्रश्न 38.
1 ग्राम कैल्सियम सल्फेट को 298K घोलने के लिए कम-से-कम कितने आयतन जल की आवश्यकता होगी? (कैल्सियम सल्फेट के लिए Ksp = 9.1 × 10-6 ).
हल:
यदि 298 K ताप पर CuSO4 की विलेयता ‘s’ मोल प्रति लीटर हो, तो Ksp = S2
S = \(\sqrt { 9.1\times { 10 }^{ -6 } } \) = 3.016 × 10-3 मोल प्रति लीटर
ग्राम प्रति लीटर में विलेयता = 3:016 x 10-3 × 136 = 0.41 ग्राम प्रति लीटर
1 g को घोलने के लिए आवश्यक जल =\(\frac {1 }{ 0.411 }\) लीटर = 2.43 लीटर।
प्रश्न 39.
0.1 M HCI में हाइड्रोजन सल्फाइड से संतृप्त विलयन की सांद्रता 1.0 × 10-19 M है। यदि इस विलयन का 10 mL निम्नलिखित 0.04 M विलयन के 5 mL डाला जाए, तो किन विलयनों से अवक्षेप प्राप्त होगा – FeSO4 MnCl2, ZnCl2 Ta CaCl4.
हल:
हम जानते हैं जब आयनिक गुणनफल का मान विलेयता गुणनफल से अधिक होता है, तो अवक्षेपण प्रारंभ होता है। मिश्रित करने के पश्चात् -आयनों का सान्द्रण होगा –
M1V1 = M2V2
1 x 10-19 × 10 = M2 x 15.
M2 = 6.67 × 10-20M
मिश्रित होने के पश्चात् धातु आयनों का सान्द्रण होगा –
[Fe+2] = [Mn+2] = [Zn+2] = [Cd+2] = \(\frac {5 × 0.04 }{ 15 }\)
= 1.33 × 10-2 M
इन धातु सल्फाइडों का आयनिक गुणनफल –
= 1:33 × 10-2 × 6.67 × 10-20
= 8.87 × 10-22 M2.
केवल ZnS एवं Cds आयनों का अवक्षेपण होगा क्योंकि इनके आयनिक गुणनफल का मान विलेयता गुणनफल से अधिक है।
![]()
साम्यावस्था अन्य महत्वपूर्ण प्रश्न
साम्यावस्था वस्तुनिष्ठ प्रश्न
प्रश्न 1.
सही विकल्प चुनकर लिखिए –
प्रश्न 1.
इनमें से किस अभिक्रिया के लिए K. और K, बराबर होंगे
(a) N2(g) + 3H2(g) ⇄ 2NH3(g))
(b) 2H2S(g) + 3O2(g) ⇄ 2SO2(g) + 2H2 O2(g)
(c) Br2(g) + Cl2(g) ⇄ 2BrCl(g)
(d) P4(g) + 6Cl2(g) ⇄ 4PCl3(g)
उत्तर:
(c) Br2(g) + Cl2(g) ⇄ 2BrCl(g)
प्रश्न 2.
अभिक्रिया N2(g) + 3H2(g) ⇄ 2NH3 ; AH = – 92kJ में ताप वृद्धि में साम्यावस्था पर NH3 की सान्द्रता –
(a) बढ़ती है।
(b) नहीं बदलती
(c) घटती है
(d) पहले घटती तथा बाद में बढ़ती है।
उत्तर:
(c) घटती है
प्रश्न 3.
अमोनिया संश्लेषण की ऊष्माक्षेपी अभिक्रिया N2(g) + 3H2(g)= 2NH3(g). किस अवस्था में अधिक होगी –
(a) उच्च ताप, उच्च दाब
(b) उच्च ताप, निम्न दाब
(c) निम्न ताप, उच्च दाब
(d) निम्न ताप, निम्न दाब।
उत्तर:
(c) निम्न ताप, उच्च दाब
प्रश्न 4.
SO2 व O2 द्वारा SO2 में ऑक्सीकरण एक ऊष्माक्षेपी अभिक्रिया है।SO का निर्माण अधिकतम होगा यदि –
(a) ताप बढ़ाया जाए, दाब घटाया जाए।
(b) ताप घटाया जाए, दाब बढ़ाया जाए
(c) ताप व दाब दोनों बढ़ाए जाएँ
(d) ताप व दाब दोनों घटाए जाएँ।
उत्तर:
(b) ताप घटाया जाए, दाब बढ़ाया जाए
प्रश्न 5.
साम्य में स्थित किसी उत्क्रमणीय अभिक्रिया का क्या होगा जब दाब स्थिर रहते हुए कोई निष्क्रिय गैस मिला दी जाय –
(a) अधिक उत्पाद बनेगा
(b) कम उत्पाद बनेगा
(c) अधिक अभिकारक बनेगा
(d) अप्रभावित रहेगी।
उत्तर:
(d) अप्रभावित रहेगी।
प्रश्न 6.
N2 + 3H2 = 2NH3+ ऊष्मा, के लिए –
(a) pKp = Kc
(b) Kp = KcRT
(c) Kp = Kc(RT)-2
(d) Kp = Kc(RT)-1
उत्तर:
(a) pKp = Kc
![]() c
c
प्रश्न 7.
साम्य पर उत्क्रमणीय अभिक्रिया पर मुक्त ऊर्जा परिवर्तन होगा –
(a) 0
(b) >0
(c) α
(d) 1.
उत्तर:
(a) 0
प्रश्न 8.
जल – वाष्प भौतिक साम्य के लिए दाब प्रयुक्त करने पर –
(a) क्वथनांक बढ़ेगा
(b) गलनांक घटेगा
(c) क्वथनांक कम होगा
(d) इनमें से कोई नहीं।
उत्तर:
(a) क्वथनांक बढ़ेगा
प्रश्न 9.
निम्न में किसका pH मान उच्चतम है –
(a) CH3COOK
(b) Na2CO3
(c) NH4Cl
(d) NaNO3
उत्तर:
(b) Na2CO3
प्रश्न 10.
10-8M HCl का pH होगा –
(a)8
(b)7
(c) 7 और 8 के बीच
(d) 6 और 7 के बीच।
उत्तर:
(d) 6 और 7 के बीच।
प्रश्न 11.
यदि N2 + 3H2 ⇄ 2NH3 के लिए K है तब 2N2 + 6H2 ⇄ 4NH3 के लिए K’ होगा –
(a) K2
(b) \(\sqrt { K } \)
(c) \(\frac { 1 }{ \sqrt { K } }\)
(d) \(\frac { 1 }{ { k }^{ 2 } }\)
उत्तर:
(a) K2
![]()
प्रश्न 12.
ऐल्युमिनियम क्लोराइड है –
(a) ब्रॉन्स्टेड अम्ल
(b) आर्चीनियस अम्ल
(c) लुईस अम्ल
(d) लुईस क्षार।
उत्तर:
(d) लुईस क्षार।
प्रश्न 2.
रिक्त स्थानों की पूर्ति कीजिए –
- बर्फ ⇄ जल – Q cal. इस अभिक्रिया में उच्च ताप अभिक्रिया को ……………… दिशा में तथा दाब वृद्धि क्रिया को ………….. दिशा में प्रेरित करेगी।
- ओस्टवाल्ड तनुता नियम के अनुसार आयनन की मात्रा और आयनन स्थिरांक के मध्य सम्बन्ध के गणितीय रूप को …………… द्वारा व्यक्त किया जाता है। दुर्बल विद्युत् अपघट्य के वियोजन की मात्रा उसकी ………… के व्युत्क्रमानुपाती होती है।
- एसीटिक अम्ल और सोडियम एसीटेट का मिश्रित विलयन ……………. विलयन का उदाहरण है।
- अमोनियम क्लोराइड और अमोनियम हाइड्रॉक्साइड का मिश्रित विलयन …………… विलयन का उदाहरण है।
- अवक्षेपण हेतु आयनिक गुणनफल विलेयता गुणनफल से ………………….. होना चाहिये।
- ओस्टवाल्ड का तनुता नियम …………………….के लिये लागू नहीं होता है।
- साम्य स्थिरांक पर ताप के प्रभाव ………………. समीकरण द्वारा व्यक्त किया जाता है।
- अभिक्रिया N2 + 3H2 ⇄ 2NH3 के लिए Kc की इकाई …………. है।
- Kp और Kc का मान ……………… के साथ परिवर्तित होते हैं।
- साम्य स्थिरांक का मान अधिक होने पर अभिक्रिया ………………… में अधिक विस्थापित रहती है।
उत्तर:
- अग्र, अग्र
- α =\(\sqrt { \frac { { K }_{ a } }{ c } } \) सान्द्रण के वर्गमूल
- अम्लीय बफर
- क्षारीय बफर
- अधिक
- प्रबल विद्युत् अपघट्य
- वाण्ट हॉफ समीकरण
- (मोल/ लीटर)-2
- ताप
- अग्र दिशा।
![]()
प्रश्न 3.
उचित संबंध जोडिए –

उत्तर:
- (c) क्षारीय होता है जलीय विलयन
- (a) अम्लीय होता है
- (d) दुर्बल अम्ल और दुर्बल क्षार होता है
- (b) उदासीन होता है
- (1) Kp = Kc
- (e) Kp > Kc
- (g) Kp < Kc.
![]()
प्रश्न 4.
एक शब्द/वाक्य में उत्तर दीजिए –
- K. की इकाई हेतु सान्द्रता को व्यक्त करते हैं।
- अमोनिया गैस जल में घुलकर NH4OH देता है यहाँ जल किस प्रकार व्यवहार करता है ?
- जब NH4CI को NH4OH विलयन में मिलाया जाता है तो NH4OH का आयनन कम हो जाता है इसका क्या कारण है ?
- जल का 25°C पर pH = 7 है, यदि जल को 50°C तक गर्म किया जाये, तो pH में क्या परिवर्तन होगा?
- H2PO4– तथा HCO–3 के संयुग्मी क्षारक लिखिए।
- एक आयन का नाम लिखिए जो ब्रॉन्स्टेड अम्ल और क्षार दोनों की तरह व्यवहार करता है।
- दुर्बल अम्ल व दुर्बल क्षार से बने लवण का कोई एक उदाहरण बताइये।
- मानव रक्त का pH मान क्या है ?
- NaCl विलयन में HCl गैस गुजारने से क्या होता है ?
- निम्न संयुग्मी क्षारकों में कौन-सा प्रबल है CN– या F– ?
उत्तर:
- मोल/लीटर
- अम्ल की भाँति
- समआयन प्रभाव
- pH मान घट जायेगा
- HPO42, Co32-
- HCO3–
- अमोनियम ऐसीटेट
- 7.4
- NaCl अवक्षेपित होगा
- CN– प्रबल क्षारक।
![]()
साम्यावस्था अति लघु उत्तरीय प्रश्न
प्रश्न 1.
साम्य स्थिरांक का व्यंजक लिखते समय समझाइए कि शुद्ध द्रवों एवं ठोस को उपेक्षित क्यों किया जा सकता है ?
उत्तर:
शुद्ध ठोस अथवा द्रव (यदि आधिक्य में हो) की मोलर सान्द्रता नियत रहती है अर्थात् उपस्थित मात्रा से स्वतंत्र होती है।) यही कारण है कि साम्य स्थिरांक का व्यंजक लिखते समय शुद्ध द्रवों एवं ठोसों को उपेक्षित किया जाता है।
प्रश्न 4.
सक्रिय द्रव्यमान से आप क्या समझते हैं ?
उत्तर:
किसी विलयन की आण्विक सान्द्रता प्रति लीटर को उसका सक्रिय द्रव्यमान कहते हैं। दूसरे शब्दों में, सक्रिय भाग लेने वाले पदार्थ के ग्राम अणुओं की संख्या प्रति लीटर को सक्रिय द्रव्यमान कहते हैं। इसे ग्राम अणु/लीटर से दर्शाते हैं।

प्रश्न 5.
भौतिक साम्यावस्था से आप क्या समझते हो ? उदाहरण देकर समझाइए।
उत्तर:
वह साम्य जो भौतिक परिवर्तनों या प्रक्रमों में प्राप्त होता है भौतिक साम्य कहलाता है। किसी भी पदार्थ की ठोस, द्रव, गैस तीन अवस्थाएँ हो सकती हैं। जो एक-दूसरे में अन्तर परिवर्तित हो सकती है अतः भौतिक साम्य तीन प्रकार का हो सकता है।
(1) ठोस -द्रव
(2) द्रव = गैस
(3) ठोस – गैस।
![]()
प्रश्न 6.
ओस्टवाल्ड का तनुता नियम की व्याख्या कीजिए।
उत्तर:
ओस्टवाल्ड का तनुता नियम-दुर्बल वैद्युत अपघट्य के वियोजन की मात्रा विलयन के तनुता के वर्गमूल के अनुक्रमानुपाती होती है।
\(\sqrt { Kv } \)
जहाँ α = वियोजन की मात्रा, K = वियोजन स्थिरांक। v = तनुता (विलयन का लीटर में आयतन जिसमें एक ग्राम तुल्यांक विद्युत अपघट्य विलेय है)। c = एक लीटर विलयन में विलेय के ग्राम तुल्यांक की संख्या।
प्रश्न 7.
रासायनिक साम्यावस्था पर दाब का क्या प्रभाव पड़ता है ?
उत्तर:
रासायनिक साम्य पर दाब बढ़ाने से साम्य उस दिशा की ओर अग्रसर होता है जिस दिशा में आयतन में कमी आती है अर्थात् अणुओं की संख्या में कमी आती है।
उदाहरण:
SO2 , और O2 , के संयोग से SO3, बनता है तथा 45.2 kcal ऊष्मा मुक्त होती है।
2SO2(g) + O2(g) ⇄ 2SO3(g), ∆H = -45-2kcal
इस अभिक्रिया में 2 आयतन SO2, एक आयतन O2, से क्रिया करके 2 आयतन SO3, के बनते हैं। अतः दाब बढ़ाने से साम्य अग्र दिशा की ओर विस्थापित होता है।
प्रश्न 8.
बफर विलयन या प्रतिरोधी विलयन किसे कहते हैं ?
उत्तर:
बफर विलयन या प्रतिरोधी विलयन जिसका वह विलयन है –
- pH मान निश्चित होता है।
- तनुता से pH परिवर्तित नहीं होता।
- अल्प मात्रा में अम्ल या क्षार मिलाने पर जिनका pH मान में परिवर्तन नगण्य होता है।
प्रश्न 9.
अम्लीय बफर और क्षारीय बफर विलयन क्या है ?
उत्तर:
अम्लीय बफर:
अम्लीय बफर दुर्बल अम्ल और उसके अकार्बनिक लवण के मिश्रित विलयन होते हैं।
उदाहरण:
CH3COOH + CH3COONa विलयन।
क्षारीय बफर:
क्षारीय बफर दुर्बल क्षार और उसके अकार्बनिक लवण के मिश्रित विलयन होते हैं।
उदाहरण:
NH4OH + NH4C1 विलयन।
प्रश्न 10.
ली-शातेलिये का नियम क्या है ?
उत्तर:
ली-शातेलिये का नियम-इस नियम के अनुसार, “यदि साम्यावस्था पर स्थापित किसी निकाय के ताप, दाब या सान्द्रण में से कोई परिवर्तन किया जाये तो साम्य इस प्रकार से विस्थापित होता है जिससे परिवर्तन को उदासीन या प्रभावहीन किया जा सके। यह नियम भौतिक एवं रासायनिक साम्यों पर लागू किया जा सकता है।
![]()
प्रश्न 11.
साम्यावस्था पर उत्प्रेरक के प्रभाव को स्पष्ट कीजिए।
उत्तर:
उत्प्रेरक मिलाने से साम्यावस्था पर कोई प्रभाव नहीं पड़ता तथा साम्य स्थिरांक का मान अपरिवर्तित रहता है। उत्प्रेरक के उपयोग से साम्य जल्दी स्थापित होता है क्योंकि उत्प्रेरक अग्र व प्रतीप अभिक्रिया दोनों की दर को समान रूप से बढ़ाता है। वास्तव में उत्प्रेरक मिलाने से सक्रियण ऊर्जा में कमी हो जाती है जिससे अग्र व प्रतीप अभिक्रिया दोनों समान रूप से प्रभावित होती है।
प्रश्न 12.
समीकरण pH = -log[H+] के आधार पर, 10-8mol dm-3 HCI विलयन की pH 8 होनी चाहिए। परन्तु इसका प्रेक्षित मान 7 से कम आता है। कारण की व्याख्या कीजिए।
उत्तर:
10-8 mol dm-3 HCI सान्द्रता प्रदर्शित करती है कि विलयन अति तनु होना चाहिए। अतः हम विलयन में जल से उत्पन्न H3O+ आयनों की उपेक्षा नहीं कर सकते हैं। अतः प्राप्त कुल [H3O+] = (10-8 +10-7)M इस मान से हमें विलयन की pH 7 के लगभग परन्तु 7 से कम प्राप्त होती है। (क्योंकि विलयन अम्लीय है)।
प्रश्न 13.
अमोनिया लुईस क्षारक है, क्यों ?
उत्तर:
लुईस की अम्ल-क्षार अवधारणा के अनुसार वे यौगिक या पदार्थ जो एकांकी इलेक्ट्रॉन युग्म दान कर सकते हैं। अमोनिया के इलेक्ट्रॉनिक संरचना से स्पष्ट है कि अमोनिया में नाइट्रोजन के पास एक एकांकी इलेक्ट्रॉन युग्म है जिसे वह रासायनिक अभिक्रिया में दान कर सकता है। इसलिये अमोनिया प्रबल लुईस क्षार की तरह कार्य करता है।
प्रश्न 14.
तृतीय समूह के हाइड्रॉक्साइडों के अवक्षेपण में NH4Cl व NH4OH के स्थान पर NaCl की उपस्थिति में NaOH मिलाया जा सकता है, या नहीं?
उत्तर:
तृतीय समूह के हाइड्रॉक्साइडों के अवक्षेपण हेतु NH4Cl की उपस्थिति में NH4OHसम आयन प्रभाव के कारण मिलाया जाता है जिससे NH4OH का वियोजन कम हो। इनके स्थान पर NaCl + NaOH नहीं मिलाया जा सकता क्योंकि NaOH प्रबल क्षार है तथा सम आयन प्रभाव से केवल दुर्बल वैद्युत अपघट्य का वियोजन कम होता है। NaOH डालने पर आगे के हाइड्रॉक्साइड भी अवक्षेपित होने लगते हैं।
![]()
प्रश्न 15.
बफर विलयन के उपयोग लिखिए।
उत्तर:
उपयोग:
- रासायनिक क्रियाओं के वेग के अध्ययन में pH का मान स्थिर रखने के लिये बफर विलयन प्रयुक्त होते हैं।
- किण्वन से एल्कोहॉल का निर्माण करने के लिये pH 5 से 6.8 के बीच होना चाहिये।
- शक्कर और कागज का निर्माण तथा विद्युत लेपन निश्चित pH पर होता है।
प्रश्न 16.
गैसों की द्रवों में विलेयता पर दाब एवं ताप का क्या प्रभाव पड़ता है ?
उत्तर:
- दाब का प्रभाव – दाब बढ़ाने से गैसों की द्रवों में विलेयता बढ़ती है क्योंकि गैस के अणु विलायक के अन्तर अणुक स्थान में समा जाते हैं।
- ताप का प्रभाव – ताप बढ़ाने से गैसों की द्रवों में विलेयता घटती है क्योंकि गैसों के अणुओं की गतिज ऊर्जा बढ़ जाती है।
प्रश्न 17.
निम्न में से प्रत्येक अम्ल के संयुग्मी भस्म का सूत्र तथा नाम लिखिए –
- H3O+
- NH4+
- CH3NH3+
- H3PO4,
- NH2 – NH3+
उत्तर:
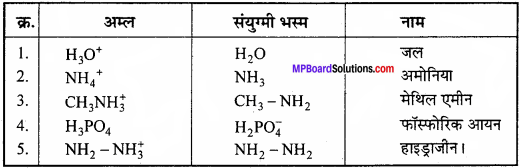
प्रश्न 18.
ब्रॉन्स्टेड क्षारकों NH2–, NH3, तथा HCOO– के संयुग्मी अम्ल लिखिए। ]
उत्तर:
क्षारक + H+ ⇄ संयुग्मी अम्ल
NH2– + H+ ⇄ NH–
NH3+H+ ⇄ NH4+
HCOO– + H+ ⇄ HCOOH
प्रश्न 19.
किसी दुर्बल क्षारक का संयुग्मी अम्ल सदैव प्रबल होता है। निम्नलिखित संयुग्मी क्षारकों की क्षारकता का घटता हुआ क्रम क्या होगा –
OH–, RO–,CH3COO–,Cl–
उत्तर:
दिए गए क्षारकों के संयुग्मी अम्ल क्रमशः H2O,ROH, CH3COOH तथा HCl है इनकी अम्लीयता का क्रम निम्न है –
HCI > CH3COOH > H2O > ROH
अतः इनके संयुग्मी क्षारकों की क्षारकता का क्रम निम्न होगा –
RO> OH > CH3COO >Cl..
![]()
प्रश्न 20.
साम्य स्थिरांक की इकाई क्या है ?
उत्तर:
साम्य स्थिरांक की इकाई अभिक्रिया के प्रकार पर निर्भर करती है यदि अभिक्रिया में अणुओं की संख्या में कोई परिवर्तन नहीं होता है तब साम्य स्थिरांक की कोई इकाई नहीं होती है। लेकिन अभिक्रिया के दौरान अणुओं की संख्या में परिवर्तन हो रहा है तो उनके लिये साम्य स्थिरांक की इकाई होती है।
उदाहरण:
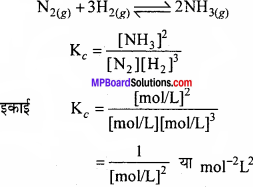
प्रश्न 21.
pH मान की उपयोगिता अम्लीय तथा क्षारीय विलयन की पहचान के लिये अधिक हैं, . क्यों?
उत्तर:
किसी विलयन का pH मान ज्ञात होने पर हम यह ज्ञात कर सकते हैं कि दिया गया विलयन अम्लीय, क्षारीय या उदासीन है –
- यदि pH का मान 7 से कम है तो विलयन अम्लीय होगा।
- यदि pH का मान 7 से अधिक है तो विलयन क्षारीय होगा।
- यदि pH का मान 7 है तो विलयन उदासीन होगा।
प्रश्न 22.
रासायनिक साम्य पर प्रभाव डालने वाले कारकों के नाम बताइये।
उत्तर:
रासायनिक साम्य को प्रभावित करने वाले कारक निम्नलिखित हैं –
- ताप
- दाब
- सान्द्रण परिवर्तन
- उत्प्रेरक।
प्रश्न 23.
सान्द्रण एवं दाब साम्य स्थिरांक में संबंध बताने वाला सूत्र लिखिए।
अथवा,
Kp एवं Kc में संबंध लिखिए।
उत्तर:
सान्द्रण एवं दाब साम्य स्थिरांक में संबंध – Kp = Kc × RT∆n
जहाँ Kp = दाब साम्य स्थिरांक,Kc = साम्य स्थिरांक, R = गैस स्थिरांक, T = परम ताप, ∆n = उत्पाद तथा अभिकारकों के मोलों का अंतर।
प्रश्न 24.
ताप में वृद्धि करने से CO2 की विलेयता कम होती है, क्यों?
उत्तर:
CO2(g) + H2O(g) ⇄ CO2(aq), CO2, की जल में विलेयता एक ऊष्माक्षेपी प्रक्रम है। अतः ली-शातेलिए सिद्धान्त के अनुसार ताप बढ़ाने पर यह अभिक्रिया प्रतीप दिशा में विस्थापित होती है। इसलिये ताप में वृद्धि करने पर CO2, की विलेयता कम होती है।
साम्यावस्था लघु उत्तरीय प्रश्न
प्रश्न 1.
सोडियम कार्बोनेट का जलीय विलयन क्षारीय होता है, क्यों ?
उत्तर:
Na2CO3 ⇄ 2Na+ + CO-23
2H2O ⇄ 2H+ + 2OH–
Na2CO3 + 2H2O ⇄ 2NaOH + H2CO3,
प्रबल क्षार दुर्बल अम्ल
Na2CO3 से प्राप्त Na+ आयन जल के OH– आयनों के साथ संयोग कर प्रबल विद्युत् अपघट्य NaOH बनाने के कारण जल में आयनों के रूप में रहता है जबकि CO3-2, आयन जल के H* आयन के साथ संयोग कर दुर्बल अम्ल H2CO3, बनाता है जो दुर्बल विद्युत् अपघट्य होने के कारण आंशिक रूप से आयनित रहता है। साम्यावस्था बनाये रखने के लिये H2O आयनित होने लगता है जिससे OH– आयनों का सान्द्रण बढ़ने लगता है। इसलिये सोडियम कार्बोनेट का जलीय विलयन क्षारीय होता है।
![]()
प्रश्न 2.
गैसों को द्रवों में घोलने पर साम्य पर क्या प्रभाव पड़ता है ? उदाहरण देकर समझाइये।
उत्तर:
सोडा वाटर की बोतल खोलने पर उसमें विलेय CO2 गैस तेजी से बाहर निकलती है। यह किसी गैस तथा द्रव में विलयन के मध्य स्थापित साम्यावस्था को दर्शाता है। निश्चित दाब पर गैस के विलेय एवं अविलेय अणुओं के मध्य साम्य स्थापित रहता है तथा इस प्रकार के साम्य के लिये हेनरी के नियम का पालन करते हैं।
हेनरी का नियम:
इस नियम के अनुसार, “स्थिर ताप पर विलायक की ज्ञात मात्रा में विलेय होने वाली गैस की मात्रा साम्यावस्था पर विलयन में गैस के दाब के समानुपाती होती है”। यदि विलेय होने वाली गैस की मात्रा m व दाब P हो, तो
m ∝ P m = KP.
उदाहरण:
सोडा वाटर की बोतल बंद करते समय बोतल के अंदर गैस का दाब वायुमण्डलीय दाब से बहुत अधिक होता है जिसके कारण द्रव में CO2, की अत्यधिक मात्रा विलेय रहती है। बोतल को खोलने पर विलयन पर आरोपित दाब में अचानक कमी आ जाने के कारण CO2, की विलेयता में कमी आती है जिसके कारण साम्यावस्था स्थापित करने के लिये CO2 गैस तेजी से बाहर निकलने लगती है।
प्रश्न 3.
सम आयन प्रभाव क्या है ? समझाइये ।
उत्तर:
सम आयन प्रभाव:
किसी दुर्बल विद्युत् अपघट्य के विलयन में कोई सम आयन युक्त प्रबल विद्युत् अपघट्य का विलयन मिलाने पर दुर्बल विद्युत् अपघट्य का आयनन कम हो जाता है। यह प्रभाव सम आयन प्रभाव कहलाता है।
उदाहरण:
द्वितीय समूह के परीक्षण में HCl + H2S का उपयोग समूह अभिकर्मक के रूप में करते हैं समूह II के सल्फाइडों का विलेयता गुणनफल चतुर्थ समूह के सल्फाइडों के विलेयता गुणनफल की अपेक्षा कम होता है। HCl की उपस्थिति में H2S प्रवाहित करने पर सम आयन प्रभाव के कारण H2S का आयनन और कम हो जाता है जिसके कारण विलयन से सल्फाइड आयनों का सान्द्रण घट जाता है।
HCl ⇄ H++Cl–
H2S ⇄ 2H+ + S-2
अतः समूह IV के सल्फाइडों का आयनिक गुणनफल उनके विलेयता गुणनफल से अधिक नहीं हो पाता परन्तु सल्फाइड आयनों का सान्द्रण द्वितीय समूह के सल्फाइडों के लिये पर्याप्त रहता है। क्योंकि द्वितीय समूह के सल्फाइडों का विलेयता गुणनफल कम होता है।
![]()
प्रश्न 4.
साम्यावस्था स्थिरांक की विशेषताएँ लिखिए।
उत्तर:
साम्यावस्था स्थिरांक की विशेषताएँ निम्नलिखित हैं –
- किसी निश्चित ताप पर किसी भी अभिक्रिया के लिये साम्य स्थिरांक का मान निश्चित होता है। इसका मान ताप परिवर्तन होने पर बदल जाता है।
- किसी भी अभिक्रिया के साम्यावस्था स्थिरांक का मान दाब तथा आयतन पर निर्भर नहीं करता।
- साम्य स्थिरांक का मान अभिकारकों व क्रियाफलों के प्रारंभिक मोलर सान्द्रण पर निर्भर नहीं करता बल्कि साम्यावस्था में उनके सान्द्रण पर निर्भर है।
- यदि अभिक्रिया विपरीत करायी जाती है तो साम्य स्थिरांक का मान भी पूर्व अभिक्रिया के विलोम होता है।
- यदि किसी रासायनिक अभिक्रिया को 2 से विभाजित किया जाता है तो प्राप्त नयी अभिक्रिया के लिये साम्य स्थिरांक पूर्व में ज्ञात साम्य स्थिरांक का वर्गमूल होगा। K’=\(\sqrt { K } \)
- यदि किसी रासायनिक अभिक्रिया जिसका साम्य स्थिरांक K है को 2 से गुणा किया जाता है तो नई अभिक्रिया के लिये प्राप्त साम्य स्थिरांक K का वर्ग होगा। K’= K2
- यदि अभिक्रिया को दो चरणों में लिखा जाता है इन पदों के साम्य स्थिरांक K1 व K2 हैं, तो
K = K1 × K2.
प्रश्न 5.
समांगी तथा विषमांगी साम्यावस्था को उदाहरण सहित समझाइये।
उत्तर:
समांगी साम्यावस्था:
जब रासायनिक साम्यावस्था में अभिकारक तथा उत्पादों की भौतिक अवस्था एकसमान हो, तो उसे समांगी साम्यावस्था कहते हैं।
N2(g) + 3H2(g) ⇄ 2NH3(g)
H2(g) + I2(g) ⇄ 2HI(g)
विषमांगी साम्यावस्था:
जब रासायनिक साम्यावस्था में अभिकारक एवं उत्पाद की भौतिक अवस्था असमान हो, तो उसे विषमांगी साम्यावस्था कहते हैं।
CaCO3(s) ⇄ CaO(s) + CO2(g)
BaCO3(s) ⇄ BaO(s) + CO2(g)
प्रश्न 6.
Kc तथा Qc के मानों की तुलना करके आप किसी अभिक्रिया की निम्नलिखित अवस्थाओं का पता किस प्रकार लगाओगे –
- परिणामी अभिक्रिया अग्र दिशा की ओर अग्रसर होती है।
- परिणामी अभिक्रिया पश्च दिशा की ओर अग्रसर होती है।
- अभिक्रिया में कोई परिवर्तन नहीं होता है।
उत्तर:
- यदि Qc < Kc ; अभिक्रिया उत्पादों की दिशा में अग्रसर होगी। (अग्र अभिक्रिया)
- यदि Qc > Kc; अभिक्रिया अभिकारकों की दिशा की ओर अग्रसर होगी। (अर्थात् प्रतीप या पश्चगामी अभिक्रिया)
- यदि Qc. = Kc ; अभिक्रिया मिश्रण पर साम्यावस्था में पूर्वतः होता है अतः अभिक्रिया में कोई परिवर्तन नहीं होता है।
प्रश्न 7.
निम्नलिखित में से प्रत्येक साम्य में जब आयतन बढ़ाकर दाब कम किया जाता है, तब बतलाइए कि अभिक्रिया के उत्पादों के मोलों की संख्या बढ़ती है या घटती है या समान रहती है ?
- PCl5(g) ⇄ PCl3(g) + Cl2(g)
- Ca(s) + CO2(g) ⇄ CaCO3(s)
- 3Fe(s) + 4H2O(g) ⇄ Fe3O4(s) + 4H2(g).
उत्तर:
ली-शातेलिए सिद्धान्त के अनुसार दाब घटाने पर साम्य उस दिशा में विस्थापित होता है जिस ओर दाब बढ़ता है। (अर्थात् गैसीय अवस्था में मोलों की संख्या अधिक होती है) अतः अभिक्रिया के उत्पादों के मोलों की संख्या:
- बढ़ती है।
- घटती है।
- समान रहती है। (यदि ∆ n(g) = 0 , तो दाब में परिवर्तन का कोई प्रभाव नहीं पड़ेगा।)
प्रश्न 8.
सान्द्रता भागफल किसे कहते हैं ?
उत्तर:
उत्पादों तथा अभिकारकों की सान्द्रताओं के अनुपात को सान्द्रता भागफल कहते हैं। इसे Q से दर्शाते हैं। किसी भी उत्क्रमणीय अभिक्रिया के लिये सान्द्रता भागफल Q उसके साम्यावस्था स्थिरांक K. के बराबर होता है।
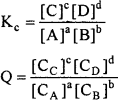
साम्यावस्था पर Q = Kc
![]()
प्रश्न 9.
आयनन साम्यावस्था को उदाहरण सहित समझाइये।
उत्तर:
जब भी किसी आयनिक यौगिक को जल या किसी उचित विलायक में विलेय किया जाता है तो वह विभाजित होकर धनायन तथा ऋणायन देता है। इस प्रकार किसी भी आयनिक यौगिक के आयनों में विभाजित होने की प्रक्रिया को आयनन या आयनीकरण कहते हैं। तथा इन यौगिकों को विद्युत् अपघट्य कहते हैं। वे आयनिक यौगिक जो पूर्णतः आयनित हो जाते हैं, प्रबल वैद्युत अपघट्य कहलाते हैं।
जैसे – NaCl, NaOH, H2SO4. इत्यादि, दूसरी तरफ वे यौगिक जो पूर्णतः आयनित नहीं होते, दुर्बल वैद्युत अपघट्य कहलाते हैं। जैसे – NH4OH, CH3COOH इत्यादि । दुर्बल वैद्युत अपघट्यों को जब H2O में विलेय कर विलयन बनाया जाता है तो विलयन में आयनों तथा अनआयनित अणुओं के मध्य एक साम्यावस्था स्थापित हो जाती है जिसे आयनन साम्यावस्था कहते हैं।
NH4OH(aq) = NH4(aq)+ + OH(aq)–(aq)
प्रश्न 10.
रासायनिक साम्य से क्या समझते हैं ? इसकी प्रमुख विशेषताएँ लिखिए।
उत्तर:
किसी उत्क्रमणीय रासायनिक अभिक्रिया की वह अवस्था जिसमें क्रियाकारकों तथा क्रियाफलों के सान्द्रण में समय के साथ कोई परिवर्तन नहीं होता। अर्थात् किसी रासायनिक उत्क्रमणीय अभिक्रिया की वह अवस्था जिसमें अग्र अभिक्रिया प्रतीप अभिक्रिया समान वेग से घटित होती है। रासायनिक साम्यावस्था कहलाती है।
साम्यावस्था की विशेषताएँ:
- साम्यावस्था पर अग्र और प्रतीप अभिक्रियाओं का वेग समान रहता है।
- क्रियाकारकों और क्रियाफलों की आपेक्षिक मात्राएँ साम्य मिश्रण में स्थिर रहती हैं।
- साम्य की प्रकृति गतिक होती है। अर्थात् साम्यावस्था पर अभिक्रिया रुकती नहीं है बल्कि अग्र अभिक्रिया और प्रतीप अभिक्रिया समान वेग से निरन्तर होती रहती है।
- ताप, दाब या सान्द्रण में परिवर्तन करा के साम्य की स्थिति को बदला जा सकता है।
- साम्यावस्था पर मुक्त ऊर्जा परिवर्तन शून्य होता है अर्थात् ∆G = 0 होता है।
प्रश्न 11.
दाब बढ़ाने पर निम्न में से कौन-सी अभिक्रियाएँ प्रभावित होगी। यह भी बताइए दाब परिवर्तन करने पर अभिक्रिया अग्र या प्रतीप दिशा में गतिमान होगी
- COCI2(g) CO(g) + Cl2(g)
- CH4(g) + 2S2(g) ⇄ CS2(g) + 2H2S(g)
- CO2(g) + C(S) ⇄ 2CO(g)
- CaCO3(S) ⇄ Cao(S) + CO2(S)
- 4NH3(g) +5O2(g) ⇄ 4NO(g) +6H2O(g)
उत्तर:
- np>nr, प्रतीप दिशा में अग्रसर होगी।
- np = nr दाब वृद्धि के कारण साम्य प्रभावित नहीं होगा।
- np>nr प्रतीप दिशा में अग्रसर होगी।
- np > nrप्रतीप दिशा में अग्रसर होगी।
- np >nr प्रतीप दिशा में अग्रसर होगी।
प्रश्न 12.
भौतिक साम्यावस्था से क्या समझते हैं ? इसकी प्रमुख विशेषताएँ लिखिए।
उत्तर:
वह साम्य जो भौतिक परिवर्तनों या प्रक्रमों में प्राप्त होता है भौतिक साम्य कहलाता है। दूसरे शब्दों में भौतिक साम्यावस्था वह साम्य है जो एक ही रासायनिक यौगिक की दो विभिन्न प्रावस्थाओं के मध्य स्थापित होती है तथा अभिक्रिया के दौरान उस यौगिक के रासायनिक संगठन में कोई परिवर्तन नहीं होता केवल उसकी भौतिक अवस्था में परिवर्तन होता है।
उदाहरण:
बर्फ(ठोस) ⇄ जल(द्रव)
जल(द्रव) ⇄ जलवाष्प(गैस)
भौतिक साम्य की विशेषताएँ:
- बंद निकाय होना चाहिये अर्थात् घिराव से पदार्थ का आदान-प्रदान नहीं होना चाहिये।
- इस स्थिति में गतिशील परन्तु स्थिर अवस्था रहती है। अर्थात् दोनों विपरीत प्रक्रम समान गति से चलने चाहिये।
- पदार्थ का सान्द्रण स्थिर रहना चाहिये तथा मापने योग्य गुण जैसे ताप, दाब इत्यादि स्थिर होने चाहिये।
- ठोस तथा द्रव के बीच साम्यावस्था एक निश्चित ताप पर स्थापित होती है जिसे गलनांक या हिमांक कहते हैं।
![]()
प्रश्न 13.
विलेयता गुणनफल की परिभाषा देकर इसे स्पष्ट कीजिए।
उत्तर;
निश्चित ताप पर किसी विलेय वैद्युत अपघट्य के संतृप्त विलयन में उसके आयनों की सान्द्रताओं का गुणनफल विलेयता गुणनफल कहलाता है। यह मान किसी दिये हुये ताप पर स्थिर होता है। किसी वैद्युत अपघट्य पदार्थ का संतृप्त विलयन यदि अपने ठोस के संपर्क में हो, तो उसमें निम्नलिखित साम्यावस्था होती है –
![]()
द्रव्य अनुपाती क्रिया नियम के अनुसार,

जहाँ Ksp एक स्थिरांक है जिसे विलेयता गुणनफल कहते हैं।
प्रश्न 14.
किसी अल्प विलेय द्विअंगी विद्युत् अपघट्य की विलेयता एवं विलेयता गुणनफल में संबंध स्थापित कीजिए।
उत्तर:
माना कि AB एक द्विअंगी वैद्युत अपघट्य है जिसकी विलेयता 3 ग्राम मोल/ लीटर है।
AB ⇄ A+ + Br –
[A+] = S तथा [B–] = S
विलेयता गुणनफल के अनुसार,
Ksp = [A+][B–]
मान रखने पर,
Ksp = [S][S]
⇒ Ksp = S2
⇒ \(\sqrt { { K }_{ sp } } \) = S
अर्थात् किसी अल्प विलेय द्विअंगी वैद्युत अपघट्य की विलेयता उसके विलेयता गुणनफल के वर्गमूल के बराबर होती है।
प्रश्न 15.
AgCl का उदाहरण देकर विलेयता गुणनफल को समझाइये।
उत्तर:
![]()
द्रव्य अनुपाती क्रिया नियम के अनुसार,

अत: AgCl के संतृप्त विलयन में Ag+ तथा Cr– आयनों की सान्द्रता का गुणनफल, विलेयता गुणनफल होगा।
प्रश्न 16.
लुईस अम्ल एवं लुईस क्षार से क्या समझते हो? उदाहरण सहित स्पष्ट कीजिए।
उत्तर:
लुईस अम्ल:
ऐसे अणु, आयन या मूलक जिनके केन्द्रीय परमाणु को अष्टक पूर्ण करने के लिये एकाकी इलेक्ट्रॉन युग्म की आवश्यकता होती है लुईस अम्ल कहलाते हैं। अर्थात् इलेक्ट्रॉन युग्म ग्राही लुईस अम्ल कहलाता है।
उदाहरण:
BF3 AICl3 Br+, NO+2 इत्यादि।
लुईस क्षार:
ऐसे अणु, आयन या मूलक जिनके केन्द्रीय परमाणु का अष्टक पूर्ण होता है तथा इनके पास एकाकी इलेक्ट्रॉन युग्म होते हैं जिसे ये रासायनिक अभिक्रिया में दान करके उपसहसंयोजी बंध बना सकते हैं, लुईस क्षार कहलाते हैं । अर्थात् इलेक्ट्रॉन युग्म दाता लुईस क्षार कहलाते हैं।
उदाहरण:
प्रश्न 17.
संयुग्मी अम्ल एवं संयुग्मी क्षार से क्या समझते हैं ?
उत्तर:
संयुग्मी अम्ल:
जब कोई अणु या आयन प्रोटॉन ग्रहण करता है तो बनने वाला समूह अम्ल की तरह कार्य करता है। क्योंकि इसमें प्रोटॉन दान करने की प्रवृत्ति होती है। इसे उस क्षार का संयुग्मी अम्ल कहते
उदाहरण:
NH3 का संयुग्मी अम्ल NH3+ है।
संयुग्मी क्षार:
जब कोई अणु, आयन या अम्ल प्रोटॉन दान करता है तो बचा हुआ समूह क्षार की तरह कार्य करता है। क्योंकि इसमें प्रोटॉन ग्रहण करने की शक्ति होती है। इसे उस अम्ल का संयुग्मी क्षार कहते हैं।
उदाहरण:
HCl का Cl– आयन संयुग्मी क्षार है। अत: संयुग्मी अम्ल एवं संयुग्मी क्षार में एक प्रोटॉन का अन्तर होता है। प्रबल अम्ल का संयुग्मी क्षार सदैव दुर्बल होता है।

प्रश्न 18.
310 K पर जल का आयनिक गुणनफल 2.7× 10-14 है। इसी तापक्रम पर उदासीन जल की pH ज्ञात कीजिए।
हल:
K.w = [H3O+] [OH– ] = 2.7 × 10-14
अभिक्रिया H2O + H2O ⇄ [H2O+][OH– ] हेतु
[H3O+] = [OH–]
अतः [H2O+] = \(\sqrt { 2.7\times { 10 }^{ -14 } } \) = 1.643 × 10-7M
pH = – log[H3O+] = -log 1.643 × 10-7 = 7 + (-0.2156) = 6.7844.
प्रश्न 19.
pH मान क्या है ? स्पष्ट कीजिए। अथवा, pH किसे कहते हैं ? और इसका हाइड्रोजन सान्द्रण से क्या संबंध है ?
उत्तर:
किसी विलयन की अम्लीयता एवं क्षारीयता को व्यक्त करने के लिये सन् 1909 में सारेन्सन ने एक पैमाना प्रस्तुत किया जिसे pH मापक्रम या स्केल कहते हैं। किसी विलयन का pH मान उस ऋणात्मक घात के संख्यात्मक मान के बराबर होता है जिसे 10 की घात पर लगाया जाना चाहिए जो उस विलयन के H’ आयन या H3O+ आयन के सान्द्रण को दर्शाता है। दूसरे शब्दों में किसी विलयन का pH मान उसके H+ आयन सान्द्रण का ऋण चिन्ह के साथ 10 आधार पर लघुगणक होता है।
![]()
प्रश्न 20.
H2S प्रवाहित करने से पहले प्रथम वर्ग के छनित को HCl द्वारा अम्लीय किया जाता है। क्यों?
उत्तर:
प्रथम वर्ग के छनित का उपयोग द्वितीय वर्ग के सल्फाइडों के परीक्षण के लिये किया जाता है। इसके लिये H2S प्रवाहित करने के पूर्व छनित को तनु HCI मिलाकर अम्लीय कर लिया जाता है। समूह द्वितीय के सल्फाइडों का विलेयता गुणनफल चतुर्थ समूह के सल्फाइडों के विलेयता गुणनफल से कम होता है। H2S दुर्बल वैद्युत अपघट्य है जिसका आयनन कम होता है।
किन्तु HCl प्रबल वैद्युत अपघट्य है जिसके सम आयन प्रभाव के कारण H2S का आयनन कम हो जाता है। जिसके फलस्वरूप सल्फाइड आयनों का सान्द्रण घट जाता है। जिसके कारण चतुर्थ समूह के धातु सल्फाइडों का आयनिक गुणनफल उनके विलेयता गुणनफल से अधिक नहीं हो पाता इसलिये वे अवक्षेपित नहीं होते हैं, परन्तु सल्फाइड आयनों का सान्द्रण द्वितीय समूह के सल्फाइडों के अवक्षेपण के लिये पर्याप्त रहता है क्योंकि इनका विलेयता गुणनफल कम होता है।
प्रश्न 21.
FeSO4तथा Na2S के सममोलर विलयनों की अधिकतम सान्द्रता बताइए जब उनके समान आयतन मिलाने पर आयरन सल्फाइड न हो।(आयरन सल्फाइड के लिएKsp = 6.3 × 10-18 )
हल:
अवक्षेपण बिन्दु पर [Fe2+][S2-] = Ksp
[Fe2+] = [S2-] = \(\sqrt { { K }_{ sp } } \) = \(\sqrt { 6.3\times { 10 }^{ -18 } } \)
[Fe2+] = [S2-] = 2.51 × 10-9M
चूँकि विलयनों के समान आयतन मिलाए गए हैं। अतः प्रत्येक विलयन की मोलर सान्द्रता आधी रह जाती है जिसके कारण मूल विलयन में [FeSO4.] = [Na2S] = 2 × 2.51 × 10-9M = 5.02 × 10-9M अतः विलयन की उच्चतम मोलरता = 2.5 × 10-‘M है।
प्रश्न 22.
यदि पिरीडिनीयम हाइड्रोजन क्लोराइड के 0.02 M विलयन का pH 3.44 है तो पिरीडीन का आयनन स्थिरांक ज्ञात कीजिए।
हल:
पिरीडिनीयम हाइड्रोजन क्लोराइड दुर्बल क्षारक (पिरीडीन) तथा प्रबल अम्ल HCI का लवण है।
C6H5N HCl + H2O ⇄ C6H5N+ HOH– + HCl (जलयोजन के कारण अम्लीय विलयन है।)
अतः pH = – \(\frac {1 }{ 2 }\) [log Kw – logKb +log C]
⇒ 3.44 =- \(\frac {1 }{ 2 }\) [-14 -log Kb + log 2.0 × 10-2]
⇒ 6.88 = 14 + logKb +1.70
⇒ log Kb = – 8.82 = \(\overline { 9 } \) .18
∴ Kb= antilog \(\overline { 9 } \) .18 = 1.5 × 10-9 .
प्रश्न 23.
NaCl की जल के साथ अभिक्रिया को जल अपघटन अभिक्रिया में नहीं गिना जाता है, क्यों?
उत्तर:
NaCl जल अपघटित नहीं होता क्योंकि जब NaCl को जल में विलेय किया जाता है तो वह आयनित होकर Na+ तथा Cl– आयन देता है। Na+ आयन OH– आयन के साथ संयोग नहीं कर पाता। क्योंकि NaOH प्रबल वैद्युत अपघट्य है। इसी प्रकार Cr आयन H+ आयनों के साथ संयोग नहीं करते क्योंकि HCl भी प्रबल वैद्युत अपघट्य है। इस प्रकार इसके जलीय विलयन में H+ तथा OH– आयनों की सान्द्रता बराबर होगी। इस प्रकार NaCl का जलीय विलयन न तो अम्ल की तरह कार्य करेगा और न ही क्षार की तरह इसलिये इसे जल अपघटन अभिक्रिया में नहीं गिना जा सकता है।
NaCl + H2O ⇄ NaOH + HCl
प्रश्न 24.
निम्नलिखित अभिक्रियाओं के लिये सान्द्रता भागफल प्राप्त कीजिए –
(1) Cro-24(aq) + Pb+24(aq) ⇄ PbCrO4(s)
(2) CaCO3(s) ⇄ Ca0(s) + CO2(s)
(3) NH3(aq) + H2O(l) ⇄ NH4(aq)+ + OH(aq)–
(4) H2O(l) ⇄ H2O(g)
उत्तर:

प्रश्न 25.
क्लोरोऐसीटिक अम्ल का आयनन स्थिरांक 1.35 × 10-3 है। 0.1 M तथा इसके 0.1 M सोडियम लवण का pH ज्ञात कीजिए।
हल:
CH2ClCOOH + H2O ⇄ CH2ClCOO– + H3O+
प्रश्नानुसार K.α = 1.35 × 10-3 (दिया है) क्लोरोएसीटिक अम्ल का सोडियम लवण, प्रबल क्षारक NaOH तथा दुर्बल अम्ल क्लोरोएसीटिक अम्ल से बना है। अतः प्रबल क्षारक एवं दुर्बल अम्ल से बने लवण हेतु
pH = \(\frac { 3 }{ 2 }\)[log Kw + log Kα– log C]

![]()
प्रश्न 26.
निम्नलिखित लवणों के जलीय विलयनों के उदासीन, अम्लीय तथा क्षारीय होने की प्रागुक्ति कीजिए – NaCl, KBr, NaCN, NH,NO3,NaNO, एवं KE.
हल:
प्रश्न 27.
निम्नलिखित अभिक्रियाओं के लिये साम्य स्थिरांक व्यंजक लिखिए –
1. BaCO3(s) ⇄ BaO(s)+ CO2(s)
2. CH3COCH3(l) ⇄ CH3 COCH3(g)
3. AgBr3(s) + aq ⇄ Ag(aq)+ + Br(aq)–
4. CH4(g)+ 2O2(g) ⇄ CO2(g) + 2H2O(l)
उत्तर:

प्रश्न 28.
नमक के शोधन में विलेयता गुणनफल का क्या महत्व है ?
उत्तर:
साधारण नमक का शोधन करने के लिये उसके संतृप्त विलयन से निलम्बित अशुद्धियाँ हटाकर HCl गैस प्रवाहित करते हैं, संतृप्त विलयन में निम्नलिखित साम्यावस्था होती है।
NaCl ठोस ⇄ NaCl विलयन – Na+ + CI–
HCl एक प्रबल वैद्युत अपघट्य है जिसका आयनन बहुत अधिक होता है । HCl गैस प्रवाहित करने पर विलयन में Cl– आयनों का सान्द्रण बहुत अधिक हो जाता है इससे आयनिक गुणनफल का मान विलेयता गुणनफल से बहुत अधिक हो जाता है तथा सोडियम क्लोराइड विलयन अति संतृप्त हो जाता है। साम्य को स्थापित करने के लिये NaCl के अति संतृप्त विलयन से ठोस NaCl अवक्षेपित होने लगता है। इस प्रकार अवक्षेपित NaCl शुद्ध अवस्था में प्राप्त होता है जिसे छान कर सुखा लेते हैं।
प्रश्न 29.
AgCl की जल में विलेयता साधारण नमक के विलयन की अपेक्षा अधिक होती है, क्यों?
उत्तर:
जब कोई अल्प विलेय लवण सम आयन के साथ संकर लवण नहीं बनाता तो सम आयन की उपस्थिति में लवण की विलेयता घट जाती है। क्योंकि लवण का आयनिक गुणनफल उसके विलेयता गुणनफल से अधिक होती है। AgCl की विलेयता नमक के विलयन की अपेक्षा जल में अधिक होती है। NaCl की उपस्थिति में विलयन के आयनों की सान्द्रता बढ़ जाती है जिससे आयनिक गुणनफल का मान विलेयता गुणनफल से बढ़ जाता है या अधिक हो जाता है। जिससे लवण अवक्षेपित होने लगता है और उसकी विलेयता कम होने लगती है।
![]()
प्रश्न 30.
साबुन के अवक्षेपण में विलेयता गुणनफल का क्या महत्व है ?
उत्तर:
साबुन उच्च वसीय अम्लों के सोडियम या पोटैशियम लवण होते हैं जो तेल या वसा का क्षार द्वारा जल अपघटन करने से प्राप्त होता है। साबुन बनाने की गर्म विधि में साबुन सान्द्र विलयन के रूप में प्राप्त होता है जिसे अवक्षेपित करने के लिये नमक का संतृप्त विलयन मिलाया जाता है। नमक का सान्द्र विलयन मिलाने से Na* आयनों का सान्द्रण बढ़ जाता है जिससे आयनिक गुणनफल उस ताप पर साबुन के विलेयता गुणनफल के मान से अधिक हो जाता है। इस प्रकार ठोस साबुन का उसके विलयन से अवक्षेपण हो जाता है।
प्रश्न 31.
NH4OH विलयन द्वारा तृतीय समूह के हाइड्रॉक्साइडों का अवक्षेपण करने के पहले NH4Cl मिलाना आवश्यक होता है, क्यों?
उत्तर:
तृतीय समूह में Fe+3,Cr+3, और A+3 को उनके हाइड्रॉक्साइड के रूप में NH4Cl तथा अधिक मात्रा में NH4 OH मिलाकर अवक्षेपित किया जाता है। समूह III के हाइड्रॉक्साइड का विलेयता गुणनफल का मान समूह IV, V, VI के हाइड्रॉक्साइडों के विलेयता गुणनफल से कम है।

तृतीय समूह के अवक्षेपण में यदि केवल NH4OH का उपयोग किया जाये तो OH– आयनों का सान्द्रण इतना अधिक होगा कि तृतीय समूह के हाइड्रॉक्साइड के साथ IV, V, VI समूह के हाइड्रॉक्साइड का भी अवक्षेपण हो जायेगा। लेकिन यदि तृतीय समूह के परीक्षण में NH4OH से पहले NH4CI मिलाते हैं तो समआयन प्रभाव के कारण दुर्बल वैद्युत अपघट्य NH4OH का वियोजन, कम हो जाता है जिसमें कम OH– आयन प्राप्त होते हैं और ये OH– आयन केवल तृतीय समूह के हाइड्रॉक्साइड को ही अवक्षेपित करते हैं।
प्रश्न 32.
नाइट्रिक ऑक्साइड के संश्लेषण में अमोनिया संश्लेषण की अपेक्षा उच्च ताप क्यों प्रयुक्त किया जाता है ?
उत्तर:
N2 + O2 ⇄ 2NO ; ∆H = + 43KCal
N2 + 3H2 ⇄ 2NH3; ∆H = -92.4KCal
ली-शातेलिये सिद्धान्त के अनुसार ताप में वृद्धि करने पर अभिक्रिया उस दिशा में विस्थापित होती है जिस दिशा में अभिक्रिया ऊष्माशोषी होती हैं। नाइट्रिक ऑक्साइड का संश्लेषण ऊष्माशोषी अभिक्रिया है जबकि अमोनिया का संश्लेषण ऊष्माक्षेपी अभिक्रिया है। इसलिये ताप में वृद्धि करने से नाइट्रिक ऑक्साइड के संश्लेषण में अभिक्रिया अग्र दिशा की ओर विस्थापित होती है जिससे NO के बनने की दर बढ़ जाती है जबकि NH3 संश्लेषण में ताप वृद्धि करने से अभिक्रिया प्रतीप दिशा में विस्थापित होती है जिससे NH3 के बनने की दर कम हो जाती है। इसलिये NO का संश्लेषण NH3 की तुलना में उच्च ताप पर कराया जाता है।
प्रश्न 33.
अम्ल एवं क्षार की ब्रॉन्स्टेड – लॉरी अवधारणा को उदाहरण सहित समझाइये।
उत्तर:
ब्रॉन्स्टेड – लॉरी अवधारणा:
इस सिद्धान्त के अनुसार अम्ल वह पदार्थ है, जो प्रोटॉन दान कर सकता है जबकि क्षार वह पदार्थ है जो प्रोटॉन ग्रहण कर सकता है।

उपर्युक्त उदाहरण में HCl प्रोटॉन दाता है इसलिये यह अम्ल है जबकि H2O प्रोटॉन ग्राही है इसलिये H2O क्षार है। अम्ल जब प्रोटॉन दान करता है तो बचा हुआ समूह क्षार की तरह कार्य करता है इसे उस अम्ल का संयुग्मी क्षार कहते हैं। इसी प्रकार जब क्षार एक प्रोटॉन ग्रहण करता है तो बनने वाला समूह अम्ल की तरह कार्य करता है इसे उस क्षार का संयुग्मी अम्ल कहते हैं तथा संयुग्मी अम्ल-क्षार युग्म में केवल एक प्रोटॉन का अंतर होता है।
![]()
साम्यावस्था दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
साम्य स्थिरांक Kp और Kc में संबंध स्थापित कीजिए। अथवा, सिद्ध कीजिए कि Kp = Kc RT∆n .
उत्त:
सन् 1867 में गुल्डबर्ग एवं वागे ने अभिक्रिया की दर तथा अभिकारकों के सान्द्रण के बीच संबंध स्थापित किया जिसे बाद में द्रव्य अनुपाती क्रिया का नियम दिया। जिसके अनुसार “निश्चित ताप पर किसी पदार्थ के क्रिया करने की दर उसकी सक्रिय मात्रा के समानुपाती होती है तथा रासायनिक अभिक्रिया की दर अभिकारकों के सक्रिय मात्राओं के गुणनफल के समानुपाती होती है।”
उदाहरण –
aA + bB ⇄ cC + dD
यदि A, B, C तथा D के सक्रिय द्रव्यमान [A], [B], [C] तथा [D] हैं, तो
अग्र अभिक्रिया का वेग α [A][B].
या अग्र अभिक्रिया की दर = Kf[A][B]
इसी प्रकार प्रतीप अभिक्रिया की दर = Kb[C][D]
साम्यावस्था पर, Kf [A][B] = Kb[C][D]
जहाँ Kcअभिक्रिया का साम्य स्थिरांक है।
Kpतथा Kcमें संबंध:
माना एक रासायनिक उत्क्रमणीय अभिक्रिया में अभिकारक A व B तथा उत्पाद C व D सभी गैसीय अवस्था में हैं।
aA +bB ⇄ cC + dD
द्रव्य अनुपाती क्रिया नियम के अनुसार,
![]()
आण्विक सान्द्रण के स्थान पर आंशिक दाब का प्रयोग करने पर
![]()
आदर्श गैस समीकरण के अनुसार,
⇒PV = nRT
⇒ P = \(\frac { n}{ v }\)RT
∴ \(\frac { n}{ v }\) = C
⇒ P = CRT,
जहाँ C गैस के मोलर सान्द्रण को दर्शाता है।
Pa = CaRT = [A] RT
Pb = CbRT = [B] RT
Pc = CcRT = [C] RT
Pd = CdRT = [D] RT
समीकरण (2) में मान रखने पर,
![]()
समीकरण (1) के अनुसार,
Kp = Kc × RT = Kc × RT (c+d)-(a+b)
[∴ (c+d) – (a+b) = ∆n]
या Kp = Kc RT∆n
![]()
प्रश्न 2.
नीचे दर्शाए गए साम्य में 899 K पर Kp का मान 0.04 atm है। C2H6 की साम्य पर सान्द्रता क्या होगी, यदि 4.0 atm दाब पर C2H6 को एक फ्लास्क में रखा गया है एवं साम्यावस्था पर आने दिया जाता है।
हल:
प्रश्न 3.
निम्नलिखित समीकरण के लिये साम्य स्थिरांक की गणना कीजिए –
(1) PCl5 ⇄ PCl3 + Cl2,
(2) H2 + I2 ⇄ 2HI.
उत्तर:
(1) माना कि PCl5 के a मोल अभिक्रिया प्रारंभ करते हैं और साम्यावस्था पर x मोल वियोजित होते हैं। यदि पात्र का आयतन v लीटर हो, तो

(2) HI का संश्लेषण-माना कि प्रारंभ में H2 व I2 के क्रमश: a तथा b मोल लेकर अभिक्रिया प्रारंभ करते हैं। साम्यावस्था पर दोनों के x मोल संयोग करते हैं। यदि पात्र का आयतन v लीटर हो, तो।

प्रश्न 4.
दुर्बल वैद्युत अपघट्यों के वियोजन सम्बन्धी ओस्टवाल्ड का तनुता सिद्धान्त का प्रतिपादन कीजिए। इसकी क्या सीमाएँ हैं ?
अथवा
आयनन की मात्रा और आयनन स्थिरांक में संबंध स्थापित कीजिए।
उत्तर:
सन् 1888 में ओस्टवाल्ड ने बताया कि दुर्बल वैद्युत अपघट्य के विलयन में आयनों तथा अनआयनित अणुओं के मध्य एक साम्य स्थापित हो जाता है और इस आयनिक साम्यावस्था पर द्रव्य अनुपाती क्रिया नियम का प्रयोग किया जा सकता है जिसे ओस्टवाल्ड का तनुता नियम कहते हैं। माना AB एक दुर्बल वैद्युत अपघट्य है जिसके एक मोल को । लीटर में विलेय है यदि आयनन की मात्रा α है, तो

दुर्बल वैद्युत अपघट्य में आयनन की मात्रा अत्यंत कम होती है। अतः ४ का मान नगण्य होगा अतः (1 – α) = 1 रखने पर,
K = \(\frac { { α }^{ 2 } }{ v } \)
KV = α2
\(\sqrt { K v} \) = α
∴ \(\frac { 1 }{ v }\)
\(\sqrt { K\frac { 1 }{ c } }\)
ओस्टवाल्ड के तनुता नियमानुसार दुर्बल वैद्युत अपघट्य के वियोजन की मात्रा उसकी तनुता के वर्गमूल के समानुपाती तथा उसकी सान्द्रता के वर्गमूल के व्युत्क्रमानुपाती होती है।
![]()
प्रश्न 5.
∆G और के मध्य संबंध लिखिये तथा पद के अर्थ को परिभाषित कीजिए।निम्न प्रश्नों के उत्तर भी दीजिए –
(a) जब Q < K तब अभिक्रिया अग्र दिशा में क्यों अग्रसर होती है तथा जब Q = K तब परिणामी अभिक्रिया क्यों नहीं होती है ?
(b) निम्न अभिक्रिया के दाब में वृद्धि का अभिक्रिया भागफल (Q) पर प्रभाव बताइये –
CO2(g) + 3H2(g) ⇄ CH4(g) + H2O(g)
हल:
∆G तथा Q के मध्य निम्नलिखित संबंध है –
∆G = ∆G°+ RT In Q जहाँ ∆G = अभिक्रिया होने के फलस्वरूप मुक्त ऊर्जा में परिवर्तन, ∆G° = मानक मुक्त ऊर्जा Q = अभिक्रिया भागफल, R = गैस नियतांक, T = परम ताप
(a) AG° = -RT in K
∆G = -RT In K + RT In Q = RT In \(\frac { Q }{ K}\)
यदि Q < K, ∆G = ऋणात्मक होगा तथा अभिक्रिया अग्र दिशा में अग्रसर होगी।
यदि Q = K, ∆G = शून्य अभिक्रिया साम्य में होगी तथा क्रिया पर कोई प्रभाव नहीं पड़ेगा।
(b) CO(g) + 3H2(g) ⇄ CH4(g) + H2O(g).
![]()
दाब घटाने पर आयतन घटता है। दाब दोगुना करने पर आयतन आधा रह जाता है परन्तु मोलर सान्द्रताएँ दोगुनी हो जाती हैं तब
![]()
अत: Q, K. की अपेक्षा कम है अत: Q साम्यावस्था को पुनः प्राप्त करने के लिए वृद्धि करने का प्रयास करेगा जिसके कारण अभिक्रिया अग्र दिशा में अग्रसर होगी।
प्रश्न 6.
आयनन की मात्रा से क्या समझते हो ? तथा आयनन की मात्रा को प्रभावित करने वाला कारक लिखिए।
उत्तर:
आयनिक यौगिक ठोस अवस्था में ही स्थायी होते हैं। क्योंकि ये स्थिर वैद्युत आकर्षण बल द्वारा जुड़े रहते हैं। इन आयनिक यौगिकों को जब किसी विलायक में विलेय किया जाता है तो स्थिर वैद्युत आकर्षण बल में कमी के कारण ये आयनों में विभक्त हो जाते हैं। किसी विलयन में यौगिकों का आयनों में पृथक् होना आयनन कहलाता है। कुल मात्रा में से जिस अंश तक किसी यौगिक का आयनन होता है, उसे आयनन की मात्रा या वियोजन की मात्रा कहते हैं।
![]()
आयनन को प्रभावित करने वाले कारक –
(1) विलेय की प्रकृति:
प्रबल वैद्युत अपघट्य जलीय विलयन में पूर्णतः आयनित हो जाते हैं इसलिये इनकी आयनन की मात्रा अधिक होती है जबकि दुर्बल वैद्युत आयनों में आंशिक रूप से आयनित होते हैं । इसलिये इनकी आयनन की मात्रा कम होती है।
(2) सान्द्रता:
आयनन की मात्रा सान्द्रता के व्युत्क्रमानुपाती होती है अत: विलयन की तनुता में वृद्धि करने पर आयनन की मात्रा में वृद्धि होती है।
(3) विलायक की प्रकृति:
विलायक विलेय में उपस्थित स्थिर विद्युत् आकर्षण बल में कमी लाते हैं। इस गुण को विलायक का डाई इलेक्ट्रिक स्थिरांक कहते हैं। किसी भी विलायक का डाई इलेक्ट्रिक स्थिरांक का मान जितना अधिक होगा उसमें विलेय के आयनन की मात्रा उतनी अधिक होगी।
(4) ताप:
आयनन की मात्रा ताप के समानुपाती होती है ताप में वृद्धि करने से आयनन की मात्रा में वृद्धि होती है क्योंकि ताप में वृद्धि करने से स्थिर विद्युत् आकर्षण बल में कमी आती है।
प्रश्न 7.
अम्ल तथा क्षारक क्या है ? इनकी आपेक्षिक प्रबलता कैसे ज्ञात करते हैं ?
उत्तर:
आर्तीनियस के अनुसार अम्ल वह पदार्थ है जो जल में विलेय होकर H’ आयन दान करते हैं।
HCl ⇄ H+ + Cl–
ब्रॉन्स्टेड-लॉरी अवधारणा के अनुसार अम्ल वह पदार्थ है जो विलयन में किसी अन्य यौगिक या पदार्थ को प्रोटॉन दान करते हैं।
HCl + H2O ⇄ Cl– + H3O+
लुईस परिकल्पना के अनुसार अम्ल वह पदार्थ है जो किसी अन्य पदार्थ से इलेक्ट्रॉन युग्म ग्रहण कर सकते हैं।
NH4: + BE3 → NH3 → BF3
लुईस अम्ल
अम्ल की प्रबलता:
किसी भी अम्ल की प्रबलता को अम्ल के आयनन स्थिरांक की सहायता से दर्शाया जा सकता है।
HA + H2O ⇄ A–+ H3O++ द्रव्य अनुपाती क्रिया नियम के अनुसार,

जहाँ Kα अम्ल का आयनन स्थिरांक है जिसे अम्लीयता स्थिरांक कहते हैं। Kα का मान जितना अधिक होगा। अम्ल उतना प्रबल होगा।
क्षारक:
आर्टीनियस के अनुसार क्षारक वह पदार्थ है जो जल में विलेय होकर OH– आयन देता है।
KOH ⇄ K+ + OH–
ब्रॉन्स्टेड एवं लॉरी के अनुसार क्षारक वह पदार्थ है जो विलयन में किसी अन्य पदार्थ से प्रोटॉन ग्रहण करता है।
NH3 + H2O ⇄ NH4+ + OH–
लुईस परिकल्पना के अनुसार क्षारक वह पदार्थ है जो इलेक्ट्रॉन युग्म दान कर सकता है।
NH3 + BF3 → NH3 → BF3
लुईस क्षार
क्षार की प्रबलता:
किसी भी क्षार की प्रबलता उसके प्रोटॉन ग्रहण करने की प्रवृत्ति पर निर्भर करती है। क्षार की प्रबलता को आयनन स्थिरांक की सहायता से ज्ञात कर सकते हैं।
NH3 + H2O ⇄ NH4+ + OH–
द्रव्य अनुपाती क्रिया नियम के अनुसार,
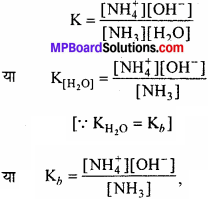
यहाँ पर Kb क्षार का आयनन स्थिरांक है जिसे क्षारीयता स्थिरांक कहते हैं। इसका मान जितना अधिक होगा क्षार उतना प्रबल क्षार होगा।
![]()
प्रश्न 8.
निम्नलिखित ऊष्माशोषी अभिक्रिया के अनुसार ऑक्सीकरण द्वारा डाइहाड्रोजन गैस प्राकृतिक गैस से प्राप्त की जाती है-
CH4(g) + H2O(g) ⇄ CO(g) + H2(g)
- उपरोक्त अभिक्रिया के लिए Kpका व्यंजक लिखिए।
- Kp एवं अभिक्रिया मिश्रण का साम्य पर संघटन किस प्रकार प्रभावित होगा, यदि –
- दाब बढ़ा दिया जाय
- ताप बढ़ा दिया जाय
- उत्प्रेरक प्रयुक्त किया जाए।
हल:
CH4(g) + H2O(g) ⇄ CO(g) + H2(g)
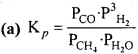
(b) 1. दाब में वृद्धि के कारण साम्य उस दिशा में अग्रसर होगा, जहाँ दाब में कमी होती है (अर्थात् गैसीय मोलों की संख्या कम हो)। यह प्रतीप अभिक्रिया है। दाब में परिवर्तन के फलस्वरूप Kp समान रहेगा।
2. चूँकि ∆H = धनात्मक (ऊष्माशोषी होती है) अतः अभिक्रिया ऊष्मा के अवशोषण द्वारा सम्पन्न होगी।
इसी कारण ताप में वृद्धि के कारण साम्य उस दिशा में विस्थापित होगा जिस ओर ऊष्मा अवशोषित होती हो (अर्थात् अग्र दिशा)। इसके कारण Kp के मान में वृद्धि होती है।
3. कोई प्रभाव नहीं पड़ता है क्योंकि उत्प्रेरक दोनों दिशाओं की दर पर समान प्रभाव डालता है।
प्रश्न 9.
ली-शातेलिये का नियम क्या है ? निम्न समीकरणों पर ताप, दाब एवं सान्द्रण बढ़ाने पर क्या प्रभाव पड़ेगा?
(a) N2 + 3H2 ⇄ 2NH3; ∆H = – 93.6KJ
(b) N2 + O2 ⇄ 2NO; ∆H = + 180.7KJ
उत्तर:
सन् 1885 में ली-शातेलिये ने उत्क्रमणीय अभिक्रिया के रासायनिक साम्य पर ताप, दाब व सान्द्रण के गुणात्मक प्रभाव को एक नियम के रूप में दर्शाया। इस नियम के अनुसार, “यदि किसी अभिक्रिया की साम्यावस्था पर स्थापित किसी निकाय के ताप, दाब व सान्द्रण में से कोई परिवर्तन किया जाये तो साम्य इस प्रकार से विस्थापित होगा जिससे परिवर्तन को उदासीन या प्रभावहीन किया जा सके।”
(a) N2 + 3H2 ⇄ 2NH3; ∆H = – 93.6KJ
दाब:
उपर्युक्त अभिक्रिया में यदि दाब बढ़ा दिया जाये तो अग्र अभिक्रिया की दर बढ़ जायेगी क्योंकि दाब बढ़ाने से आयतन में कमी आती है। अर्थात् अभिक्रिया के दौरान आयतन में कमी हो रही है। इसलिये ताप बढ़ाने से अभिक्रिया अग्र दिशा की ओर विस्थापित होगी जिससे NH3 के बनने की दर बढ़ जायेगी।
ताप:
NH3 का बनना एक ऊष्माक्षेपी अभिक्रिया है इसीलिये ताप बढ़ाने से अभिक्रिया प्रतीप दिशा में चलेगी जिससे NH3 के बनने की दर कम हो जायेगी। सान्द्रण – N2 या H2 के सान्द्रण में वृद्धि करने से अभिक्रिया अग्र दिशा की ओर चलेगी अर्थात् NH3 के बनने की दर बढ़ जायेगी क्योंकि। का मान स्थिर रहना चाहिये।
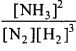
(b) N2 +O2 ⇄ 2NO; ∆H = + 180.7KJ
- सान्द्रण:
N2 या O2 का सान्द्रण बढ़ाने से साम्यावस्था अग्र दिशा की ओर विस्थापित होता है जिससे NO के बनने की दर बढ़ जाती है। - ताप:
NO का बनना एक ऊष्माशोषी प्रक्रम है इसलिये ताप में वृद्धि करने से साम्य दाँयी ओर विस्थापित होता है जिससे NO अधिक बढ़ेगा। - दाब:
इस अभिक्रिया के दौरान आयतन में कोई परिवर्तन नहीं हो रहा है इसलिये इस अभिक्रिया पर दाब का कोई प्रभाव नहीं पड़ेगा।
प्रश्न 10.
ली-शातेलिये नियम की सहायता से साम्यावस्था में 2SO2 + O2 ⇄ 2SO3; ∆H = -188.2 kJ अभिक्रिया द्वारा सल्फर ट्राइऑक्साइड के अधिक उत्पादन के लिये आवश्यक प्रतिबन्ध निकालिये।
उत्तर:
2SO2 + O2 ⇄ 2SO3; ∆H = -188.2kJ
सान्द्रण का प्रभाव:
उपर्युक्त अभिक्रिया में साम्यावस्था में अभिक्रिया मिश्रण में SO2 या O2 का सान्द्रण बढ़ाने पर ली-शातेलिये सिद्धान्त के अनुसार साम्यावस्था दाँयी ओर विस्थापित हो जायेगा। अर्थात् SO3 अधिक मात्रा में बनेगा।
ताप:
SO3का बनना एक ऊष्माक्षेपी अभिक्रिया है। ली-शातेलिये सिद्धान्त के अनुसार ताप में वृद्धि करने से अभिक्रिया उस दिशा में विस्थापित होती है जिस दिशा में अभिक्रिया ऊष्माशोषी हो इसलिये ताप में वृद्धि करने पर यह अभिक्रिया प्रतीप दिशा में विस्थापित होती है जिससे SO3के बनने की दर में कमी आती है।
दाब का प्रभाव:
SO3 के निर्माण में एक आयतन SO2 एक आयतन O2 के साथ संयोग कर 2 आयतन SO3 का निर्माण करता है अर्थात् SO3 के निर्माण के दौरान आयतन में कमी आती है। इस अभिक्रिया में दाब में वृद्धि करने पर अभिक्रिया अग्र दिशा की ओर विस्थापित होती है जिससे SO3 के बनने की दर बढ़ जाती है।
![]()
प्रश्न 11.
ली-शातेलिये सिद्धान्त के अनुसार निम्नलिखित भौतिक साम्यों पर निम्नलिखित प्रभाव समझाइये
(1) बर्फ के पिघलने पर ताप तथा दाब का प्रभाव
(2) जल के वाष्पीकरण पर ताप तथा दाब का प्रभाव
(3) जल की विलेयता पर ताप का प्रभाव।
उत्तर:
(1) बर्फ के पिघलने पर ताप तथा दाब का प्रभाव –
बर्फ ⇄ जल – Q cal
बर्फ का जल में परिवर्तन एक ऊष्माशोषी अभिक्रिया है तथा आयतन में कमी आती है। इसलिये ताप व दाब में वृद्धि करने पर साम्यावस्था अग्र दिशा की ओर विस्थापित होती है।
(2) जल के वाष्पीकरण पर ताप तथा दाब का प्रभाव –
जल ⇄ जलवाष्प – Qcal
जल के वाष्पीकरण के दौरान आयतन में वृद्धि होती है। इसलिये दाब में वृद्धि करने पर साम्यावस्था प्रतीप दिशा की ओर विस्थापित होती है। अर्थात् दाब में वृद्धि करने पर जल का वाष्पीकरण कम होता है तथा यह प्रक्रम ऊष्माशोषी प्रक्रम है। इसलिये ताप में वृद्धि करने पर साम्यावस्था अग्र दिशा की ओर विस्थापित होती है।
(3) जल में विलेयता पर ताप का प्रभाव –
NH4Cl, NaCl इत्यादि को जल में विलेय करने पर अभिक्रिया ऊष्माशोषी होती है। ऐसे लवणों की जल में विलेयता ताप में वृद्धि करने पर बढ़ती है। दूसरी तरफ CaCO3 तथा Cao की जल में विलेयता ऊष्माक्षेपी अभिक्रिया है। इसलिये इन यौगिकों की जल में विलेयता ताप में वृद्धि करने पर घटती है।
प्रश्न 12.
हाइड्रोजन आयोडाइड के विरचन (बनने) और वियोजन को उदाहरण के रूप में लेते हुए रासायनिक साम्य का वर्णन कीजिए।
हल:
720 K ताप पर एक बंद पात्र में H2 और I2 के बीच होने वाली अभिक्रिया को निम्न प्रकार से दर्शाया जाता है –
H2(g) + I2(g) → 2HI2(g) अभिकर्मकों H2 और I2 के प्रभावी टकराव से HI का विरचन होता है क्योंकि अभिक्रिया बंद पात्र में होती है इसलिए कोई अणु बाहर नहीं जाता और वे आपस में टकराते रहते हैं । अत: अभिक्रिया दोनों दिशाओं में संपन्न होती है और यह उत्क्रमणीय अभिक्रिया है।
अग्रगामी अभिक्रिया H2(g) + I2(g) → 2HI2(g)
प्रतीप अभिक्रिया 2HI2(g) → H2(g) + I2(g)
उत्क्रमणीय अभिक्रिया H2(g) + I2(g) ⇄ 2HI2(g)
प्रारंभ में अभिकारक की सान्द्रता अधिक होती है अतः अग्रगामी क्रिया की दर अधिक होगी। समय के साथ अग्रगामी क्रिया की दर घटती जाती है और प्रतीप दिशा में उत्पादों की सान्द्रता बढ़ती जाती है। परिणामस्वरूप प्रतीप दिशा में अभिक्रिया दर बढ़ती है। एक अवस्था में दोनों दिशाओं में अभिक्रिया दर समान हो जायेगी अर्थात् HI का वियोजन, HI के विरचन (बनने) के बराबर हो र जायेगा। यह अवस्था उत्क्रमणीय अभिक्रिया की साम्यावस्था कहलाती है।
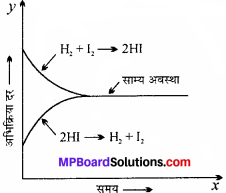
प्रश्न 13.
अम्लीय बफर विलयन की बफर क्रिया को समझाइये।
उत्तर:
अम्लीय बफर विलयन की बफर क्रिया:
CH3COONa प्रबल वैद्युत अपघट्य है इसलिये यह पूर्णतः आयनित होकर CH3COO–– आयन देता है। जबकि CH3COOH दुर्बल वैद्युत अपघट्य है, यह आंशिक रूप से आयनित होकर कम मात्रा में CH3COO– आयन देता है। C3COONa से प्राप्त एसीटेट आयन H+ आयन के साथ संयोग कर एसीटिक अम्ल बनाता है। CH3COONa सम आयन प्रभाव के कारण एसीटिक अम्ल के आयनन को कम कर देता है जिससे बहुत कम H+ बनते हैं इसलिये pH विलयन में कोई परिवर्तन नहीं होता।
CH3COOH ⇄ CH3COO– + H+
CH3COONa ⇄ CH COO– + Na+
CH3COO–+ H+ ⇄ CH3COOH
बफर विलयन में अम्ल की अल्प मात्रा मिलाने पर अम्ल से प्राप्त H आयन CH3COO– आयन से संयुक्त होकर CH3COOH बनाता है जो दुर्बल वैद्युत अपघट्य है जिसके कारण HCl जैसे प्रबल वैद्युत अपघट्य मिलाने पर भी विलयन के H* आयन सान्द्रण में वृद्धि नहीं हो पाती इसलिये pH में भी कोई परिवर्तन नहीं होता है।
HCl ⇄ H+ + Cl–
CH3COO– + H+ ⇄ CH3COOH बफर विलयन में क्षार मिलाने पर क्षार से प्राप्त OH– आयन H+ आयन के साथ संयोग कर जल बनाते हैं। इस परिस्थिति में साम्यावस्था बनाये रखने के लिये कुछ CH3COOH वियोजित होने लगते हैं। जिसके फलस्वरूप H+ आयनों के सान्द्रण में कोई परिवर्तन नहीं होता इस प्रकार विलयन का pH निश्चित रहता है।
NaOH ⇄ Na+ +OH–
OH+ + H– ⇄ H2O
प्रश्न 14.
क्षारीय बफर विलयन की बफर क्रिया को समझाइये। बफर क्रिया का महत्व समझाइये।
उत्तर:
NH4Cl प्रबल वैद्युत अपघट्य है इसलिये यह पूर्णतः आयनित होकर अधिक मात्रा में NH4+ आयन देता है। जबकि NH4OH दुर्बल वैद्युत अपघट्य है जो आंशिक रूप से आयनित होकर कम मात्रा में NH4+ आयन देता है। NH4Cl से प्राप्त NH4+आयन OH– आयन से संयोग कर NH4OH बनाते हैं। इस प्रकार NH4Cl सम आयन प्रभाव द्वारा NH4OH के वियोजन को कम कर देता है जिससे बहुत कम OH– आयन बनते हैं अतः pH मान में कोई परिवर्तन नहीं होता है।
NH4 OH ⇄ NH4+ + OH–
NH4Cl → NH4+ + Cl–
NH4+ + OH– ⇄ NH4OH
बफर विलयन में क्षार मिलाने पर क्षार से प्राप्त OH– आयन NH4+आयनों के साथ संयोग कर NH,OH बनाते हैं जो दुर्बल वैद्युत अपघट्य है जिसका आयनन बहुत कम होता है। इस प्रकार NaOH जैसे प्रबल वैद्युत अपघट्य मिलाने पर भी OH आयनों के सान्द्रण में वृद्धि नहीं हो पाती इसलिये pH स्थिर रहता है।
NaOH ⇄ Na+ + OH–
NH4+ + OH– ⇄ NH4OH
अम्ल मिलाने पर अम्ल से प्राप्त H+ आयन OH–आयनों के साथ संयोग कर HO– बनाते हैं। इस परिस्थिति में साम्यावस्था को बनाये रखने के लिये कुछ NH4OH वियोजित हो जाते हैं और इस प्रकार OH– आयनों के सान्द्रण स्थिर रहता है अतः pH मान स्थिर रहता है।
HCl ⇄ H++ Cl–
H+ + OH–→ H2O
बफर विलयन का महत्व:
- प्रयोगशाला में रासायनिक क्रियाओं के वेग के अध्ययन में pH मान स्थिर रखने के लिये बफर विलयन प्रयुक्त होता है।
- गुणात्मक विश्लेषण में-फॉस्फेट के निष्कर्षण में CH3COONa और CH3COOH का बफर विलयन प्रयुक्त होता है।
- उद्योग में – शक्कर और कागज का निर्माण तथा वैद्युत लेपन निश्चित pH पर होता है।
![]()
प्रश्न 15.
pH और pOH मान में संबंध स्थापित कीजिए। अथवा, सिद्ध कीजिये कि pH + pOH = 14.
उत्तर:
जल के स्वआयनन से,
H4O + H4O ⇄ H3O+ + OH–
द्रव्य अनुपाती क्रिया नियम के अनुसार,
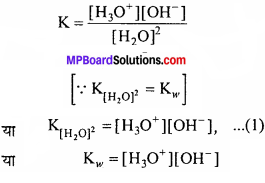
Kw, एक स्थिरांक है जिसे जल का आयनिक गुणनफल कहते हैं। 298K ताप पर Kw = 1 × 10-14
समीकरण (1) में मान रखने पर,
10-14 = [H3O+][OH–]
दोनों तरफ log10 लेने पर,
-14 log10 10 = log10 [H3O+ ] + log10[OH– ]
[∴ log10 10 = 1]
-14 = log10[H3O+] + log10[OH– ]
दोनों तरफ (-) का गुणा करने पर,
या 14 = [-log10[H3O+] + [-log10[OH–]
या 14 = pH + pOH [-log10[H3O+] = pH, – log10[OH– ] = pOH]
प्रश्न 16.
बफर विलयन के pH मान की गणना करने के लिये हेन्डर्सन समीकरण की व्युत्पत्ति कीजिए।
उत्तर:
किसी दुर्बल अम्ल HA और उसके आयनित होने वाले लवण NaA लेते हैं।

माना कि मिश्रण में अम्ल और लवण के आण्विक सान्द्रण क्रमशः C1 और C2 है। लवण के भी A– आयन की उपस्थिति के कारण विलयन में अम्ल का वियोजन कम हो जायेगा।
[HA] =C1
[A ] = C1
मान रखने पर,
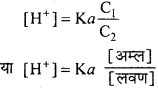
दोनों पक्षों का 10 आधार पर log लेने पर,

यह समीकरण हेन्डर्सन समीकरण कहलाता है।
![]()
प्रश्न 17.
द्रव्य अनुपाती क्रिया के नियम का प्रायोगिक सत्यापन हेतु एक प्रयोग का वर्णन कीजिए।
उत्तर:
काँच के कुछ बल्ब में H2 और I2 की भिन्न-भिन्न मात्राएँ लेकर उनके मुँह को बंद कर देते हैं । इन बल्बों को उबलती हुई गंधक की वाष्प में कुछ समय तक गर्म करते हैं जिससे साम्य शीघ्र ही स्थापित हो जाता है। इन बल्बों को फिर एकाएक कमरे के ताप पर ठण्डा करके साम्यावस्था स्थापित करते हैं। इन बल्बों के मुँह को NaOH के विलयन में खोलने पर NaOH विलयन प्रत्येक बल्ब की H व आयोडीन को सोख लेता है।
शेष बची हुई हाइड्रोजन का आयतन ज्ञात कर लेते हैं तथा साम्यावस्था पर HI व I2 का सान्द्रण भी प्राप्त कर लेते हैं इस प्रकार प्रत्येक बल्ब में H2, I2 व HI की मात्रा ज्ञात कर लेते हैं तथा इन मानों की सहायता से प्रत्येक बल्ब के लिये K के मान की गणना करते हैं। यदि सभी बल्ब में K का मान लगभग समान रहता है जिससे द्रव्य अनुपाती क्रिया नियम की पुष्टि होती है।

प्रश्न 18.
1127 K एवं 1 atm दाब पर CO तथा CO2 के गैसीय मिश्रण में साम्यावस्था पर ठोस कार्बन में 90.55% CO है।
C(s) + CO2(g) ⇄ 2CO(g)
उपरोक्त ताप पर अभिक्रिया के लिए K. के मान की गणना कीजिए।
हल:
अभिक्रिया C(s) + CO2(g) ⇄ 2CO(g)
यदि मिश्रण CO और CO2 का कुल द्रव्यमान 100g है तब
CO = 90.55 gm तथा CO2 = 100 – 90.55 = 9.45g
