In this article, we will share MP Board Class 12th Chemistry Solutions Chapter 3 वैद्युतरसायन Pdf, These solutions are solved subject experts from the latest edition books.
MP Board Class 12th Chemistry Solutions Chapter 3 वैद्युतरसायन
वैद्युतरसायन NCERT पाठ्यनिहित प्रश्नोत्तर
प्रश्न 1.
निकाय Mg2+|Mg का मानक इलेक्ट्रोड विभव आप कैसे ज्ञात करेंगे?
उत्तर-
Mg2+ |Mg इलेक्ट्रोड को मानक हाइड्रोजन इलेक्ट्रोड से जोड़कर E0Mg2+ /Mg का निर्धारण किया जा सकता है।
Mg(s)|Mg+2(1M)||H+(1M)|H2(1 atm)Pt
प्रश्न 2.
क्या आप एक जिंक के पात्र में कॉपर सल्फेट का विलयन रख सकते हैं ?
हल
जिंक का मानक अपचयन विभव ( \(\mathrm{E}_{\mathrm{Zn}^{2+} / \mathrm{Z} \mathrm{n}}^{\circ} \) = -0.76V), कॉपर के मानक अपचयन विभव ( \(\mathrm{E}_{\mathrm{Zn}^{2+} / \mathrm{Z} \mathrm{n}}^{\circ} \) = +0-34V) से कम है अतः जिंक कॉपर आयनों को अपचयित कर देगा। अत: हम कॉपर सल्फेट को जिंक के पात्र में नहीं रख सकते हैं।
Zn + Cu2+→ Zn2+ + Cu.
Ecell= Ecathode – Eanode = 0.034 – (-0.76) = +1.1 V.
प्रश्न 3.
मानक इलेक्ट्रोड विभव की तालिका का निरीक्षण कर तीन ऐसे पदार्थों के नाम बताइए जो अनुकूल परिस्थितियों में फेरस आयनों को ऑक्सीकृत कर सकते हैं ?
उत्तर
फेरस आयनों को केवल वे तत्व ऑक्सीकृत कर सकते हैं जिनके मानक अपचयन विभव \(\mathrm{E}_{\mathrm{Fe}^{2+} / \mathrm{Fe}}^{\circ}\) = 0.77 से ज्यादा धनात्मक होंगे, अत: F2, Cl2, B2 फेरस आयनों को ऑक्सीकृत कर सकते हैं।
प्रश्न 4.
pH = 10 के विलयन के सम्पर्क वाले हाइड्रोजन इलेक्ट्रोड के विभव का परिकलन कीजिए।
हल

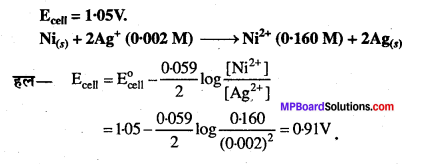
प्रश्न 5.
एक सेल के EMF का परिकलन कीजिए, जिसमें निम्नलिखित अभिक्रिया होती है। दिया गया है
Ecell = 1.05V.
Ni(s)h + 2Ag+(0.002 M) →Ni2+(0.160 M) + 2Ags
हल
प्रश्न 6.
एक सेल जिसमें निम्नलिखित अभिक्रिया होती है –
2Fe3+(aq) + 2I–(aq) →2Fe2+(aq)) + I2(s)
का 298 K ताप पर E0cell = 0.236V है। सेल अभि-क्रिया की मानक गिब्स ऊर्जा एवं साम्य स्थिरांक का परिकलन कीजिए।
हल
ΔG° =-nFE° = -2 × 96,500 × 0.236J
= -45548J = – 45.548kJ.
K = \(Antilog\left[\frac{n \mathrm{E}^{\circ}}{0.059}\right] \)
= \(Antilog \frac{2 \times 0.236}{0.059}=10^{8} \)
प्रश्न 7.
किसी विलयन की चालकता तनुता के साथ क्यों घटती है ? ‘
उत्तर
विलयन की तनुता बढ़ाने पर विलयन के इकाई आयन में उपस्थित आयनों की संख्या घटती है। अत: चालकता भी घटती है।
प्रश्न 8.
जल की \(\Lambda_{m}^{\mathbf{o}}\) ज्ञात करने का एक तरीका बताइये।
हल
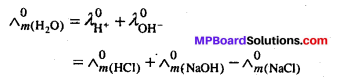
प्रश्न 9.
0.025 mol L-1 मेथेनोइक अम्ल की चालकता 46.1S cm mol-1 है। इसकी वियोजन मात्रा एवं वियोजन स्थिरांक का परिकलन कीजिए।
दिया गया है कि \(\lambda_{\left(\mathrm{H}^{*}\right)}^{\circ}\) = 349.6 S cm2 mol-1एवं \(\lambda_{\left(H \subset O O^{-}\right)}^{0}\) = 54.6 S cm2 mol-1.
हल

प्रश्न 10.
यदि एक धात्विक तार में 0-5 ऐम्पियर की धारा 2 घण्टों के लिए प्रवाहित होती है तो तार में से कितने इलेक्ट्रॉन प्रवाहित होंगे?
हल
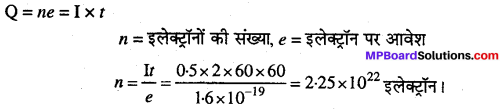
प्रश्न 11.
उन धातुओं की सूची बनाइए जिनका वैद्युत अपघटनी निष्कर्षण होता है।
उत्तर
Na, K, Mg, AI, Ca इत्यादि सक्रिय धातुओं का निष्कर्षण वैद्युत अपघटनी विधि से किया जाता है।
प्रश्न 12.
निम्नलिखित अभिक्रिया में Cr2O72- आयनों के एक मोल के अपचयन के लिए कूलॉम में विद्युत् की कितनी मात्रा की आवश्यकता होगी?
Cr2O72- +14H+ + 6e– → 2Cr+3 +8H2O.
उत्तर-
मोल Cr2O72- आयनों के अपचयन के लिए 6 मोल इलेक्ट्रॉन आवश्यक है। अतः आवश्यक आवेश = 6F
= 6 × 96,500 कूलॉम।
प्रश्न 13.
चार्जिंग के दौरान प्रयुक्त पदार्थों का विशेष उल्लेख करते हुए लेड संचायक सेल की चार्जिंग क्रियाविधि का वर्णन रासायनिक अभिक्रियाओं की सहायता से कीजिए।
उत्तर
व्यापारिक सेल या बैटरी में देखिए।
प्रश्न 14.
हाइड्रोजन को छोड़कर ईंधन सेलों में प्रयुक्त किये जा सकने वाले दो अन्य पदार्थों के नाम बताइए।
उत्तर
मेथेन एवं मेथेनॉल।
प्रश्न 15.
समझाइये कि कैसे लोहे पर जंग लगने का कारण एक वैद्युत रासायनिक सेल बनना माना जाता है ?
उत्तर
लोहे की सतह पर जल एवं CO2 से कार्बोनिक अम्ल बनना है –
H2O(l) + CO2(g) →H2CO3 ⇋ 2H+ + CO32-
H+ आयनों की उपस्थिति में लोहे का ऑक्सीकरण होता है।
Fe(s) → Fe2+(aq) +2e–
दूसरे भाग पर इन इलेक्ट्रॉनों का उपयोग अपचयन में होता है।
O2(g) + 4H+(aq) + 4e– →2H2O(l)
कुल अभिक्रिया,
2Fe(s) + O2(g) + 4H+(aq) ⇋ 2Fe+2(aq)+ 2H2O(l)
NCERT पाठ्य-पुस्तक प्रश्नोत्तर
प्रश्न 1.
निम्नलिखित धातुओं को उस क्रम में व्यवस्थित कीजिए जिसमें वे एक दूसरे को उनके लवणों के विलयनों में से प्रतिस्थापित करती हैं।
AI, Cu, Fe, Mg एवं Zn.
उत्तर
वह धातु जिसका मानक अपचयन विभव तुलनात्मक रूप से कम होगा वह ज्यादा सक्रिय होगी एवं अन्य को उसके विलयन से विस्थापित कर देगी।
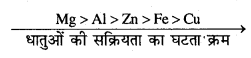
प्रश्न 2.
नीचे दिए गए मानक इलेक्ट्रोड विभवों के आधार पर धातुओं को उनकी बढ़ती हुई .. अपचायक क्षमता के क्रम में व्यवस्थित कीजिए –
K+/K = -2.93V, Ag+/Ag = 0.80V, Hg 2+/Hg = 0.79V, Mg2+/Mg =-2.37V, Cr3+/Cr = -0.74V.
उत्तर
जिस धातु का मानक इलेक्ट्रोड विभव कम होगा वे तुलनात्मक रूप से प्रबल अपचायक होंगे। अतः दी गई धातुओं की अपचायक क्षमता का बढ़ता क्रम
Ag < Hg < Cr < Mg <K
प्रश्न 3.
उस गैल्वेनीक सेल को दर्शाइए जिसमें निम्नलिखित अभिक्रिया होती है –
Zn(s)+2Ag+(aq) → Zn+2(aq) + 2Ag(s), अब बताइए –
(i) कौन-सा इलेक्ट्रोड ऋणात्मक आवेशित है ?
(ii) सेल में विद्युत्-धारा के वाहक कौन से हैं ?
(iii) प्रत्येक इलेक्ट्रोड पर होने वाली अभिक्रिया क्या है ?
उत्तर
Zn(s) | Zn2+(aq) || Ag+(aq) | Ag(s)
एनोड पर Zn → zn2++ 2e– (ऑक्सीकरण)
कैथोड पर Ag+ + e– →Ag (अपचयन)
(i) यहाँ Zn एनोड है जो कि ऋणात्मक इलेक्ट्रोड होगा।
(ii) सेल में इलेक्ट्रॉन, विद्युत्-धारा के वाहक हैं।
प्रश्न 4.
निम्नलिखित अभिक्रियाओं वाले गैल्वेनीक सेल का मानक सेल-विभव परिकलित कीजिए –
(i) 2Cr(s) + 3Cd+2(aq) → 2Cd+3(aq)+3Cd
(ii) Fe+2(aq) + Ag+(aq) → F+3(aq)+ Ago(s) उपरोक्त अभिक्रियाओं के लिए ΔrG° एवं साम्य स्थिरांकों की भी गणना कीजिए।
हल
(i) E°cell = E°cathode-E°anode
= -0.40- (-0.74) = + 0.34V
AG° = -nFE° = -6 × 96500 × 0.34
= -19686J = -196.86kJmol-1
ΔG° = -2.303 RT log K
– 19686 = -2.303 × 8.314 × 298 log K
या log K = 35.5014
या K = Antilog 35.5014 = 3.19 × 1034.
(ii) E°cell = E°Cathode– E°anode
= 0.80 – (0.77) = +0.03V
ΔG° = -nFE = -1 × 96500 × 0.03
= -2895Jmol-1
=-2.895 kJmol-1
∴ ΔG° = – 2.303 RT log K
– 2895 Jmol-1= – 2.303 × 8:314 × 298 log K
या log K = 0.5074
K = Antilog 0.5074 = 3.22.
प्रश्न 5.
निम्नलिखित सेलों की 298K पर ननस्ट समीकरण एवं emf लिखिए।
(i) Mg(s) | Mg 2+ (0.001M) || Cu 2+ (0.0001 M) |Cu (s)
(ii) Fe(s) | Fe2+ (0.001M)|| H+ (1M) |H2(g) (1bar)|Pt(s)
(iii) Sn(s)|Sn+2 (0.050 M) || H+ (0.020 M) |H2(g)) (1 bar) |Pt(s)
(iv) Pt(s) |Br2(l) | Br– (0-010 M) ||H+ (0.030 M) | H2(g) (1 bar) | Pt(s) .
हल-
(i)
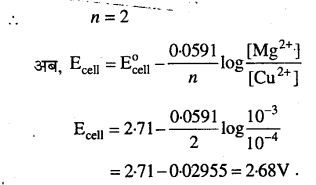
(ii)

(iii)

(iv)

प्रश्न 6.
घड़ियों एवं युक्तियों में अत्यधिक उपयोग में आने वाली बटन सेलों में निम्नलिखित अभिक्रिया होती है –
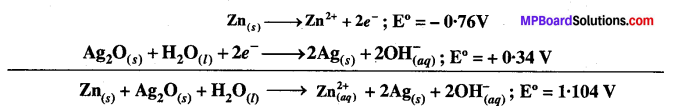
अभिक्रिया के लिए ΔrG° एवं E° ज्ञात कीजिए।
उत्तर
Zn(s)→zn2+ +2e– ; E° =-0.76V
Ag2O+H2O+2e– → 2Ag + 20H– ; E° = + 0.34 V
E°cell = E°cathode – E°anode
= 0.34 – (-0.76) = 1.10 v
ΔG° = -nFE°
=-2 × 96500 × 1.10 = – 2.123 × 105J.
प्रश्न 7.
किसी वैद्युत-अपघट्य के विलयन की चालकता एवं मोलर चालकता की परिभाषा दीजिए। सान्द्रता के साथ इनके परिवर्तन की विवेचना कीजिए।
उत्तर
मोलर चालकता (Molar conductance) – स्थिर ताप एवं मिश्चित सान्द्रण (या तनुता) पर किसी विलयन की मोलर चालकता, उस विलयन की चालकता होती है जिसमें पदार्थ का एक मोल उपस्थित होता है। इसे \(\wedge_{m}\) से प्रदर्शित किया जाता है –
या
“किसी विलयन की मोलर चालकता पदार्थ के एक ग्राम मोल को Vघन सेमी में विलेय करने से उत्पन्न हुए सभी आयनों की चालकता होती है।” तुल्यांकी चालकता के समान ही मोलर चालकता भी विलयन की विशिष्ट चालकता से संबंधित होती है।
सान्द्रता का प्रभाव-सान्द्रता या तनुता के साथ-साथ विलयन में आयनों की संख्या तथा आयनिक गतिशीलता में परिवर्तन होता है। अतः सान्द्रता से विलयन की चालकता में परिवर्तन होता है, इसी प्रकार सान्द्रता बढ़ाने या कम करने पर विलयन में आयनों की संख्या बढ़ती है। अर्थात् मोलर चालकता में वृद्धि होती है।
प्रश्न 8.
298K पर 0.20M KCI विलयन की चालकता 0.0248 S cm-1 है। इसकी मोलर चालकता का परिकलन कीजिए।
हल
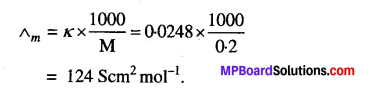
प्रश्न 9.
298K पर एक चालकता सेल जिसमें 0.001M KCl विलयन है, का प्रतिरोध 15000Ω है। यदि 0.001M KCI विलयन की चालकता 298K पर 0-146 x 10-3s cm-1 हो तो सेल स्थिरांक क्या है ?
हल
G* = \(\frac{\kappa}{G} \) =k × R = (0.146 × 10-3) × 1500
= 0.219cm-1 .
प्रश्न 10.
298K पर सोडियम क्लोराइड की विभिन्न सान्द्रताओं पर चालकता का मापन किया गया जिसके आँकड़े निम्नलिखित हैं –

सभी सान्द्रताओं के लिए \(\Lambda_{m} \) का परिकलन कीजिए एवं \(\Lambda_{m} \) तथा C1/2 के मध्य एक आरेख खींचिए। \(\Lambda_{m}^{\mathbf{o}} \) का मान ज्ञात कीजिए।
उत्तर
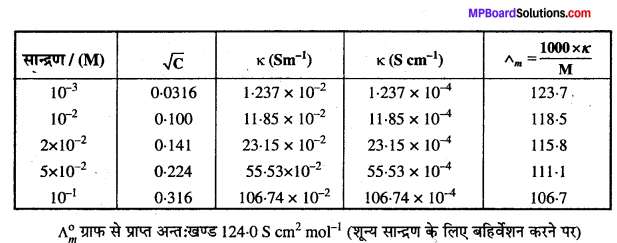
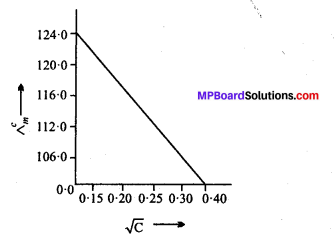
प्रश्न 11.
0.00241M ऐसीटिक अम्ल की चालकता 7.896 × 10-5 S cm-1 है। इसकी मोलर चालकता को परिकलित कीजिए। यदि ऐसीटिक अम्ल के लिए \(\Lambda_{m}^{\mathbf{o}} \) का मान 390.5S cm” mor’हो तो वियोजन स्थिरांक क्या है?
हल

प्रश्न 12.
निम्नलिखित के अपचयन के लिए कितने आवेश की आवश्यकता होगी?
(i) 1 मोल Al3+को Al में
(ii) 1 मोल Cu2+ को Cu में
(iii) 1 मोल MnO4– को Mn2+ में।
हल

प्रश्न 13.
निम्नलिखित को प्राप्त करने में कितने फैराडे विद्युत् की आवश्यकता होगी?
(i) गलित CaCl2 से 20.0 gm Ca
(ii) गलित Al2O3 से 40.0 gm Al.
हल
(i) Ca2+ + 2e– →Ca
1 मोल 2F
40 ग्राम 2F
∴ 20 ग्राम Ca2+ आयन के लिए 1F कूलॉम की आवश्यकता होगी।
(iii) Al3+ + 3e– →Al
∴ 27 ग्राम Al के लिए 3F की आवश्यकता होगी।
अत: 40g Al के लिए \(\frac{3 \times 40}{27} \) = 4.44F की आवश्यकता होगी।
प्रश्न 14.
निम्नलिखित को ऑक्सीकृत करने के लिए कितने कूलॉम विद्युत् आवश्यक है –
(i) 1 मोल H20 को O2 में,
(ii) 1 मोल Fe0 को Fe203 में।
हल
(i)
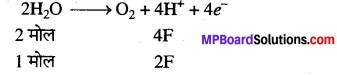
अतः 1 मोल जल को ऑक्सीकृत करने के लिए 2F = 2×96,500 कूलॉम की आवश्यकता होगी।
(ii)
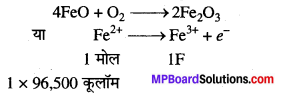
प्रश्न 15.
Ni(NO3)2 के एक विलयन का प्लैटिनम इलेक्ट्रोडों के बीच 5 ऐम्पियर की धारा प्रवाहित करते हुए 20 मिनट तक विद्युत्-अपघटन किया गया।Ni की कितनी मात्रा कैथोड पर निक्षेपित होगी?
हल
∵ \(\mathrm{W}=\frac{\mathrm{I} t \mathrm{E}}{96,500} \)
= \(\frac{5 \times 20 \times 60 \times 58.7112}{96,500} \) = 3.65ग्राम।
प्रश्न 16.
ZISO4, AgNO3 एवं Cuso, विलयन वाले तीन वैद्युत्-अपघटनी सेलों A, B, C के श्रेणीबद्ध किया गया एवं 1.5 ऐम्पियर की विद्युत् धारा, सेल B के कैथोड पर 1.45g सिल्वर निक्षेपित होने तक लगातार प्रवाहित की गई। विद्युत् धारा कितने समय तक प्रवाहित हुई ? निक्षेपित कॉपर एवं जिंक का द्रव्यमान क्या होगा?
हल
फैराडे के प्रथम नियम से \(\mathrm{W}=\frac{\mathrm{I} t \mathrm{E}}{96,500} \)
∴ 1-45 = \(\frac{1.5 \times t \times 108}{96,500} \)
या t= 863.7 sec = 14.4min.
फैराडे के द्वितीय नियम से,

प्रश्न 17.
सारणी 3.1 में दिए गए मानक इलेक्ट्रोड विभवों की सहायता से अनुमान लगाइए कि क्या निम्नलिखित अभिकर्मकों के बीच अभिक्रिया संभव है ?
(i) Fe3+(aq) और I–(aq)
(ii) Ag+(aq) और Cu (s)
(iii) Fe3+(aq) और Br– (aq)
(iv) Ags और Fe3+(aq)
(v) Br2(aq) और Fe2+(aq)
हल
नोट-सारणी के लिए NCERT पाठ्य-पुस्तक देखें।
यदि सेल का EMF धानत्मक हो तो अभिक्रिया संभव होगी।
कैथोड पर अपचयन एवं एनोड पर ऑक्सीकरण होता है।


प्रश्न 18.
निम्नलिखित में से प्रत्येक के लिए वैद्युत-अपघटन से प्राप्त उत्पाद बताइए।
(a) सिल्वर इलेक्ट्रोडों के साथ AgNO3 का जलीय विलयन
(b) प्लैटिनम इलेक्ट्रोडों के साथ AgNO3 का जलीय विलयन
(c) प्लैटिनम इलेक्ट्रोडों के साथ H2SO4 का तनु विलयन
(b) प्लैटिनम इलेक्ट्रोडों के साथ CuCl2 का जलीय विलयन।
हल
(a) Ag इलेक्ट्रोड के साथ AgNO3 के जलीय विलयन में Ag* का कैथोड पर अपचयन होगा क्योंकि \(\mathrm{B}_{\mathrm{A}_{8}}^{\circ}>\mathrm{E}_{\mathrm{H}, \mathrm{O}}^{\circ} \)
अतः कैथोड पर Ag+(aq) + e–→ Ag(s)
एनोड पर Ag(s) → Ag+(aq)taa) + e–
चूंकि Ag का एनोड NO3– आयनों से प्रभावित होता है एनोड पर Ag धुलकर Ag+ आयन बनायेगा। Ag(s) कैथोड पर जमा होगा।
(b) Pt इलेक्ट्रोड के साथ AgNO3 के जलीय विलयन में Pt के एनोड NO3– से क्रिया नहीं करेंगे।
कैथोड पर Ag+(aq) + e– →Ag(s) (Ag का जमाव होगा।)
एनोड पर OH– (aq)→ OH + e–
4OH → 2H2O(l) + O2 (O2 गैस मुक्त होगी।)
(c) Pt इलेक्ट्रोड के साथ H2SO4 के तनु विलयन में H2SO4 एवं H2O दोनों का निम्नानुसार आयनन होगा।
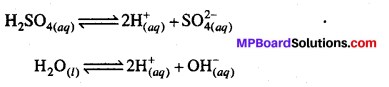
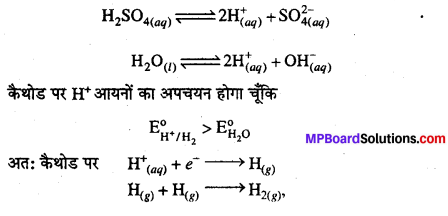

वैद्युतरसायन अन्य महत्वपूर्ण प्रश्नोत्तर
वैद्युतरसायन वस्तुनिष्ठ प्रश्न
1. सही विकल्प चुनकर लिखिए
प्रश्न 1.
यदि विशिष्ट चालकता = K; R = प्रतिरोध, L = इलेक्ट्रॉनों के बीच की दूरी, A = किसी इलेक्ट्रोड के अनुप्रस्थ काट का क्षेत्रफल हो Cm = mole L-1, Ceg = g eq L-1 हो तो किसी विद्युत्-अपघट्य का विशिष्ट प्रतिरोध बराबर होगा –
(a) \( \frac{\mathbf{1}}{R}\)
(b) \(\frac{\mathbf{A}}{l}\)
(c) \(\frac{1}{\mathrm{R}} \cdot \frac{l}{\mathrm{A}}\)
(d) \(\frac{1000 \mathrm{K}}{\mathrm{C}_{m}}\)
उत्तर
(b) \(\frac{\mathbf{A}}{l}\)
प्रश्न 2.
K बराबर है –
(a) \(\frac{\mathbf{A}}{T}\)
(b) \(\frac{1}{\mathrm{R}} \cdot \frac{\mathrm{A}}{l}\)
(c) \(\frac{1}{\mathrm{R}} \cdot \frac{l}{\mathrm{A}}\)
(c) \(\frac{\mathbf{l}}{A}\)
उत्तर
(c) \(\frac{1}{\mathrm{R}} \cdot \frac{l}{\mathrm{A}}\)
प्रश्न 3.
मोलर चालकता Am बराबर है –
(a) \(\frac{10000 K}{C_{e q}} \)
(b) \(\frac{K}{C_{e q}} \)
(c) \(\frac{\mathrm{K}}{\mathrm{C}_{m} \times 1000} \)
(d) \(\frac{1000 \mathrm{K}}{\mathrm{C}_{m}} \)
उत्तर
(d) \(\frac{1000 \mathrm{K}}{\mathrm{C}_{m}} \)
प्रश्न 4.
सेल-स्थिरांक है –
(a) \(\frac{\mathbf{A}}{l} \)
(b) \(\frac{\mathbf{l}}{A} \)
(c) lA
(d) e \(\frac{\mathbf{l}}{A} \)
उत्तर
(b) \(\frac{\mathbf{l}}{A} \)
प्रश्न 5.
1-1 विद्युत्-अपघट्य (V+ = V– = 1) जैसे NaCI के लिए –
(a) \(\wedge_{m}^{\infty}=\lambda_{e q}^{\infty} \)
(b) \(\wedge_{m}^{\infty}>\wedge_{e q}^{\infty} \)
(c) \(\wedge_{m}^{\infty}<\wedge_{e q}^{\infty} \)
(d) \(\wedge_{m}^{\infty}=2 \wedge_{e q}^{\infty} \)
उत्तर
(a) \(\wedge_{m}^{\infty}=\lambda_{e q}^{\infty} \)
प्रश्न 6.
इनमें से कौन विद्युत् का सुचालक नहीं है –
(a) NaCl(eq)
(b) NaCl(s)
(c) NaCl(mdxn)
(d) Ag.
उत्तर
(b) NaCl(s)
प्रश्न 7.
विलयन के प्रतिरोध को निम्नलिखित में किससे गुणा करने पर सेल-स्थिरांक प्राप्त होता है –
(a) विशिष्ट चालकता (K)
(b) मोलर चालकता ( \(\wedge_{m} \))
(c) तुल्यांक चालकता ( \(\wedge_{e q} \))
(d) इनमें से कोई नहीं।
उत्तर
(a) विशिष्ट चालकता (K)
प्रश्न 8.
एक विद्युत्-अपघट्य विलयन की तुल्यांकी चालकता में तनुकरणे द्वारा वृद्धि का कारण है –
(a) आयनिक आकर्षण में वृद्धि
(b) आण्विक आकर्षण में वृद्धि
(c) विद्युत्-अपघट्य के संगुणन की मात्रा में वृद्धि
(d) विद्युत्-अपघट्य के आयनन की मात्रा में वृद्धि।
उत्तर
(d) विद्युत्-अपघट्य के आयनन की मात्रा में वृद्धि।
प्रश्न 9.
यदि किसी विलयन की विशिष्ट चालकता तथा प्रेक्षित चालकता समान है, तो इसका सेल स्थिरांक होगा –
(a) 1
(b) 0
(c) 10
(d) 1000.
उत्तर
(a) 1
प्रश्न 10.
सेल-स्थिरांक की इकाई है –
(a) ohm-1cm-1
(b) cm
(c) ohm cm
(d) cm-1
उत्तर
(d) cm-1
प्रश्न 11.
विशिष्ट चालकता की इकाई है –
(a) ohm-1
(b) ohm-1 cm-1
(c) ohm-2cm1 equirulenr-1
(d) ohm-1cm-2.
उत्तर
(b) ohm-1 cm-1
प्रश्न 12.
यदि किसी विलयन की सान्द्रता cg equi/lion तथा विशिष्ट प्रतिरोध A हो, तो तुल्यांकी चालकता होगी –
(a) \(\frac{1000 \mathrm{A}}{\mathrm{C}} \)
(b) \(\frac{\mathrm{A} \times \mathrm{C}}{1000} \)
(c) \(\frac{1000}{\mathrm{A} \times \mathrm{C}} \)
(d) \(\frac{1000}{\mathrm{A} \times \mathrm{C}} \)
उत्तर
(a) \(\frac{1000 \mathrm{A}}{\mathrm{C}} \)
प्रश्न 13.
लोहे को संक्षारित होने से बचाने के लिए उस पर जिंक की परत चढ़ाना कहलाता है –
(a) गैल्वेनीकरण
(b) कैथोडिक रक्षण
(c) विद्युत्-अपघटन
(d) प्रकाश विद्युत्-अपघट्य।
उत्तर
(a) गैल्वेनीकरण
प्रश्न 14.
लवण-सेतु बनाने के लिए KNOJ के संतृप्त विलयन का उपयोग किया जाता है क्योंकि –
(a) K+ का वेग NO3– से ज्यादा होता है
(b) NO3– का वेग K+ से ज्यादा होता है
(c) दोनों का वेग लगभग बराबर होता है
(d) KNO3 की जल में विलेयता उच्च होती है।
उत्तर
(c) दोनों का वेग लगभग बराबर होता है
प्रश्न 15.
शुष्क सेलों में द्विध्रुवक का कार्य करता है –
(a) NH4 CI
(b) Na2 CO3
(c) PbSO4
(d) MnO2 .
उत्तर
(d) MnO2 .
प्रश्न 16.
अपचयन को कहते हैं –
(a) इलेक्ट्रॉनीकरण
(b) विइलेक्ट्रॉनीकरण
(c) प्रोटॉनीकरण
(d) विप्रोटॉनीकरण।
उत्तर
(a) इलेक्ट्रॉनीकरण
प्रश्न 17.
जब डेनियल सेल में Zn तथा Cu इलेक्ट्रोडों को जोड़ा जाता है तो विद्युत् धारा का मार्ग क्या होता है –
(a) सेल में Cu से Zn की ओर
(b) सेल के बाहर Cu से Zn की ओर
(c) सेल के अन्दर Zn से Cu की ओर
(d) सेल के बाहर Zn से Cu की ओर।
उत्तर
(d) सेल के बाहर Zn से Cu की ओर।
प्रश्न 18.
एक सेल जिसमें Zn इलेक्ट्रोड तथा नॉर्मल हाइड्रोजन इलेक्ट्रोड (NHE) हो, इसमें Zn इलेक्ट्रोड किसकी भाँति कार्य करते हैं –
(a) एनोड
(b) कैथोड
(c) न कैथोड, न एनोड
(d) दोनों एनोड व कैथोड।
उत्तर
(a) एनोड
प्रश्न 19.
यदि अर्द्ध-सेलों के बीच से लवण-सेतु हटा दिया जाए तो वोल्टेज –
(a) घटकर शून्य हो जाती है
(b) बढ़ जाती है
(c) शीघ्रता से बढ़ती है
(d) परिवर्तित नहीं होती है।
उत्तर
(a) घटकर शून्य हो जाती है
प्रश्न 20.
जब लेड स्टोरेज बैटरी को विसर्जित किया जाता है –
(a) SO2 उत्सर्जित होती है
(b) Pb का निर्माण होता है
(c) PbSo4 का व्यय होता है
(d) H2 SO4 का व्यय होता है।
उत्तर
(d) H2 SO4 का व्यय होता है।
प्रश्न 21.
लोहे में जंग लगने की क्रिया है –
(a) ऑक्सीकरण
(b) अपचयन
(c) संक्षारण
(d) बहुलीकरण।
उत्तर
(c) संक्षारण
प्रश्न 22.
हाइड्रोजन इलेक्ट्रोड के मानक विभव का मान होगा –
(a) धनात्मक
(b) ऋणात्मक
(c) शून्य
(d) कोई मान निश्चित नहीं।
उत्तर
(c) शून्य
2. रिक्त स्थानों की पूर्ति कीजिए
- एसीटिक अम्ल एक ……………….. विद्युत्-अपघट्य है।
- ताप बढ़ाने पर विद्युत्-अपघट्य की चालकता …….. जाती है।
- तनुता बढ़ाने पर विलयन की विशिष्ट चालकता का मान …………….. हो जाता है।
- आयन का आकार बड़ा होने से ……………….. घट जाती है।
- प्रतिरोधकता की इकाई ……………….. है।
- प्राथमिक सेल को पुनः ……………. नहीं किया जा सकता हैं।
- वह युक्ति जो रासायनिक ऊर्जा को विद्युत् ऊर्जा में परिवर्तित करती है, उसे ………सेल कहते हैं।
- विद्युत् धारा की वह मात्रा जो किसी पदार्थ का एक ग्राम तुल्यांक उत्पन्न करती है ……… कहलाती है।
- धात्विक चालन में ………. गुण अपरिवर्तित रहते हैं।
- प्रतिरोध का व्युत्क्रम …………….. कहलाता है।
- किसी चालक के एक घन सेमी की चालकता …….. ……… कहलाती है।
- एक फैराडे विद्युत् का मान ……….. कूलॉम होता है।
- लोहे पर जंग लगना एक ………….. का उदाहरण है।
- मानक हाइड्रोजन इलेक्ट्रोड का विभव ……….. माना गया है।
- लोहे पर जंग लगना ……….. का उदाहरण है।
उत्तर
- दुर्बल
- बढ़
- कम
- चालकता
- ओम सेमी
- आवेशित
- विद्युत् रासायनिक
- फैराडे
- रासायनिक
- चालकता
- विशिष्ट चालकता
- 96500 कूलॉम
- संक्षारण क्रिया
- 0-0 वोल्ट
- विद्युत् रासायनिक सेल।
3. उचित संबंध जोडिए –
I.

उत्तर
1. (d), 2. (a), 3. (b) 4. (e) 5. (c)
II.

उत्तर
1. (c), 2. (d), 3. (b), 4. (a), 5. (e), 6. (f).
4. एक शब्द/वाक्य में उत्तर दीजिए
- प्रबल विद्युत्-अपघट्य के दो उदाहरण दीजिए।
- दुर्बल विद्युत्-अपघट्य के दो उदाहरण दीजिए।
- विद्युत्-अपघटनी चालकता पर ताप का क्या प्रभाव पड़ता है ?
- कोलरॉश नियम का सूत्र लिखिए।
- तुल्यांकी चालकता का सूत्र लिखिए।
- आण्विक चालकता का सूत्र लिखिए।
- एक ऐसा उपकरण जिसमें विद्युत् ऊर्जा का रासायनिक ऊर्जा में परिवर्तन होता है, क्या कहते हैं ?
- सेल के दोनों इलेक्ट्रोडों के विभवान्तर जिसके कारण सेल में विद्युत् धारा बहती है, उसे क्या कहते हैं ?
- किसी धातु के इलेक्ट्रोड एवं उसके आयनों के मध्य सम्पन्न हुई रेडॉक्स अभिक्रिया के कारण उत्पन्न हुआ विभव क्या कहलाता है ?
- विभवांतर की इकाई क्या है ?
- सेल-स्थिरांक का सूत्र लिखिए।
- पुनः आवेशित करने योग्य सेल कहलाते हैं।
- तुल्यांकी चालकता की इकाई बताइए।
- जंग का रासायनिक सूत्र लिखिए।
- किसी सेल के विद्युत्-वाहक बल एवं साम्यावस्था स्थिरांक में संबंध लिखिए।
- वह अभिक्रिया क्या कहलाएँगी, जिसमें ऑक्सीकरण एवं अपचयन एक साथ होता है ?
उत्तर
- प्रबल विद्युत्-अपघट्य-HCl, NaOH, NaCl
- CH3COOH, H2CO3
- चालकता बढ़ जाती है
- कोलरॉश नियम \(\wedge_{m}^{\infty}=v_{+} \lambda_{+}^{\infty}+v_{-} \lambda_{-}^{\infty} \)
- तुल्यांक चालकता ( \(\wedge_{e q}) =\frac{1000 \times V_{1}}{C_{e q}} \) ohm-1cm2gmeq-1
- \(\wedge_{m}=\frac{1000 \mathrm{V}_{1}}{\mathrm{C}_{m}}\)ohm-1cm2mol-1
- विद्युत्-अपघटनी सेल,
- विद्युत् वाहक बल,
- इलेक्ट्रोड विभव,
- वोल्ट,
- सेल स्थिरांक = \(\frac{l}{\mathrm{A}} \)
- द्वितीयक सेल,
- ohm-1cm2gmeq-1
- Fe2O3.xH2O
- \(\log \mathrm{K}_{c}=\frac{\mathrm{mF}^{\circ} \mathrm{cell}}{0.0591}\) mFocell
- रेडॉक्स अभिक्रिया।
वैद्युतरसायन अति लघु उत्तरीय प्रश्न
प्रश्न 1.
विद्युत्-रासायनिक सेल की परिभाषा लिखिए।
उत्तर
ऐसा निकाय जिसमें ऑक्सीकरण-अपचयन अभिक्रिया द्वारा रासायनिक ऊर्जा को विद्युत् ऊर्जा में परिवर्तित किया जाता है। विद्युत्-रासायनिक सेल या वोल्टीय सेल कहलाता है।
प्रश्न 2.
विद्युत्-अपघट्य सेल किसे कहते हैं ?
उत्तर
वह पात्र या.निकाय जिसमें विद्युत् धारा प्रवाहित करने पर रासायनिक अभिक्रिया होती है अर्थात् विद्युत् ऊर्जा को रासायनिक ऊर्जा में परिवर्तित किया जाता है, उसे विद्युत्-अपघट्य सेल कहते हैं।
प्रश्न 3.
इलेक्ट्रोड विभव किसे कहते हैं ?
उत्तर
किसी वैद्युत रासायनिक सेल में इलेक्ट्रोड तथा वैद्युत अपघट्य के मध्य विभव के अंतर को इलेक्ट्रोर्ड विभव कहते हैं।
प्रश्न 4.
प्रबल विद्युत्-अपघट्य किसे कहते हैं ? दो उदाहरण लिखिए।
उत्तर
वे विद्युत्-अपघट्य जो जलीय विलयन में पूर्णत: आयनित हो जाते है। प्रबल विद्युत्-अपघट्य कहलाते हैं।
उदाहरण-NaCl, KCI, NH4Cl इत्यादि।
प्रश्न 5.
दुर्बल विद्युत्-अपघट्य किसे कहते हैं ? दो उदाहरण लिखिए।
उत्तर
वे विद्युत्-अपघट्य जिनका जलीय विलयन में बहुत कम आयनन होता है तथा अत्यधिक तनु करने पर भी पूर्ण आयनन नहीं होता, दुर्बल विद्युत्-अपघट्य कहलाते है।
उदाहरण-NH4OH, CH3COOH, HCN इत्यादि।
प्रश्न 6.
मानक इलेक्ट्रोड विभव से क्या अभिप्राय है ?
उत्तर
मानक इलेक्ट्रोड विभव-किसी अर्द्ध-सेल (इलेक्ट्रोड) का मानक इलेक्ट्रोड विभव (Eo), वह विभवान्तर है, जो किसी इलेक्ट्रोड को उसके अपने ही आयनों के एक मोलर सान्द्रता के विलयन में 298 K ताप पर डुबाने से उत्पन्न होता है।
यदि इलेक्ट्रोड गैसीय है, तो गैस का दाब एक वायुमण्डलीय होना चाहिए अर्थात् मानक ताप और मानक दाब में प्राप्त विभवान्तर मानक इलेक्ट्रोड विभव कहलाता है। IUPAC प्रणाली में अपचयन विभव को ही मानक इलेक्ट्रोड विभव माना जाता है।
प्रश्न 7.
ओम का नियम लिखिए।
उत्तर
इस नियम के अनुसार-किसी धातु चालक अथवा विलयन में बहने वाली विद्युत् धारा की प्रबलता चालक के सिरो या विलयन के डूबे हुये दोनों इलेक्ट्रोडों के मध्य लगाये गये विभवान्तर के समानुपाती होती है।
यदि इलेक्ट्रोडों के मध्य विभवान्तर V वोल्ट तथा विलयन में बहने वाली विद्युत् धारा की प्रबलता I हो, तो
V ∝ I
V=RI
जहाँ, R एक स्थिरांक है, जिसे चालक का प्रतिरोध कहा जाता है।
प्रश्न 8.
सेल-स्थिरांक किसे कहते हैं ?
उत्तर
किसी चालकता सेल के इलेक्ट्रोडों के बीच की दूरी । तथा किसी एक इलेक्ट्रोड के अनुप्रस्थ क्षेत्रफल का अनुपात एक स्थिरांक होता है, जिसे सेल-स्थिरांक कहते हैं तथा x से दर्शाते हैं।
x = \(\frac{l}{a} \)
सेल-स्थिरांक का मात्रक = cm-1.
प्रश्न 9.
गैल्वेनीकरण क्या है ? समझाइए।
उत्तर
लोहे पर जंग लगने की क्रिया को रोकने के लिए उस पर जिंक की तह लगायी जाती है। यह प्रक्रम गैल्वेनीकरण (Galvanizing) कहलाती है। गैल्वेनाइज्ड आयरन के जिंक फिल्म के ऊपर भास्मिक जिंक कार्बोनेट (ZnCO3) Zn(OH)2 की अदृश्य सतह होती है, जिसके कारण गैल्वेनाइज्ड आयरन की चमक कायम रहती है।
प्रश्न 10.
विद्युत्-रासायनिक तुल्यांक किसे कहते हैं ?
उत्तर
किसी पदार्थ का विद्युत्-रासायनिक तुल्यांक, किसी पदार्थ का वहे द्रव्यमान है, जो एक ऐम्पियर की विद्युत् धारा को एक सेकण्ड तक प्रवाहित करने पर इलेक्ट्रोड पर मुक्त या जमा होता है। लघु
वैद्युतरसायन लघु उत्तरीय प्रश्न
प्रश्न 1.
लवण-सेतु क्या है ? इसके दो कार्य लिखिए।
उत्तर
लवण-सेतु (Salt bridge)-KCI या KNO3 या Na2 SO4 तथा अगर–अगर (agar-agar) विलयन की जेली से भरी हुई यू-आकार की नली को लवण-सेतु कहते हैं।
कार्य – (1) इसके द्वारा दो विलयनों के मध्य विद्युत् सम्पर्क होता है तथा विद्युत् परिपथ पूर्ण होता है।
(2) इसके कारण दोनों विलयन आपस में नहीं मिलते।
(3) दोनों विलयनों की विद्युत् उदासीनता बनाये रखता है।
प्रश्न 2.
मानक विद्युत्-वाहक बल तथा साम्य स्थिरांक के संबंध दर्शाइये।
उत्तर
मानक मुक्त ऊर्जा परिवर्तन तथा साम्य स्थिरांक उसके अग्र और पश्च अभिक्रियाओं के वेग स्थिरांक का अनुपात होता है। इसे Kc से दर्शाते हैं।
A+B ⇌ C+D
\(\mathbf{K}_{C}=\frac{[\mathrm{C}][\mathrm{D}]}{[\mathrm{A}][\mathrm{B}]} \)
मानक मुक्त ऊर्जा की सहायता से हम किसी अभिक्रिया के लिये साम्य स्थिरांक की गणना कर सकते हैं।
ΔG° = -RTIn Kc
तथा -ΔG° = -nFE0cell
nFE0cell = RT In Kc
E0cell = \(\frac{2.303 \mathrm{RT}}{n \mathrm{F}} \) log10 Kc
प्रश्न 3.
ऑक्सीकरण-अपचयन अभिक्रिया से आप क्या समझते हैं ?
उत्तर
ऑक्सीकरण-अपचयन अभिक्रियाएँ-वह रासायनिक अभिक्रिया जिसमें तत्वों की संयोजकता परिवर्तित होती है, ऑक्सीकरण-अपचयन अभिक्रिया कहलाती है। इस क्रिया में ऑक्सीकरण और अपचयन दोनों प्रक्रियाएँ साथ-साथ होती हैं, जिसमें एक पदार्थ का ऑक्सीकरण और दूसरे पदार्थ का अपचयन होता है, जैसे –
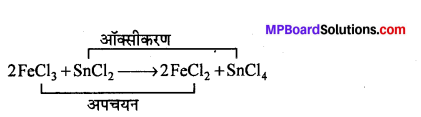
इस अभिक्रिया में FeCl3 का FeCl2 में अपचयन और SnCl2 का SnCl4 में ऑक्सीकरण होता है। अभिक्रिया में Fe की संयोजकता घटती है और Sn की संयोजकता बढ़ती है।
प्रश्न 4.
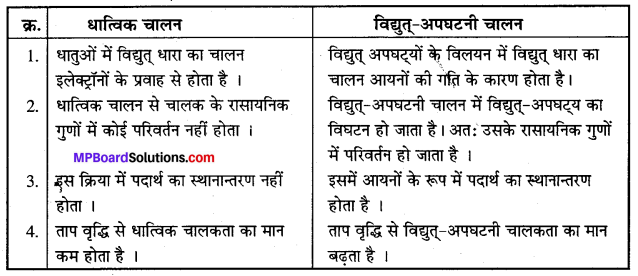
धात्विक चालन तथा विद्युत्-अपघटनी चालन में कोई चार अन्तर लिखिए ।
उत्तर
धात्विक चालन तथा विद्युत्-अपघटनी चालन में अन्तर-
प्रश्न 5.
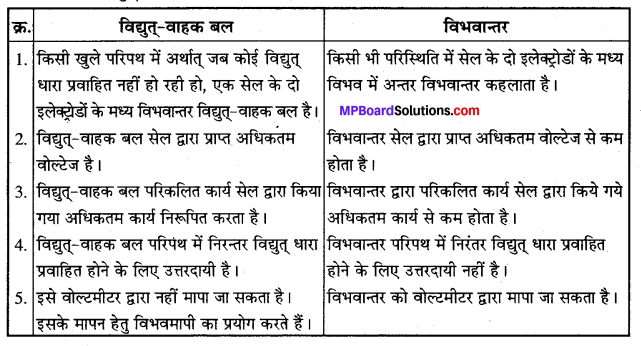
विद्युत्-वाहक बल तथा विभवान्तर में अन्तर लिखिए।
उत्तर
विद्युत्-वाहक बल और विभवान्तर में अन्तर –
प्रश्न 6.
विशिष्ट चालकता क्या है ? इसकी इकाई बताइए।
उत्तर
“किसी विद्युत्-अपघट्य (चालक) के एक घन सेमी विलयन की चालकता को विशिष्ट चालकता कहते हैं।”
इसे K (Kappa) द्वारा व्यक्त करते हैं।
यह विशिष्ट प्रतिरोध ρ (Rho) का व्युत्क्रम होता है।
अतः
k = \(\frac{1}{\rho} \), ( ∵ \( \rho=\frac{\mathrm{RA}}{l}\))
k = \(\frac{1}{R} \times \frac{l}{\mathrm{A}} \)
जहाँ, R= प्रतिरोध, A = इलेक्ट्रोडों का अनुप्रस्थ क्षेत्रफल व 1 = इलेक्ट्रोडों के बीच की लम्बाई है।
![]()
S.I. इकाई S cm-1 या Ohm-1 cm-1 है।
प्रश्न 7.
किसी विलयन की प्रतिरोधकता क्या है ?
उत्तर
प्रतिरोधकता (Resistivity) – किसी विलयन में दो इलेक्ट्रोड लगाकर विद्युत् धारा प्रवाहित करने पर प्रतिरोध, (धात्विक चालकों के समान ही) लम्बाई (इलेक्ट्रोडों के बीच की दूरी ।) के समानुपाती तथा अनुप्रस्थ काट के क्षेत्रफल (A) के व्युत्क्रमानुपाती होता है । अर्थात्
R ∝ \(\frac{l}{\mathrm{A}} \)
या R = ρ \(\frac{l}{\mathrm{A}} \)
या ρ = \(\frac{\mathrm{R} \times \mathrm{A}}{l}\)
स्थिरांक p(रो-Rho) को प्रतिरोधकता (Resistivity) कहा जाता है। (पूर्व में इसे विशिष्ट प्रतिरोध कहा जाता था ।)
प्रतिरोधकता (Resistivity) की इकाई –
यदि / को cm तथा A को cm2 में तथा R को ohm में दर्शाया जाए तो प्रतिरोधकता है ρ की इकाई \(\frac{\mathrm{cm}^{2} \mathrm{ohm}}{\mathrm{cm}} \) या ohm cm होगी ।
समी. (1) में A = 1 cm2 तथा l = 1 रखने पर,
ρ = R
अतः किसी विलयन की प्रतिरोधकता उसके 1 घन सेमी. (one cube cm) का प्रतिरोध है ।
प्रश्न 8.
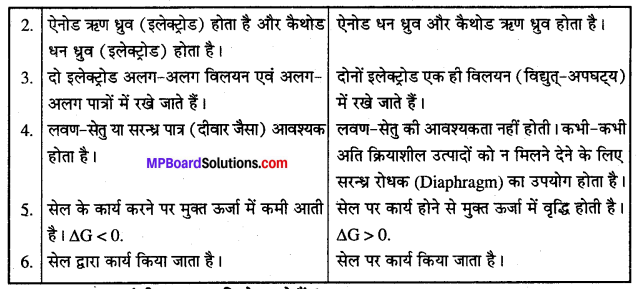
विद्यत-रासायनिक सेल तथा विद्युत्-अपघटनी सेल में अन्तर बताइए।
उत्तर
विद्युत्-रासायनिक सेल (गैल्वेनिक सेल) और विद्युत्-अपघटनी सेल में अन्तर –

प्रश्न 9.
तुल्यांकी चालकता किसे कहते हैं ?
उत्तर
तुल्यांकी चालकता-“किसी विलयन की तुल्यांकी चालकता उन समस्त आयनों की चालकता है, जो एक ग्राम तुल्यांक विद्युत्-अपघट्य को V ml में विलेय करने से उत्पन्न होती है।”
इसे \(\wedge_{e q}^{c} \) (लेम्ब्डा ) λ से प्रदर्शित करते हैं।
![]()
जहाँ, k = विशिष्ट चालकता है।
\(\wedge_{e q}^{c} \) = K × V
यदि C ग्राम तुल्यांक (Ceq) 1000 cm3 में विलेय है, तो 1 ग्राम तुल्यांक \(\frac{1000 \mathrm{cm}^{3}}{\mathrm{C}_{e q}} \) में विलेय होगा |

प्रश्न 10.
आण्विक चालकता किसे कहते हैं ?
उत्तर
आण्विक चालकता-“किसी विद्युत्-अपघट्य विलयन की आण्विक चालकता उन समस्त आयनों की चालकता है, जो एक ग्राम मोल विद्युत्-अपघट्य को Vml में विलेय करने से उत्पन्न होती है।” इसे ∧m से प्रदर्शित करते हैं । यह विलयन की विशिष्ट चालकता K व आयतन V के गुणनफल के बराबर होता है, जिसमें विलेय के 1 ग्राम-मोल उपस्थित हो।
अर्थात् ∧m = K x V
यदि M ग्राम-मोल 1000 cm3 में विलेय हो,

प्रश्न 11.
सेल-स्थिरांक किसे कहते हैं ? विशिष्ट चालकता वसेल-स्थिरांक के बीच क्या सम्बन्ध है?
उत्तर
सेल-स्थिरांक-किसी चालकता सेल के इलेक्ट्रोडों के बीच की दूरी (l) तथा किसी एक इलेक्ट्रोड के तल का क्षेत्रफल (A) निश्चित रहता है, अतः इनका अनुपात एक स्थिरांक होता है जिसे सेल स्थिरांक कहते हैं तथा x से दर्शाते हैं।
x = \(\frac{l}{a} \)
सेल-स्थिरांक का मात्रक = cm-1.
विशिष्ट चालकता व सेल-स्थिरांक में सम्बन्ध – किसी चालक पदार्थ के लिये प्रतिरोध R का मान, लम्बाई (l) के समानुपाती तथा अनुप्रस्थ परिच्छेद (A) के व्युत्क्रमानुपाती होता है।
R ∝ \(\frac{l}{a} \)
या \(\mathrm{R}=\rho \times \frac{l}{a} \)
या R = ρ × x,

प्रश्न 12.
विद्युत्-अपघट्य पदार्थ की विद्युतीय चालकता को प्रभावित करने वाले कारक कौनकौन से हैं ?
उत्तर
विद्युत्-अपघट्य पदार्थों की विद्युतीय चालकता को प्रभावित करने वाले कारक निम्नलिखित हैं
(1) अन्तर आयनिक आकर्षण (Inter ionic attraction)—यह विलेय-विलेय अन्योन्य क्रिया पर निर्भर होता है, जो विलेय के आयनों के मध्य उपस्थित होता है।
(2) आयनों का सॉल्वेशन (Solvation of ions)-यह भी विलेय-विलायक अन्योन्य क्रिया पर निर्भर करता है, जो विलेय के आयनों के मध्य उपस्थित होता है।
(3) विलायक की विस्कासिता (Viscosity of the solvent)–यह विलायक-विलायक अणुओं की अन्योन्य क्रिया पर निर्भर करता है, विलायक के अणु ही आपस में सम्बन्धित होते हैं।
ताप वृद्धि से ये तीनों प्रभाव कम हो जाते हैं। अतः विद्युत्-अपघट्य के आयनों की औसत गतिज ऊर्जा ताप वृद्धि के साथ बढ़ जाती है। अत: ताप वृद्धि से विद्युत्-अपघट्य के विलयन का प्रतिरोध कम हो जाता है अर्थात् चालकता बढ़ जाती है। इसके विपरीत धात्विक चालक का ताप बढ़ने से उसकी चालकता कम हो जाती
है।
प्रश्न 13.
किसी विद्युत्-अपघट्य के विलयन की विभिन्न चालकताएँ किन कारकों पर निर्भर करती हैं ?
उत्तर
विद्युत्-अपघट्य के विलयन की चालकताएँ निम्नलिखित कारकों पर निर्भर करती हैं
(1) तनुता- विलयन की तनुता बढ़ने पर विशिष्ट चालकता का मान कम होता है, तुल्यांकी चालकता और मोलर चालकता के मान बढ़ते हैं ।
(2) विलायक की प्रकृति-विलायक का डाइ-इलेक्ट्रिक स्थिरांक अधिक होने पर चालकता का मान अधिक तथा स्थिरांक कम होने पर चालकता का मान कम होता है ।
(3) विलयन में उपस्थित आयनों की संख्या-प्रबल विद्युत्-अपघट्यों की चालकता दुर्बल विद्युत्अपघट्यों की चालकता से अधिक होती है ।
(4) आयन का आमाप जलीय विलयन में छोटे आयन अधिक जलयोजित होने के कारण उनके आमाप में वृद्धि होती है, जिससे चालकता कम हो जाती है ।
(5) ताप का प्रभाव-ताप बढ़ने से चालकता में वृद्धि होती है ।
प्रश्न 14.
तनुता में वृद्धि के साथ-साथ विशिष्ट चालकता, तुल्यांकी चालकता तथा आण्विक चालकता के मान किस प्रकार परिवर्तित होते हैं ?
उत्तर
तनुता में वृद्धि से विशिष्ट चालकता का मान कम हो जाता है। इसका कारण यह है कि तनुता में वृद्धि से 1 घन सेमी विलयन में उपस्थित आयनों की संख्या कम हो जाती है।
किन्तु, तुल्यांक चालकता ∧eq = K x V
तथा मोलर चालकता ∧m = K x V.
तुल्यांक चालकता तथा मोलर चालकता, विशिष्ट चालकता तथा तनुता के गुणनफल हैं । तनुता वृद्धि (या सान्द्रण में कमी) से x का मान कम होता है, किन्तु V के मान में वृद्धि होती है।
K के मान की कमी की अपेक्षा V के मान में वृद्धि बहुत अधिक होती है। अतः दोनों का संयुक्त प्रभाव यह होता है कि तनुता वृद्धि से ∧eq और ∧m के मान बढ़ जाते हैं।
प्रश्न 15.
विद्युत्-अपघटनी सेल क्या है तथा किस प्रकार कार्य करता है ?
उत्तर
विद्युत्-अपघटनी सेल (Electrolytic Cells)- इन सेलों में विद्युत् धारा बाहरी स्रोत से भेजी जाती है, इसके फलस्वरूप सेल में अपघटन आदि रासायनिक अभिक्रियाएँ होती हैं, जिन्हें विद्युत्-अपघटन (Electrolysis) कहा जाता है। जैसे-जल, NaCl, AIO, इत्यादि का विद्युत्-अपघटन। उदाहरणार्थसॉल्वे ट्रफ सेल में सोडियम क्लोराइड विलयन में इलेक्ट्रोड लगाकर विद्युत् धारा प्रवाहित करने से NaCl
अपघटित हो जाता है। पारा (Mercury) के कैथोड पर सोडियम मुक्त होता है और ऐनोड पर क्लोरीन मुक्त होती है। पारा के साथ सोडियम, अमलगम बनाकर सेल से बाहर आता है।
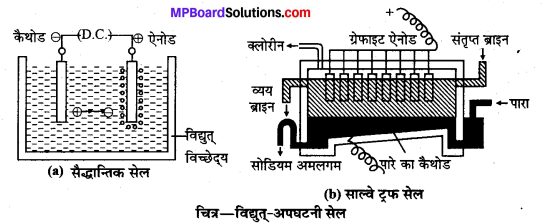
विद्युत्-अपघटन NaCl → Na+ + Cl –
कैथोड पर, Na+ + e –→ Na
Na + Hg → (Na-Hg) अमलगम
ऐनोड पर, Cl– + e – → Cl
Cl + Cl → Cl2
विद्युत्-अपघटनी सेल में विद्युत् बाहर से दी जाती है। अतः धन ध्रुव ऐनोड और ऋण ध्रुव कैथोड होता है।
प्रश्न 16.
किसी विद्युत्-रासायनिक सेल का विद्युत्-वाहक बल क्या है ?
उत्तर
“किसी विद्युत्-रासायनिक सेल के दोनों इलेक्ट्रोडों के इलेक्ट्रोड विभवों का अन्तर विद्युत्वाहक बल (Electromotive force) या सेल विभव (Cell potential) कहलाता है।” इसे वोल्ट (Volt) में दर्शाते हैं।
विभवान्तर के कारण निम्न अपचयन विभव वाले इलेक्ट्रोड से उच्च अपचयन विभव वाले इलेक्ट्रोड की ओर विद्युत् धारा बहती है। सेल के E.M.FE को अपचयन विभवों के अन्तर के रूप में निम्न प्रकार से दर्शाया जा सकता है –
सेल का सेल विभव = R.H.S. इलेक्ट्रोड का मानक अपचयन विभव
L.H.S. इलेक्ट्रोड का मानक अपचयन विभव
अर्थात् Ecell= Eredn(right) – Eredn (left)
Ecell= Eredn(cathode) – Eredn (anode)
सेल के दोनों इलेक्ट्रोडों के मध्य एक वोल्टमीटर जोड़कर सेल का E.M.F. मापते हैं। किसी सेल का E.M.E. दोनों इलेक्ट्रोडों की प्रकृति तथा दोनों अर्द्ध-सेलों के विलयनों के सान्द्रण पर निर्भर होता है। उदाहरणार्थडेनियल सेल के अर्द्ध-सेलों में CuSO4 एवं ZnSO4 विलयनों के सान्द्रण 1 M होते हैं तथा 298 K पर इस सेल का E.M.E 1.10 वोल्ट होता है।
वैद्युतरसायन दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
मानक हाइड्रोजन इलेक्ट्रोड क्या है ? यह कैसे बनाया जाता है ?
उत्तर
मानक हाइड्रोजन इलेक्ट्रोड-इसमें प्लैटिनम ब्लैक की परत चढ़ी हुई प्लैटिनम की एक पतली पत्ती का इलेक्ट्रोड हाइड्रोजन आयन (H+) के एक मोलर सान्द्रता के विलयन में डुबाकर रखा जाता है । यह काँच की एक नली से ढंका रहता है। नली में से एक वायुमण्डलीय दाब पर शुद्ध हाइड्रोजन गैस प्रवाहित की जाती है। जैसा कि चित्र में दिखाया गया है।
प्लैटिनम पर हाइड्रोजन गैस अवशोषित होती है तथा शीघ्र ही H2 तथा H2O+ आयनों के बीच साम्य स्थापित हो जाता है। परिस्थिति के अनुसार हाइड्रोजन इलेक्ट्रोड ऐनोड एवं कैथोड दोनों की भाँति कार्य करते हैं।
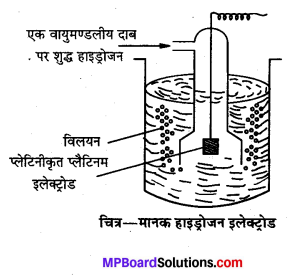
मानक हाइड्रोजन इलेक्ट्रोड (SHE) ऐनोड होने पर सेल अभिक्रिया –
H2 → 2H+ + 2e –
इस इलेक्ट्रोड को सेल में बायीं ओर निम्न प्रकार दर्शाया जाता है-
H2 (1atm)Pt |H+ (1.0M)
SHE कैथोड होने पर सेल अभिक्रिया –
2H + 2e– → H2
इसे सेल में दायीं ओर निम्न प्रकार दर्शाया जाता है
H+(1.0M)| H2(g)28) (1 atm)Pt
इस इलेक्ट्रोड का मानक इलेक्ट्रोड विभव स्वेच्छा से शून्य माना जाता है।
प्रश्न 2.
एकल इलेक्ट्रोड विभव के लिए नर्नस्ट समीकरण व्युत्पन्न कीजिए।
उत्तर
विद्युत्-रासायनिक श्रेणी में दिए गये मानक इलेक्ट्रोड विभव मानक अवस्था के लिए जब विद्युत् अपघट्य विलयन का सान्द्रण 1 M तथा ताप 298 K हो, परन्तु विद्युत्-रासायनिक सेलों में विद्युत्-अपघट्य विलयन का सान्द्रण हमेशा निश्चित नहीं होता तथा इलेक्ट्रोड विभव विद्युत्-अपघट्य को सान्द्रण तथा ताप पर निर्भर करता है। ऐसी स्थिति में एकल इलेक्ट्रोड विभव ननस्ट समीकरण द्वारा दर्शाया गया है। किसी अपचयन अर्द्ध-अभिक्रिया के लिए नर्नस्ट समीकरण को निम्न प्रकार से दर्शाया/प्रदर्शित करते हैं –

प्रश्न 3.
फैराडे के विद्युत्-अपघटन के नियम लिखिए।
उत्तर
सन् 1832 में माइकल फैराडे ने विद्युत्-अपघटन के दो नियम दिये –
(1) प्रथम नियम–“विद्युत्-अपघटन से किसी इलेक्ट्रोड पर मुक्त होने वाले पदार्थ की मात्रा प्रवाहित विद्युत् धारा की मात्रा के समानुपाती होती है।”
माना i ऐम्पियर की धारा : सेकण्ड तक प्रवाहित करने पर इलेक्ट्रोड पर W ग्राम पदार्थ मुक्त होता है, तो इस नियम से,
W ∝ Q
या . W ∝ i x j (∵ Q = it कूलॉम में विद्युत् की मात्रा)
या W = Zi.t
जहाँ z विद्युत्-रासायनिक तुल्यांक है।
(2) द्वितीय नियम-“जब श्रेणीक्रम में लगे हुए विभिन्न विद्युत-अपघट्यों के विलयनों से होकर विद्युत् की समान मात्रा प्रवाहित की जाती है, तो इलेक्ट्रोड पर एकत्रित विभिन्न पदार्थों की मात्राएँ उनके रासायनिक तुल्यांक के समानुपाती होती हैं।”
माना, श्रेणी क्रम में जुड़े हुए दो विद्युत्-अपघट्यों में विद्युत् की समान मात्रा प्रवाहित करने पर विक्षेपित पदार्थ की मात्राएँ क्रमशः W1 व W2 हैं तथा उनके रासायनिक तुल्यांक क्रमशः E1 व E2 हैं तो
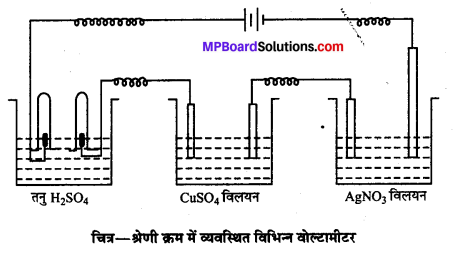
W ∝ E अथवा \(\frac{W}{E} \) = स्थिरांक
या W1 & E1 तथा W2 & E2
या \(\frac{\mathrm{w}_{1}}{\mathrm{w}_{2}}=\frac{\mathrm{E}_{1}}{\mathrm{E}_{2}} \)
प्रश्न 4.
संक्षारण किसे कहते हैं ? जंग लगने का विद्युत्-रासायनिक सिद्धान्त समझाइए।
उत्तर
वायुमण्डल में उपस्थित गैसों तथा नमी द्वारा धातुओं के धीमी गति से अवांछित यौगिकों में बदल जाने की प्रक्रिया संक्षारण कहलाती है। लोहे में जंग लगना इसका प्रमुख उदाहरण है।
जंग लगने का विद्युत्-रासायनिक सिद्धान्त-इस सिद्धान्त के अनुसार, अशुद्ध लोहे की सतह एक विद्युत्-रासायनिक सेल की भाँति व्यवहार करती है। ऐसे सेल को संक्षारण सेल भी कहते हैं। इन सेलों में शुद्ध लोहा ऐनोड तथा अशुद्ध लोहा कैथोड का कार्य करता है। नमी जिसमें O2 और CO2 विलेय है, विद्युत्-अपघट्य का कार्य करता है।
ऐनोड पर-Fe, Fe+2 आयनों के रूप में विलयन में चला जाता है।
कैथोड पर-Fe →Fe+2 + 2e–
ऑक्सीजन की उपस्थिति में ये इलेक्ट्रॉन जल के अणुओं द्वारा ले लिये जाते हैं तथा OF आयन बनाते हैं।
2H2+O2 +4e– →4OH–
ऐनोड पर बने Fe+2 आयन OH– आयनों से क्रिया करके Fe(OH)2, बनाते हैं। यह आयरन (II) हाइड्रॉक्साइड वायुमण्डल के ऑक्सीजन द्वारा नमी की उपस्थिति में हाइड्रेटेड आयरन (III) ऑक्साइड बनाता है।
2Fe(OH)2 + \(\frac{1}{2} \) O2(aq) + H2O(l) →Fe2O3. xH2O
यही हाइड्रेटेड फेरिक ऑक्साइड जंग है।
प्रश्न 5.
संक्षारण किसे कहते हैं ? इसे प्रभावित करने वाले तीन कारकों को लिखकर इससे बचाव के कोई तीन उपाय लिखिए।
उत्तर
संक्षारण – प्रश्न क्रमांक 4 देखिए।
संक्षारण को प्रभावित करने वाले कारक –
(1) धातु की प्रकृति-अधिक क्रियाशील धातु जल्दी संक्षारित होती है।
(2) धातु में अशुद्धियाँ-अशुद्ध धातु जल्दी और अधिक संक्षारित होती है।
(3) वातावरण-धातु के आस-पास के वातावरण में उपस्थित ऑक्सीजन, कार्बन डाइ-ऑक्साइड, नमी, खारापन या लवणों की उपस्थिति तथा SO2, SO3 आदि गैसें संक्षारण को बढ़ावा देते हैं।
संक्षारण से बचाव (Prevention)—संक्षारण को कई विधियों द्वारा रोका जाता है, जिनमें प्रमुख निम्नलिखित हैं
(i) रोधिका (Barrier) स्थापित करना-लोहे पर पेण्ट लगाकर या सतह पर ग्रीस या तेल की पतली पर्त लगाकर या टिन, निकिल, क्रोमियम, जिंक आदि की विद्युत् प्लेटिंग करके लोहे की सतह पर रोधिका बना देते हैं।
(ii) समर्पित बचाव (Sacrificial protection)—इस विधि में लोहे के ऊपर इससे अधिक क्रियाशील धातु की तह चढ़ा देते हैं, इससे लोहे पर कोई संक्षारण प्रभाव होने से पूर्व यह धातु नष्ट होती है और लोहे के पदार्थ बचे रहते हैं इसलिए इसे समर्पित बचाव कहते हैं। जैसे-गैल्वेनीकरण।
लोहे पर जिंक की पर्त चढ़ाना गैल्वेनीकरण कहलाता है। लोहे की सतह पर कोई खरोंच आने पर भी संक्षारण नहीं होता है, क्योंकि Zn और Fe दोनों में से Zn का ऑक्सीकरण पहले होता है।
प्रश्न 6.
सीसा-संचायक सेल की क्रिया को समझाइए।
उत्तर
सीसा-संचायक सेल-इस बैटरी का उपयोग मुख्य रूप से मोटर गाड़ियों में होता है। प्रत्येक बैटरी कई वोल्टीय सेलों को श्रेणी क्रम में जोड़कर बनी होती है। इस प्रकार के सेल से 2-0V की विद्युत् धारा प्राप्त होती है। 3 अथवा 6 ऐसे सेलों को आपस में जोड़ने पर 6 अथवा 12 वोल्ट की बैटरी प्राप्त होती है। प्रत्येक सेल में लेड (Pb) का एक ऐनोड होता है, जिसमें स्पंजी लेड भरा रहता है और कैथोड के रूप में Pb-Sb मिश्र धातु की जाली में PbO2का महीन चूर्ण भरा रहता है। H2SO4 का जलीय विलयन विद्युत्-अपघट्य का कार्य करता है, जिसमें 38 % H2SO4 तथा घनत्व 1.38 ग्राम/धन सेमी होता है। इस प्रकार सीसा संचायक सेल तैयार हो जाता है। जब सेल से विद्युत् धारा ली जा रही हो, तो सेल निम्न प्रकार से कार्य करता है, ऐनोड पर Pb का Pb2+ आयन में ऑक्सीकरण होता है, जो अविलेय PbSo4 में बदल जाता है तथा कैथोड पर PbO2 का Pb2+ में अपचयन होकर PbSO4 बनता है।
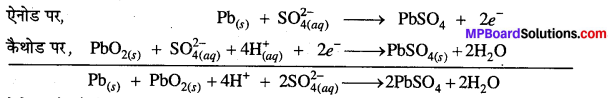
ऐनोड और कैथोड की अभिक्रियाओं से स्पष्ट है कि सेल के कार्य करने पर प्रत्येक इलेक्ट्रोड पर PbSO4(s) जमा होने लगता है, जिससे H2SO4 का सान्द्रण और घनत्व कम हो जाता है, अब बैटरी को पुनः आवेशित करके बार-बार उपयोग में लाया जा सकता है। बैटरी को पुनः आवेशित करने के लिए उपयुक्त वोल्टेज वाली विद्युत् धारा विपरीत दिशा में प्रवाहित की जाती है। जिससे इलेक्ट्रॉन प्रवाह के साथ-साथ इलेक्ट्रोड अभिक्रियाएँ भी विपरीत दिशा में होने लगती हैं अतः
ऐनोड पर Pb एवं कैथोड पर PbO2 जमा हो जाता है। H2SO4 के उत्पादन होने से उसका घनत्व बढ़ जाता है और यह क्रिया चलती रहती है।
रिचार्ज होते समय सेल में होने वाली रासायनिक अभिक्रियाएँऐ –

प्रश्न 7.
शुष्क सेल का सचित्र वर्णन कीजिए।
उत्तर
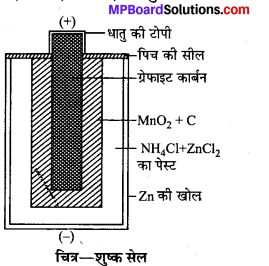
शुष्क सेल (Dry cell)-इनका उपयोग टॉर्च, टेपरिकॉर्डर, रेडियो, खिलौने, कैलकुलेटर आदि में होता है। ये लेकलांशी सेल के सिद्धान्त पर कार्य करते हैं। लेकलांशी सेल का आविष्कार जी. लेकलांशी (G. Lechlanche) द्वारा सन् 1868 में किया गया। शुष्क सेल में Zn का एक खोखला आवरण रहता है, जिसके ऊपर NH4Cl और कम मात्रा में ZnCl2 का जल में बना पेस्ट लगा रहता है। जिंक सिलिण्डर ऐनोड का कार्य करता है। कैथोड एक कार्बन की छड़ होती है। कार्बन की छड़ के चारों ओर MnO2 तथा कार्बन चूर्ण का काला पेस्ट भरा रहता है। जस्ते के खोखले आवरण के ऊपर मोटे कागज का आवरण लगा रहता है। लीक-प्रूफ शुष्क सेलों में Zn के आवरण के ऊपर आयरन या स्टील का आवरण लगा रहता है।
जब सेल कार्य करता है, तो Zn धातु इलेक्ट्रॉन खोकर Zn2+ आयनों के रूप में विद्युत्-अपघट्य NH4C1 में विलेय हो जाता है। इलेक्ट्रॉन बाह्य परिपथ में गमन करते हैं तथा कैथोड द्वारा ग्रहण कर लिये जाते हैं। इससे विद्युत्-अपघट्य से NH+4 आयमों का विसर्जन (discharge) होता है। इलेक्ट्रोड पर होने वाली अभिक्रियाएँ इस प्रकार हैं –
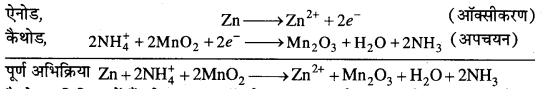
कैथोड अभिक्रिया में मैंगनीज का +4 ऑक्सीकरण अवस्था से +3 ऑक्सीकरण अवस्था में अपचयन हो जाता है। अमोनिया गैस के रूप में बाहर नहीं निकलती है, किन्तु ऐनोड में बने Zn2+ की कुछ मात्रा से संयुक्त होकर जटिल आयन बना लेती है, जिससे सेल के भीतर का दाब बढ़ नहीं पाता –
Zn+ +4NH3 >[Zn(NH3)4]2+
शुष्क सेल का वोल्टेज 1.25 V से 1.5 V के मध्य होता है।
दोष-NH4Cl की अम्लीय प्रकृति के कारण जिंक पात्र का संक्षारण होकर उसमें छिद्र हो जाते हैं । इन छिद्रों से अन्य रासायनिक यौगिक रिसकर बाहर आने लगते हैं। .
आजकल शुष्क सेलों को सुधारकर लीक रोधी बना दिया गया है। इसमें NHCl4 के स्थान पर KOH का उपयोग किया जाता है, जिससे जिंक का संक्षारण नहीं होता है।
प्रश्न 8.
कोलरॉश का नियम क्या है ? इसके दो अनुप्रयोग दीजिए।
उत्तर
कोलरॉश नियम-किसी विद्युत्-अपघट्य की अनन्त तनुता पर मोलर चालकता दो मानों का – योग है, जिसमें एक मान धनायन पर तथा दूसरा मान ऋणायन पर निर्भर करता है।
∧m ∞= V+λ+ ∞ + V–λ– ∞
जिसमें λ+ ∞ और λ– ∞ क्रमशः धनायन और ऋणायन की आयनिक चालकताएँ (Ionic conductances) तथा V+ और v– विद्युत्-अपघट्य की प्रति फॉर्मूला इकाई में धनायन और ऋणायन की संख्याएँ हैं।
“किसी विद्युत्-अपघट्य की अनन्त तनुता पर तुल्यांक चालकता उसकी आयनिक चालकताओं के योगफल के बराबर होती है।”
∧∞ = λ c ∞ + λd ∞
जहाँ, λ c ∞ और λd ∞ अनन्त तनुता पर धनायन एवं ऋणायन की आयनिक चालकताएँ हैं।
कोलरॉश के नियम का अनुप्रयोग – (i) दुर्बल विद्युत्-अपघट्यों की अनन्त तनुता पर तुल्यांक चालकता या आण्विक चालकता का निर्धारण-इस नियम के उपयोग से दुर्बल विद्युत्-अपघट्यों की तुल्यांक चालकता और आण्विक चालकता, प्रबल विद्युत्-अपघट्यों में धनायनों और ऋणायनों की चालकता के मानों का गणितीय समायोजन कर ज्ञात की जाती है । जैसे-CH3COOH की अनन्त तनुता पर आण्विक (या मोलर) चालकता की गणना –

प्रश्न 9.
विद्युत्-रासायनिक सेल एवं उसकी क्रिया-विधि डेनियल सेल का उदाहरण देकर समझाइए।
उत्तर
विद्युत्-रासायनिक सेल-रेडॉक्स अभिक्रियाओं में ऑक्सीकारकों और अपचायकों के मध्य इलेक्ट्रॉनों का स्थानान्तरण अप्रत्यक्ष रूप से, जैसे तार जोड़कर करने पर रासायनिक ऊर्जा का परिवर्तन विद्युत् ऊर्जा में होने लगता है। इस प्रकार की गई व्यवस्था विद्युत्-रासायनिक सेल कहलाती है। इसे गैल्वेनिक या वोल्टाइक सेल भी कहते हैं। इसकी क्रिया, विधि को डेनियल के उदाहरण से समझा जा सकता है।
‘डेनियल सेल-इस सेल में Zn धातु की छड़ ZnSO4 के विलयन में तथा Cu धातु की छड़ CuSO4 के विलयन में अलग-अलग पात्रों में डुबाकर रखी जाती है। दोनों विलयनों को KNO, लवण-सेतु द्वारा जोड़ दिया जाता है। Zn और Cu इलेक्ट्रोडों को किसी धातु के तार और गैल्वेनोमीटर सिरे से जोड़ने पर इलेक्ट्रॉनों का प्रवाह Zn से Cu की ओर बाह्य परिपथ में होने लगता है। Zn<sup>2+</sup> इलेक्ट्रोडों पर जिंक परमाणु Zn2+ आयन बनाकर विलयन में चले जाते हैं। यहाँ उपस्थित इलेक्ट्रॉन बाह्य परिपथ से Cu इलेक्ट्रोड पर पहुँचकर CuSO4 विलयन में उपस्थित Cu2+ आयनों को Cu धातु में बदल देते हैं, जो Cu इलेक्ट्रोड पर जमा होता जाता है। इस सेल में ऐनोड Zn इलेक्ट्रोड है, क्योंकि इसमें ऑक्सीकरण होता है –
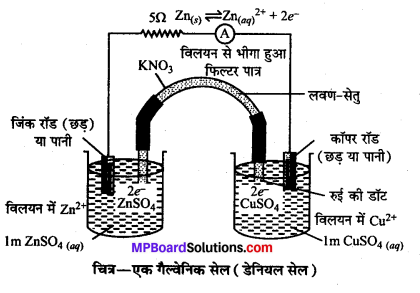
Zn(s) ⇌ Zn+2(aq) +2e –
इसमें Cu इलेक्ट्रोड कैथोड है, क्योंकि उस पर अपचयन होता है- .
Cu+2(aq) + 2e– ⇌ Cu(s)
सम्पूर्ण सेल अभिक्रिया निम्न प्रकार प्रदर्शित की जा सकती है –
Zn(s)+ Cu+2(aq) ⇌ Cu(s) +Zn+2(aq)
इस सेल में ऋण ध्रुव ऐनोड तथा धन ध्रुव कैथोड है, क्योंकि कैथोड पर दूसरे ध्रुव से इलेक्ट्रॉन आते हैं। · अतः डेनियल सेल को निम्न प्रकार प्रदर्शित कर सकते हैं
Zn(s)|(ZnSO4(aq)||CuSO–4(aq)||Cu(s)
वैद्युतरसायन संख्यात्मक प्रश्न
प्रश्न 1.
0.02molL-1KCI विलयन की 298 K पर विशिष्ट चालकता 2.48 x 10-2Ω-1cm-1 हो, तो मोलर चालकता की गणना कीजिए।
हल
K = 2.48 x 10-2ohm-1cm-1, C = 0.02molL-1
\(\wedge_{m}=\frac{1000 \kappa}{C_{m}} \)
= \(\frac{1000 \times 2 \cdot 48 \times 10^{-2}}{0 \cdot 02} \)
=124Scm2 mol-1
प्रश्न 2.
5 ऐम्पियर विद्युत् धारा 30 मिनट तक AgNO3 से भरे पात्र में प्रवाहित करने पर 10.07 ग्राम चाँदी जमा होती है, तो चाँदी का विद्युत्-रासायनिक तुल्यांक निकालिए। यदि हाइड्रोजन का विद्युत्-रासायनिक तुल्यांक 0-00001036 है, तो चाँदी का तुल्यांक भार निकालिए।
हल
फैराडे के प्रथम नियमानुसार W = ZIt
दिया गया है : W = 10.07 ग्राम, I = 5 ऐम्पियर, t= 30 x 60 सेकण्ड
10.07 =z x 5 x 30 x 60
या
\(\mathrm{Z}=\frac{10.07}{5 \times 30 \times 60} =0:001118 \)
तथा \(\frac{\mathrm{W}_{1}}{\mathrm{W}_{2}}=\frac{\varepsilon_{1}}{\varepsilon_{2}}=\frac{\mathrm{Z}_{1}}{\mathrm{Z}_{2}} \)

प्रश्न 3.
(a) दुर्बल विद्युत्-अपघट्य किसे कहते हैं ? एक उदाहरण दीजिए।
(b) LiBr के जलीय विलयन की अनंत तनुता पर मोलर चालकता ज्ञात कीजिए, जबकि Li+ आयन व Br– आयन की आयनिक चालकताएँ क्रमश: 38.7Scm2 mol-1 एवं 78.40S cm+ mol-1 है।
उत्तर
(a) दुर्बल विद्युत्-अपघट्य-वे विद्युत्-अपघट्य, जो विलयन में अल्प आयनित होते हैं, दुर्बल विद्युत्-अपघट्य कहलाते हैं। उदाहरण-CH3 COOH
(b)
∧∞LiBr = ∧∞Li+ + ∧∞Br–
दिया है- ∧∞Li+ = 38.7Scm2mol-1
∧∞Br– = 78.40S cm2mol-1
∧∞LiBr = 38.7 + 78.40
∧∞LiBr =117.10 Scm2 mol-1.
प्रश्न 4.
(a) प्रबल विद्युत्-अपघट्य किसे कहते हैं ?
(b) BaCl2 के जलीय विलयन की अनंत तनुता पर मोलर चालकता ज्ञात कीजिए, जबकि Ba+2 आयन व Cl– आयन की आयनिक चालकताएँ क्रमशः 127.30 Scm2 mol-1 एवं 76-34S cm2 mol-1है |
उत्तर
(a) प्रबल विद्युत्-अपघट्य-वे विद्युत्-अपघट्य जो विलयन में पूर्णतः आयनित होते हैं, .. प्रबल विद्युत्-अपघट्य कहलाते हैं । दिया है- .
उदाहरण-NaCl.
(b)
∧∞BaCl2 =∧∞ Ba2+ +2∧∞Cl–
दिया है – ∧∞ Ba2+ = 127-30 S cm2 mol-1
∧∞Cl– = 76.34 S cm2 mol-1
∴ ∧∞BaCl2 = 127:30 + 2(76-34)
=127.30 + 152.68 = 279.98 S cm2 mol-1.
प्रश्न 5.
यदि λ∞ (Al3+)= 189Ω-1cm2mor-1, λ∞(SO4-2) = 160-1cm2 mor-1 हो, तो Al2(SO4)3 की आण्विक चालकता की गणना कीजिए।
हल
Al2(SO4)3 के विलयन के आयनन से,
Al2(SO4)3 ⇌ 2Al3++3 So4-2
V+ = 2,V– =3
कोलरॉश नियम से, ∧m∞ = V+λ+∞ + V–λ+–
= 2 (189) + 3 (160)
= 378 + 480
= 858Ω-1cm2 mol-1
प्रश्न 6.
\(\frac{\mathbf{M}}{30}\) CH3 COOH की आण्विक चालकता 9.625 mho तथा अनन्त तनुता पर आण्विक . चालकता 385 mho है । M/30 CH3COOH के वियोजन की मात्रा की गणना कीजिए।
हल:

प्रश्न 7.
ऐसीटिक अम्ल के लिए ∧m∞ ज्ञात कीजिए।
दिया गया है-, ∧m∞(HCI) = 426Ω-1cm2 mol-1
∧m∞(NaCl) =126Ω-1cm2mol-1
∧m∞(CH3 COONa) = 91Ω-1cm2mol-1
हल : ऐसीटिक अम्ल दुर्बल विद्युत्-अपघट्य तथा HCI, NaCl और CH3 COONa प्रबल विद्युत्अपघट्य हैं । अतः कोलरॉश नियम से,
