Students get through the MP Board Class 11th Physics Important Questions Chapter 13 अणुगति सिद्धांत which are most likely to be asked in the exam.
MP Board Class 11th Physics Important Questions Chapter 13 अणुगति सिद्धांत
अति लघु उत्तरीय प्रश्न
प्रश्न 1.
बॉयल का नियम लिखिए।
उत्तर:
इस नियम के अनुसार, स्थिर ताप पर किसी गैस के निश्चित द्रव्यमान का आयतन उसके दाब के व्युत्क्रमानुपाती होता है।
यदि स्थिर ताप पर किसी गैस का आयतन V तथा दाब P हो, तो इस नियम के अनुसार,
V ∝ \(\frac{1}{\mathbf{p}}\)
या V = K.\(\frac{1}{\mathbf{p}}\)
या PV = K
जहाँ K एक नियतांक है।
प्रश्न 2.
बॉयल का नियम किन शर्तों पर लागू होता है ?
उत्तर:
निम्न दाब और उच्च ताप पर।
प्रश्न 3.
चार्ल्स का नियम लिखिए।
उत्तर:
इस नियम के अनुसार, स्थिर दाब पर किसी गैस के निश्चित द्रव्यमान के ताप को 1°C बढ़ाने पर उसका आयतन 0°C के आयतन का \(\frac{1}{273}\) वाँ भाग बढ़ जाता है।
मानलो स्थिर दाब पर किसी गैस के निश्चित द्रव्यमान का 0°C पर आयतन V0 तथा t°C पर V है। अतः इस नियम के अनुसार,
V = V0 + \(\frac{\mathrm{V}_{0}}{273}\) × t
या V = V0\(\left(1+\frac{1}{273} t\right)\)
प्रश्न 4.
चार्ल्स के नियम की सहायता से सिद्ध कीजिए कि -273°C पर गैस का आयतन शून्य हो जाता है।
उत्तर:
चार्ल्स के नियम के अनुसार,
V = V0\(\left(1+\frac{1}{273} t\right)\)
इस सूत्र में t = -273°C रखने पर,
V = V0\(\left(1-\frac{273}{273}\right)\) = V0(1 – 1) = 0
अत: -273°C पर किसी गैस का आयतन शून्य हो जाता है।
प्रश्न 5.
आदर्श गैस किसे कहते हैं ?
उत्तर:
जो गैस बॉयल तथा चार्ल्स के नियमों का पूर्णतः पालन करती है, उसे पूर्ण या आदर्श गैस कहते हैं।
व्यवहार में ऐसी कोई गैस नहीं है जो उक्त नियमों का पूर्णतः पालन करती हो। कठिनाईपूर्वक द्रवित होने वाली गैसें, जैसे-नाइट्रोजन, ऑक्सीजन, हाइड्रोजन इत्यादि काफी सीमा तक दोनों नियमों का पालन करती हैं।
अत: प्रयोगात्मक कार्यों के लिए इन्हें आदर्श गैस मान लिया जाता है।
प्रश्न 6.
गैसों के लिए ऐवोगेड्रो नियम क्या है ?
उत्तर:
इस नियम के अनुसार, दाब और ताप समान होने पर सभी गैसों के समान आयतन में अणुओं की संख्या समान होती है।
प्रश्न 7.
डॉल्टन के आंशिक दाब का नियम लिखिए।
उत्तर:
इस नियम के अनुसार, समान ताप पर परस्पर क्रिया न करने वाली गैसों के मिश्रण का दाब, उसकी अवयवी गैसों के दाब के योग के बराबर होता है।
![]()
प्रश्न 8.
ग्राह्य का विसरण नियम क्या है ?
उत्तर:
इस नियम के अनुसार, नियत दाब पर किसी गैस के विसरण की दर उसके घनत्व के वर्गमूल के व्युत्क्रमानुपाती होती है।
प्रश्न 9.
परम ताप क्या है ? क्या यह ऋणात्मक भी हो सकता है ?
उत्तर:
परम ताप पैमाने या केल्विन पैमाने पर मापे गये ताप को परम ताप कहते हैं।परम ताप कभी-भी ऋणात्मक नहीं हो सकता है।
प्रश्न 10.
परम शून्य क्या है ? क्या इससे भी नीचा ताप हो सकता है ?
उत्तर:
परम शून्य वह ताप होता है जिस पर किसी गैस का आयतन शून्य होता है। इसका वास्तविक मान -273.15°C होता है।
वास्तव में, गैसों का आयतन कभी-भी शून्य नहीं हो सकता, क्योंकि उनके अणुओं का कुछ-न-कुछ आयतन तो अवश्य होगा। किसी गैस का ताप -273°C से कम नहीं हो सकता, क्योंकि इससे कम ताप होने पर उसका आयतन ऋणात्मक होगा जो सम्भव नहीं है।
प्रश्न 11.
गैस को गर्म करने पर उसका ताप क्यों बढ़ जाता है ? अणुगति सिद्धान्त के आधार पर कारण लिखिए।
उत्तर:
गैस को गर्म करने पर उसके अणुओं की गतिज ऊर्जा बढ़ जाती है। अत: उसका ताप बढ़ जाता है (क्योंकि E ∝ T )।
प्रश्न 12.
बोल्ट्जमैन नियतांक क्या है ? इसका मान बताइए।
उत्तर:
सार्वत्रिक गैस नियतांक और ऐवोगेड्रो संख्या के अनुपात को बोल्ट्जमैन नियतांक कहते हैं।
बोल्ट्जमैन नियतांक, k = \(\frac{\mathrm{R}}{\mathrm{N}}\)
इसका मान 1.38 × 10-23 जूल/केल्विन है।
प्रश्न 13.
बोल्ट्जमैन नियतांक का महत्त्व क्या है ?
उत्तर:
हम जानते हैं कि गैसों के प्रति अणु की औसत गतिज ऊर्जा,
E = \(\frac { 3 }{ 2 }\)kT
गतिज ऊर्जा E गैस का एक सूक्ष्म गुण है जबकि ताप T उसके सम्पूर्ण आयतन का एक गुण है अर्थात् ताप एक स्थूल गुण है। इन दोनों गुणों को सम्बन्धित करने वाला नियतांक बोल्ट्जमैन नियतांक k है। यही k का महत्त्व है।
प्रश्न 14.
n मोल के लिए आदर्श गैस समीकरण लिखिए।
उत्तर:
PV = RT.
![]()
प्रश्न 15.
आदर्श गैस समीकरण PV = RT से R का विमीय सूत्र प्राप्त कीजिए।
उत्तर:
PV = RT से,
R = \(\frac{P V}{T}\)
∴ [R]= \(\left[\frac{\mathrm{ML}^{-1} \mathrm{~T}^{-2} \times \mathrm{L}^{3}}{\theta}\right]\) =[ML2T-2θ-1 ]
प्रश्न 16.
समान ताप Tव दाब P पर दो गैसें जिनमें से प्रत्येक का आयतन v है, मिलायी जाती हैं। यदि मिश्रण का ताप T व आयतन V हो, तो उसका दाब क्या होगा?
उत्तर:
डॉल्टन के आंशिक दाब के नियम से 2P होगा।
प्रश्न 17.
N.T.P. पर 1 सेमी3 H2 और 1 सेमी3 02 दी गई है। कारण सहित बताइए कि किसमें अणुओं की संख्या अधिक है।
उत्तर:
ऐवोगेड्रो के नियमानुसार, समान ताप व दाब पर गैसों के समान आयतन में अणुओं की संख्या समान होती है। अत: 1 सेमी हाइड्रोजन और 1 सेमी3 ऑक्सीजन में अणुओं की संख्या समान होगी।
प्रश्न 18.
छिद्र युक्त दीवारों से बने एक बर्तन में हाइड्रोजन और ऑक्सीजन की मात्राएँ बराबरबराबर भरी हुई हैं। बर्तन में कौन-सी गैस अधिक होगी?
उत्तर:
विसरण की दर ∝ \(\sqrt{\frac{1}{\rho}}\)
हाइड्रोजन का घनत्व ऑक्सीजन की तुलना में कम है। अतः हाइड्रोकार्बन गैस अधिक होगी।
लघु उत्तरीय प्रश्न
प्रश्न 1.
गैस समीकरण क्या है ? इसकी स्थापना कीजिए।
उत्तर:
किसी गैस के दाब P, आयतन V और परम ताप T में सम्बन्ध दर्शाने वाले समीकरण को गैस समीकरण कहते हैं। यह निम्नानुसार है-
PV = RT
जहाँ R एक सार्वत्रिक गैस नियतांक है।
स्थापना – मानलो परम ताप T पर किसी गैस के निश्चित द्रव्यमान का दाब P तथा आयतन V हैं। यदि ताप स्थिर हो तो बॉयल के नियम से,
V ∝ \(\frac{1}{\mathrm{P}}\) …(1)
किन्तु यदि दाब P स्थिर हो तो चार्ल्स के नियम से,
V ∝ T …(2)
समी. (1) और (2) से,
V ∝ \(\frac{\mathrm{T}}{\mathrm{P}}\)
या V= एक नियतांक × \(\frac{\mathrm{T}}{\mathrm{P}}\)
या \(\frac{\text { PV }}{T}\) = एक नियतांक
इस नियतांक को गैस नियतांक कहते हैं। किसी गैस के एक मोल के लिए इसे R से प्रदर्शित करते हैं।
∴ \(\frac{\text { PV }}{T}\) = R
या PV = RT.
प्रश्न 2.
गैसों के अणुगति सिद्धान्त के मुख्य अभिगृहीतों को लिखिए।
उत्तर:
गैसों के अणुगति सिद्धान्त के मुख्य अभिगृहीत निम्नलिखित हैं-
- प्रत्येक गैस छोटे-छोटे कणों से मिलकर बनी होती है, जिन्हें अणु कहते हैं।
- किसी गैस के अणु दृढ़, पूर्णतः प्रत्यास्थ (Perfectly elastic), गोलाकार व सभी प्रकार से एकसमान होते हैं।
- अणुओं का आकार अन्तराअणुक अन्तराल की तुलना में नगण्य होता है।
- ये अणु सभी सम्भव वेग से सभी सम्भव दिशाओं में अनियमित गति करते हैं।
- ये अणु बर्तन की दीवारों से टकराते रहते हैं किन्तु इन टक्करों से गैस का आयतन नहीं बदलता अर्थात् गैस के प्रति एकांक आयतन में अणुओं की संख्या स्थिर रहती है।
- दो अणुओं की टक्कर पूर्णत: प्रत्यास्थ होती है। टक्कर के समय उनके मध्य आकर्षण या प्रतिकर्षण बल नहीं लगता।
- दो अणुओं की टक्कर क्षणिक होती है अर्थात् टक्कर का समय उनके द्वारा स्वतंत्रतापूर्वक चलने में लिए गये समय की तुलना में नगण्य होता है।
- दो क्रमिक टक्करों के बीच अणु एकसमान वेग से सरल रेखा में गति करते हैं। दो क्रमिक टक्करों के बीच किसी अणु द्वारा तय की गयी दूरी को मुक्त पथ (Free path) कहते हैं। सभी अणुओं के मुक्त पथ के औसत को माध्य-मुक्त-पथ (Mean free path) कहते हैं।
प्रश्न 3.
गैस का दाब किस प्रकार उत्पन्न होता है ?
उत्तर:
जब किसी गैस को किसी बर्तन में बन्द कर दिया जाता है तो गैस के द्वारा बर्तन की दीवारों पर दाब डाला जाता है। वास्तव में, गैस के अणु अपनी अनियमित गति के दौरान बर्तन की दीवारों से टकराते रहते हैं। जब कोई अणु दीवार से टकराकर लौटता है तो उसका संवेग परिवर्तित हो जाता है। संवेग संरक्षण के नियमानुसार उतना ही संवेग दीवार से हस्तान्तरित हो जाता है। न्यूटन के गति के द्वितीय नियमानुसार, दीवार के संवेग में परिवर्तन की दर, दीवार पर लगने वाले बल के बराबर होती है। चूँकि दीवार पर असंख्य परमाणु टकराते रहते हैं। अत: दीवार पर एक स्थायी बल आरोपित होता रहता है । दीवार के प्रति एकांक क्षेत्रफल पर लगने वाला यह बल ही गैस का दाब होता है।
![]()
प्रश्न 4.
सिद्ध कीजिए कि P = \(\frac{1}{3} \rho \bar{c}^{2}\)
उत्तर:
गैसों के अणुगति सिद्धान्त से किसी गैस द्वारा आरोपित दाब,
P = \(\frac{m \mathrm{~N} \bar{c}^{2}}{3 \mathrm{~V}}\) ….(1)
जहाँ m = एक अणु का द्रव्यमान, N = V आयतन में उपस्थित अणुओं की संख्या तथा \(\bar{c}\) = वर्ग-माध्यमूल वेग।
अब गैस का द्रव्यमान = mN = M
∴ गैस का घनत्व ρ = \(\frac{\mathrm{M}}{\mathrm{V}}=\frac{m \mathrm{~N}}{\mathrm{~V}}\)
समी. (1) में मान रखने पर,
p = \(\frac{1}{3} \rho \bar{c}^{2}\) यही अभीष्ट व्यंजक है।
प्रश्न 5.
सिद्ध कीजिए कि गैस द्वारा बर्तन की दीवार पर लगाया गया दाब, प्रति एकांक आयतन की गतिज ऊर्जा \(\frac { 1 }{ 2 }\) का होता है।
अथवा
सिद्ध कीजिए कि P = \(\frac { 2 }{ 3 }\)E, जहाँ संकेतों के सामान्य अर्थ हैं।
उत्तर:
गैसों के अणुगति सिद्धान्त से गैस द्वारा आरोपित दाब,
p = \(\frac{m \mathrm{~N} \bar{c}^{2}}{3 \mathrm{~V}}\) …(1)
अब गैस का द्रव्यमान = mN
∴ गैस का घनत्व ρ = \(\frac{m N}{\mathrm{~V}}\)
समी. (1) में मान रखने पर,
p = \(\frac{1}{3} \rho \bar{c}^{2}\)
p = \(\frac{2}{3} \cdot \frac{1}{2}\)ρc-2
या p = \(\frac { 2 }{ 3 }\)E
जहाँ E = \(\frac{1}{2} \rho \bar{c}^{2}\) = प्रति एकांक आयतन की गतिज ऊर्जा।
यही सिद्ध करना था।
प्रश्न 6.
गैसों के अणुगति सिद्धान्त के आधार पर सिद्ध कीजिए कि गैस के अणुओं की माध्य गतिज ऊर्जा उसके परम ताप के अनुक्रमानुपाती होती है।
अथवा
सिद्ध कीजिए कि गैस के अणुओं की माध्य गतिज ऊर्जा
E = \(\frac { 3 }{ 2 }\)kT
उत्तर:
गैस के अणुगति सिद्धान्त से गैस द्वारा आरोपित दाब,
P = \(\frac{1}{3} \cdot \frac{m N}{V} \bar{c}^{2}\) …(1)
समी. (1) में यदि V एक मोल का आयतन हो तो N एक मोल में उपस्थित अणुओं की संख्या अर्थात् ऐवोगैड्रो संख्या होगी।
समी. (1) से,
PV = \(\frac{1}{3} m \mathrm{~N} \bar{c}^{-2}\)
परन्तु गैस समीकरण से,
PV = RT
∴ \(\frac{1}{3} m \mathrm{~N} \bar{c}^{-2}\) = RT
\(\frac{1}{2} m \bar{c}^{2}=\frac{3}{2} \frac{\mathrm{R}}{\mathrm{N}} \mathrm{T}\)
यहाँ \(\frac{1}{2} m \bar{c}^{-2}\) = E = गैस के अणुओं की माध्य गतिज ऊर्जा तथा \(\frac { R }{ N }\) = k = बोल्ट्जमैन नियतांक।
∴ E = \(\frac { 3 }{ 2 }\)kT …(2)
समी. (2) से स्पष्ट है कि
E ∝ T.
अत: गैस के अणुओं की माथ्य गतिज ऊर्जा उसके परम ताप के अनुक्रमानुपाती होती है।
प्रश्न 7.
गैसों के अणुगति सिद्धान्त के आधार पर परम शून्य की व्याख्या कीजिए।
उत्तर:
उपर्युक्त प्रश्न 6 की भांति सिद्ध कीजिए कि
E = \(\frac{3}{2}\)kT
यदि T= 0 हो, तो उपर्युक्त सूत्र से,
E = 0
अतः परम शून्य वह ताप है जिस पर अणुओं की माध्य गतिज ऊर्जा शून्य हो जाती है।
प्रश्न 8.
सिद्ध कीजिए कि गैस के अणुओं का वर्ग-माध्य-मूल वेग गैस के परम ताप के वर्गमूल के अनुक्रमानुपाती होता है।
अथवा
सिद्ध कीजिए कि \(\bar{c}=\sqrt{\frac{3 \mathbf{R} T}{\mathbf{M}}}\), जहाँ संकेतों के सामान्य अर्थ हैं।
उत्तर:
गैसों के अणुगति सिद्धान्त से गैस द्वारा आरोपित दाब,
P = \(\frac{1}{3} \cdot \frac{m \mathrm{~N}}{\mathrm{~V}} \vec{c}^{2}\) ….(1)
जहाँ m = एक अणु का द्रव्यमान, N = V आयतन में उपस्थित अणुओं की संख्या तथा \(\bar{c}\) = वर्गमाध्य-मूल वेग।
समी. (1) में यदि V एक मोल का आयतन हो, तो N उस आयतन में उपस्थित अणुओं की संख्या अर्थात् ऐवोगैड्रो संख्या होगी तथा mN ग्राम अणुभार होगा।
समी. (1) से,
PV = \(\frac{1}{3} m \mathrm{~N} \bar{c}^{-2}\)
परन्तु mN = M = ग्राम अणुभार।
∴ PV= \(\frac{1}{3} \mathrm{M} \bar{c}^{-2}\) …(2)
आदर्श गैस समीकरण से,
PV= RT …(3)
समी. (2) और (3) से,
\(\frac{1}{3} m \mathrm{~N} \bar{c}^{-2}\) = RT …(4)
या \(\bar{c}^{2}=\frac{3 \mathrm{RT}}{\mathrm{M}}\) …(5)
या \(\bar{c}=\sqrt{\frac{3 \mathrm{RT}}{\mathrm{M}}}\)
या \(\bar{c} \propto \sqrt{\mathrm{T}}\)
अतः अणुओं का वर्ग-माध्य-मूल वेग गैस के परम ताप के वर्गमूल के अनुक्रमानुपाती होता है।
प्रश्न 9.
एक बर्तन में गैस के n अणु हैं। यदि अणु संख्या आधी कर दी जाये तो गैस दाब पर क्या प्रभाव पड़ेगा ? गैस की कुल गतिज ऊर्जा तथा वर्ग-माध्य-मूल वेग पर क्या प्रभाव पड़ेगा?
उत्तर:
दाब P = \(\frac{m \mathrm{~N} \bar{c}^{2}}{3 \mathrm{~V}}\) से, P ∝ N
अतः अणुओं की संख्या आधी करने पर दाब आधी हो जायेगी।
यदि गैस की माध्य गतिज ऊर्जा E हो, तो n अणुओं की कुल गतिज ऊर्जा E1 = nE, स्पष्ट है कि अणुओं की संख्या आधी करने पर कुल गतिज ऊर्जा आधी हो जायेगी।
वर्ग-माध्य-मूल वेग, = \(\bar{c}=\sqrt{\frac{3 \mathrm{RT}}{\mathrm{M}}}\)
यह गैस के अणुओं की संख्या पर निर्भर नहीं करता। अतः अणुओं की संख्या आधी करने पर वर्गमाध्य-मूल वेग पर कोई प्रभाव नहीं पड़ेगा।
![]()
प्रश्न 10.
बॉयल का नियम क्या है ? अणुगति सिद्धान्त से इसे निगमित कीजिए।
उत्तर:
बॉयल का नियम – देखिए अति लघु उत्तरीय प्रश्न क्र. 1.
बॉयल के नियम का निगमन – गैसों के अणुगति सिद्धान्त के आधार पर गैस का दाब,
P = \(\frac{1}{3} \times \frac{m \mathrm{Nc}^{2}}{\mathrm{~V}}\)
या PV = \(\frac{1}{3} m \mathrm{~N} \bar{c}^{-2}\)
परन्तु mN = M = गैस का द्रव्यमान।
∴ PV = \(\frac{1}{3} \mathrm{M} \bar{c}^{2}\) …(1)
परन्तु \(\bar{c}^{2}\) ∝ T, अतः स्थिर ताप पर \(\bar{c}^{2}\) एक नियतांक होगा। M गैस का द्रव्यमान है, यह भी एक नियत राशि है।
इसी तरह \(\frac{1}{3} \mathrm{M} \bar{c}^{2}\) = एक नियतांक
अतः समी. (1) से, PV = एक नियतांक यही बॉयल का नियम है।
प्रश्न 11.
चार्ल्स का नियम क्या है ? अणुगति सिद्धान्त के आधार पर इसे निगमित कीजिए।
उत्तर-चार्ल्स का नियम-नियत दाब पर किसी गैस के निश्चित द्रव्यमान का आयतन उसके परम ताप के अनुक्रमानुपाती होता है, अर्थात् V ∝ T.
चार्ल्स के नियम का निगमन – गैसों के अणुगति सिद्धान्त से गैस का दाब,
p = \(\frac{1}{3} \cdot \frac{m N \bar{c}^{2}}{V}\)
या PV = \(\frac{1}{3} m \mathrm{~N} \bar{c}^{-2}\)
परन्तु mN = M = गैस का द्रव्यमान।
∴ PV = \(\frac{1}{3} \mathrm{M} \bar{c}^{-2}\) …(1)
गैस का द्रव्यमान M निश्चित रहता है अतः दाब P के स्थिर रहने पर समी. (1) से,
V ∝ \(\bar{c}^{2}\) …(2)
परन्तु, \(\bar{c}^{2}\) ∝ T …(3)
समी. (2) और (3) से,
V ∝ T यही चार्ल्स का नियम है।
प्रश्न 12.
अणुगति सिद्धान्त के आधार पर डॉल्टन के आंशिक दाब के नियम का निगमन कीजिए।
उत्तर:
मानलो V आयतन का एक बन्द बर्तन है। उसमें प्रथम गैस के N1 अणु हैं। प्रत्येक अणु का द्रव्यमान m1 है। अत: अणुगति सिद्धान्त से इस गैस का दाब,
P1 = \(\frac{1}{3} \cdot \frac{m_{1} N_{1} \bar{c}_{1}^{2}}{V}\) ….(1)
जहाँ \(\bar{c}_{1}\) इस गैस का वर्ग-माध्य-मूल वेग है।
इसी प्रकार द्वितीय गैस का दाब, P2 = \(\frac{1}{3} \cdot \frac{m_{2} \mathrm{~N}_{2} \bar{c}_{2}^{2}}{\mathrm{~V}}\) … (2)
तथा तृतीय गैस का दाब, P3 = \(\frac{1}{3} \cdot \frac{m_{3} \mathrm{~N}_{3} \bar{c}_{3}^{2}}{\mathrm{~V}}\) …(3)
इन गैसों को मिश्रित करने पर प्रत्येक गैस का आयतन V तथा मिश्रण का आयतन भी V होता है। किन्तु अब दाब N1 +N2 + N3 अणुओं के दाब के तुल्य होता है।
यदि सभी गैसें समान ताप पर मिश्रित की जाती हैं तो प्रत्येक प्रकार के अणु की माध्य गतिज ऊर्जा समान होगी, अर्थात्
\(\frac{1}{2} m_{1} \bar{c}_{1}^{2}=\frac{1}{2} m_{2} \bar{c}_{2}^{2}=\frac{1}{2} m_{3} \bar{c}_{3}^{2}\) =E (मानलो) …(4)
अत: समी. (1), (2), (3) व (4) से,
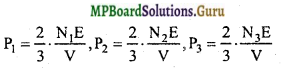
इस प्रकार मिश्रित गैस का दाब अर्थात् N अणुओं का दाब,
P = \(\frac{2}{3} \cdot \frac{\mathrm{NE}}{\mathrm{V}}\)
जहाँ N = N1 + N2 + N3
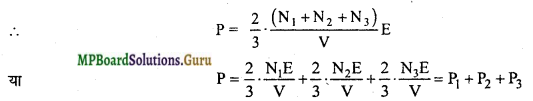
इसी प्रकार सिद्ध किया जा सकता है कि
P = P1 + P2 + P3 + P4+…….. अत: समान ताप पर पारस्परिक क्रिया न करने वाली गैसों को मिश्रित करने पर मिश्रण का दाब उसके अवयवी गैसों के दाब के योग के तुल्य होता है।
यही डॉल्टन का आंशिक दाब का नियम है।
प्रश्न 13.
एक बर्तन में दो विभिन्न गैसों का मिश्रण भरा हुआ है। कारण सहित बताइये कि-
(i) क्या दोनों गैसों की प्रति अणु औसत गतिज ऊर्जाएँ समान हैं ?
(ii) क्या अणुओं के वर्ग-माध्य-मूल वेग समान हैं ?
(iii) क्या दाब समान होंगे?
उत्तर:
(i) हाँ, क्योंकि प्रति अणु औसत गतिज ऊर्जा E = \(\frac{3}{2}\)kT ऊर्जा ताप T पर निर्भर करती है।
(ii) नहीं, क्योंकि \(\bar{c}=\sqrt{\frac{3 R T}{M}},\) \(\bar{c}\)
अणुभार M व ताप T पर निर्भर करता है।
(iii) दाब के बारे में कुछ नहीं कहा जा सकता क्योंकि गैसों के द्रव्यमान का उल्लेख नहीं है।
प्रश्न 14.
ऊर्जा के समविभाजन का नियम लिखिए।
उत्तर:
इस नियम के अनुसार, किसी निकाय के तापीय संतुलन की स्थिति में, ऊर्जा समान रूप से सभी संभव ऊर्जा रूपों में विभाजित होती है, अर्थात् प्रत्येक स्थानांतरीय एवं घूर्णी स्वातंत्रय कोटि से संबंधित ऊर्जा का मान \(\frac{1}{2}\)kT होता है।
प्रश्न 15.
स्वतंत्रता की कोटियाँ किसे कहते हैं ? समझाइए।
उत्तर:
किसी गतिक निकाय की स्थिति एवं उसके कणों के अभिविन्यास को पूर्ण रूप से प्रदर्शित करने के लिए आवश्यक निर्देशांकों की कुल संख्या को स्वतंत्रता की कोटि (Degrees of freedom) कहते हैं। यदि कोई कण एक सीधी रेखा में गति कर रहा है, तो इस कण की स्वतंत्रता की कोटि एक होगी। यदि कण किसी समतल में गतिशील है, तो स्वतंत्रता की कोटि दो होगी।
माना कोई निकाय N कणों से मिलकर बना है, इस निकाय के लिए स्वतंत्रता की कोटियाँ निम्न होगी-
f = 3N – K
जहाँ ‘K’ निकाय के कणों के मध्य स्वतंत्र संबंधों की संख्या है।
द्विपरमाणुक गैस के लिए N = 2, K = 1
अतः f = 3 × 2 – 1 = 5.
![]()
प्रश्न 16.
एकपरमाणुक गैस के लिए गैसों की विशिष्ट ऊष्माओं का अनुपात ज्ञात कीजिए।
उत्तर:
चूँकि हम जानते हैं कि एकपरमाणुक गैस जैसे- He, Ar आदि की स्वतंत्रता की कोटि 3 होती है किन्तु ऊर्जा के समविभाजन नियम के अनुसार प्रत्येक स्वतंत्रता की कोटि से संबद्ध
ऊर्जा = 3 × \(\frac{1}{2}\)kT= \(\frac{3}{2}\)kT
गैस के 1 मोल से संबद्ध कुल ऊर्जा
U = n\(\frac{3}{2}\)kT
जहाँ n, गैस के 1 मोल में अणुओं की संख्या है। …(1)
किन्तु बोल्ट्जमैन नियतांक k = \(\frac{R}{n}\) जहाँ पर R गैस नियतांक है।
nk = R
अतः समी. (1) में nk = R रखने पर,
U = \(\frac{3}{2}\)RT
किन्तु 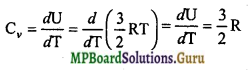
किन्तु मेयर के सूत्र से,
Cp – Cν = R
या Cp = R+Cν
लेकिन Cν\(\frac{3}{2}\)R
Cp = R + \(\frac{3}{2}\)R = \(\frac{5}{2}\)R
चूँकि हम जानते हैं कि गैस की विशिष्ट ऊष्माओं का अनुपात

अतः ν =\(\frac{5}{3}\)= 1.67.
प्रश्न 17.
द्विपरमाणुक गैसों की विशिष्ट ऊष्माओं का अनुपात ज्ञात कीजिए।
उत्तर:
हल – द्विपरमाणुक गैसें जैसे – हाइड्रोजन, ऑक्सीजन इत्यादि की स्वतंत्रता की कोटि 5 होती है। ऊर्जा के समविभाजन नियम के अनुसार प्रत्येक कोटि से सम्बद्ध ऊर्जा \(\frac{1}{2}\) kT होती है।
अत: एक अणु से सम्बद्ध ऊर्जा U = \(\frac{5}{2}\)nkT
किन्तु nk = R
∴ U = \(\frac{5}{2}\)RT

या γ = 1.40
प्रश्न 18.
त्रि-परमाणुक गैस की विशिष्ट ऊष्माओं का अनुपात ज्ञात कीजिए।
उत्तर:
त्रि-परमाणुक गैस जैसे – CO2 H2S इत्यादि की स्वतंत्रता की कोटियाँ 6 होती हैं। तब गैस के मोल से सम्बद्ध कुल ऊर्जा
U = \(\frac{6}{2}\) ηkT
या = \(\frac{6}{2}\) RT
चूँकि Cν= \(\frac{d U}{d \pi}=\frac{d}{d T}\left(\frac{6}{2} R T\right)\) = 3R
CP = Cν + R
CP = 3R + R = 4R
∴ γ = \(\frac{C_{p}}{C_{v}}=\frac{4 R}{3 R}\)
या γ = \(\frac{4}{3}\) = 1.33
दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
अणुगति सिद्धान्त के आधार पर आदर्श गैस के लिए दाब का व्यंजक ज्ञात कीजिए।
उत्तर:
मानलो एक घनाकार खोखला बर्तन है जिसकी प्रत्येक कोर की लम्बाई l है । इस बर्तन में एक आदर्श गैस भरी है जिसके प्रत्येक अणु का द्रव्यमान m है।
मानलो कोई अणु PK दिशा में c वेग से गति कर रहा है। इस वेग को तीन घटकों u, v और w जो क्रमश: X-अक्ष, Y- अक्ष और Z -अक्ष के समान्तर हैं, में वियोजित किया जा सकता है।
इस प्रकार, c2 = u2 + ν2 + w2
मानलो बर्तन के दो फलक A और B, X- अक्ष के लम्बवत् हैं। यदि यह अणु फलक A पर u वेग से टकराता है, तो टक्कर पूर्णत: प्रत्यास्थ होने के कारण यह (-u) वेग से वापस लौट जायेगा।
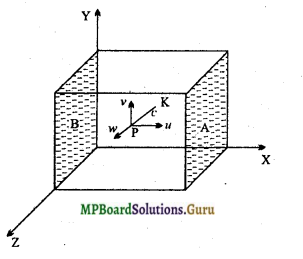
टक्कर के पहले अणु का संवेग = mu
तथा टक्कर के पश्चात् अणु का संवेग = -mu
अतः टक्कर के कारण अणु के संवेग में परिवर्तन = mu – (- mu) = 2mu
यह अणु A से B तक पहुँचने तथा B से A तक पुन: वापस आने में 2l दूरी तय करेगा।
अणुओं को 2l दूरी तय करने में लगा समय = \(\frac{2 l}{u}\), 
स्पष्ट है कि 2l दूरी तय करने के पश्चात् अर्थात् \(\frac{2 l}{u}\) समय के पश्चात् वही अणु पुन: फलक A पर टकरायेगा।
अतः प्रति सेकण्ड फलक A पर टक्करों की संख्या = \(\frac{u}{2l}\)
अतः प्रति सेकण्ड अणु द्वारा दीवार को प्रदान किया गया संवेग
= 2mu × \(\frac{u}{2 l}=\frac{m u^{2}}{l}\),
(अर्थात् फलक A पर संवेग परिवर्तन की दर)
परन्तु न्यूटन के गति के द्वितीय नियमानुसार, संवेग परिवर्तन की दर अणु द्वारा उस फलक पर आरोपित बल के बराबर होगी।
अतः अणु द्वारा फलक A पर आरोपित बल = \(\frac{m u^{2}}{l}\)
परन्तु, 
अत: अणु द्वारा फलक A पर आरोपित दाब = \(=\frac{m u^{2} / 1}{l^{2}}=\frac{m u^{2}}{l^{3}}\)
मानलो गैस के अणुओं की संख्या N है तथा X-अक्ष की दिशा में उनके वेगों के घटक क्रमश: u1, u2, u3,…., un, हैं।
अत: सम्पूर्ण अणुओं द्वारा फलक A पर आरोपित दाब,
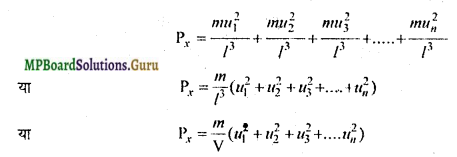
जहाँ V = l3 = बर्तन का आयतन (गैस का आयतन)।
इसी तरह Y-अक्ष के लम्बवत् किसी फलक पर गैस के अणुओं द्वारा आरोपित दाब,
![]()
जहाँ ν1, ν2,ν3,…., νn, गैस के अणुओं के वेगों के Y-अक्ष की दिशा में घटक हैं।
इसी प्रकार Z-अक्ष के लम्बवत् किसी फलक पर गैस के अणुओं द्वारा आरोपित दाब
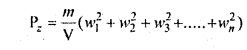
जहाँ w1,w2, w3,….,wn,गैस के अणुओं के वेगों के Z-अक्ष की दिशा में घटक हैं।
परन्तु गैस द्वारा सभी दिशाओं में आरोपित दाब समान होता है।
∴ Px = Py = Py = P (मानलो)
अत: p = \(\frac{\mathrm{P}_{x}+\mathrm{P}_{y}+\mathrm{P}_{z}}{3}\)

जहाँ \(\overline{\boldsymbol{c}}\) अणुओं का वर्ग-माध्य-मूल वेग है।
समी. (1) में मान रखने पर,
P = \(\frac{m N c^{2}}{3 V}\) यही अभीष्ट व्यंजक है।
![]()
आंकिक प्रश्न
प्रश्न 1.
स्थिर दाब पर 27°C ताप पर किसी आदर्श गैस का आयतन दुगुना करने के लिए उसे किस ताप तक गर्म करना पड़ेगा?
उत्तर:
दिया है : T1 = 27°C = 27 + 273 = 300K, V2 = 2V1
सूत्र- \(\frac{\mathrm{V}_{1}}{\mathrm{~V}_{2}}=\frac{\mathrm{T}_{1}}{\mathrm{~T}_{2}}\) से,
T2 = \(\frac{\mathrm{T}_{1} \mathrm{~V}_{2}}{\mathrm{~V}_{1}}=\frac{300 \times 2 \mathrm{~V}_{1}}{\mathrm{~V}_{1}}\)
= 600K = 600 – 273 = 327°C.
प्रश्न 2.
एक बर्तन में वायुमण्डलीय दाब पर वायु भरी है। इसे 27°C ताप पर बंद किया जाए तो बर्तन को कितना गर्म करने से कार्क बाहर निकल जाएगा? कार्क को बाहर निकालने के लिए कम-सेकम तीन गुना दाब की आवश्यकता है।
उत्तर:
दिया है : T1 = 27°C = 27 + 273 = 300K,
P2 = 3p1
सूत्र \(\frac{P_{1}}{P_{2}}=\frac{T_{1}}{T_{2}}\) से,
∴ T2 = \(\frac{\mathrm{T}_{1} \mathrm{P}_{2}}{\mathrm{P}_{\mathrm{I}}}=\frac{300 \times 3 \mathrm{P}_{1}}{\mathrm{P}_{1}}\)
= 900K = 900 – 273 = 627°C.
प्रश्न 3.
अन्तरिक्ष में किसी क्षेत्र में प्रति घन सेमी में औसत केवल 5 अणु हैं तथा वहाँ का ताप 3K है। इतनी विरल गैस का दाब क्या है ? (R = 1.38 × 10-23 जूल/ मोल/K)
उत्तर:
सूत्र : PV = nRT से, P = \(\frac{n \mathrm{RT}}{\mathrm{V}}\)
दिया है : V = 1 सेमी3 = 1 × (10-2)3 मीटर3 = 10-6 मीटर3, T=3 K, R= 1.38 × 10-23 जूल/ मोल/K, n = 5.
उपर्युक्त सूत्र में मान रखने पर,
P = \(\frac{5 \times 1 \cdot 38 \times 10^{-23} \times 3}{10^{-6}}\)
= 20.7 × 10-17 = 2.07 × 10-16 न्यूटन/मीटर।
प्रश्न 4.
किसी गैस का ताप – 68°C है। इसे किस ताप तक गर्म करें जिससे
(i) गैस के अणुओं की माध्य गतिज ऊर्जा पहले से दुगुनी हो जाये ? (ii) अणुओं का वर्ग-माध्य-मूल वेग पहले से दुगुनी हो जाये?
उत्तर:
(i) सूत्र : E = \(\frac{3}{2}\)kT से,
E ∝T
या \(\frac{\mathrm{E}_{1}}{\mathrm{E}_{2}}=\frac{\mathrm{T}_{1}}{\mathrm{~T}_{2}}\)
T1 = 273 – 68 = 205 K
दिया है : E2 = 2E1
∴ \(\frac{\mathrm{E}_{1}}{2 \mathrm{E}_{1}}=\frac{205}{\mathrm{~T}_{2}}\)
या T2 = 410 K = 410 – 273° = 137°C.
(ii) सूत्र : \(\bar{c}^{2}=\frac{3 R T}{M}\) से,
\(\bar{c} \propto \sqrt{\mathrm{T}}\) या \(\frac{\bar{c}_{1}}{\overline{2 c_{2}}}=\sqrt{\frac{\mathrm{T}_{1}}{\mathrm{~T}_{2}}}\)
दिया है : \(\vec{c}_{2}=2 \bar{c}_{1}\),T1 = 205K.
∴ \(\frac{\bar{c}_{1}}{2 \bar{c}_{1}}=\sqrt{\frac{205}{\mathrm{~T}_{2}}}\)
या \(\frac{1}{2}=\sqrt{\frac{205}{T_{2}}}\) या \(\frac{205}{\mathrm{~T}_{2}}=\frac{1}{4}\)
या T2= 820 K = (820 – 273)°C = 547°C.
प्रश्न 5.
एक बर्तन में 30°C पर हीलियम तथा हाइड्रोजन गैसों का मिश्रण भरा है। इस ताप पर इन गैसों के अणुओं के वर्ग-माध्य-मूल वेगों की तुलना कीजिए।
उत्तर:
सूत्र : \(\bar{c}^{2}=\frac{3 R T}{M}\) से,
\(\bar{c}=\sqrt{\frac{3 \mathrm{RT}}{\mathrm{M}}}\)
R व T नियतांक हैं। अतः \(\bar{c} \propto \frac{1}{\sqrt{M}}\)
या \(\frac{\bar{c}_{1}}{\bar{c}_{2}}=\sqrt{\frac{\mathrm{M}_{2}}{\mathrm{M}_{1}}}\)
हीलियम का अणुभार M1 = 4 और हाइड्रोजन का अणुभार M2 = 2.
सूत्र में मान रखने पर,
\(\frac{\bar{c}_{1}}{\bar{c}_{2}}=\sqrt{\frac{2}{4}}=\frac{1}{\sqrt{2}}\)
∴ \(\bar{c}_{1}: \bar{c}_{2}=1: \sqrt{2}\)
![]()
प्रश्न 6.
किसी गैस का परम ताप चार गुना कर देने पर अणुओं का वर्ग-माध्य-मूल वेग कितने गुना हो जायेगा? उसकी गतिज ऊर्जा और दाब कितने-कितने गुने हो जायेंगे?
उत्तर:
सूत्र \(\bar{c}=\sqrt{\frac{3 \mathrm{RT}}{\mathrm{M}}}\) में R व M नियतांक हैं।
∴ \(\bar{c} \propto \sqrt{\mathrm{T}}\)
या \(\frac{\bar{c}_{1}}{\bar{c}_{2}}=\sqrt{\frac{\mathrm{T}_{1}}{\mathrm{~T}_{2}}}\)
दिया है : T2 = 4T1.
∴ \(\frac{\bar{c}_{1}}{\bar{c}_{2}}=\sqrt{\frac{\mathrm{T}_{1}}{4 \mathrm{~T}_{1}}}=\sqrt{\frac{1}{4}}=\frac{1}{2}\)
या \(\bar{c}_{2}=2 \bar{c}_{1}\)
अर्थात् वर्ग-माध्य-मूल वेग दुगुना हो जायेगा।
सूत्र : E = \(\frac{3}{2}\)kT से,
E ∝ T या \(\frac{\mathrm{E}_{1}}{\mathrm{E}_{2}}=\frac{\mathrm{T}_{1}}{\mathrm{~T}_{2}}\)
T2 = 4T1 रखने पर,
\(\frac{\mathrm{E}_{1}}{\mathrm{E}_{2}}=\frac{\mathrm{T}_{1}}{4 \mathrm{~T}_{1}}=\frac{1}{4}\)
या
E2 = 4E1
अत: गतिज ऊर्जा चार गुनी हो जायेगी।
सूत्र : P ∝ T से,
\(\frac{P_{1}}{P_{2}}=\frac{T_{1}}{T_{2}}\)
T2 = 4T1 रखने पर,
\(\frac{\mathrm{P}_{1}}{\mathrm{P}_{2}}=\frac{\mathrm{T}_{1}}{4 \mathrm{~T}_{1}}=\frac{1}{4}\)
या P2 = 4P1
अत: दाब चार गुना हो जायेगा।
प्रश्न 7.
किसी गैस के ताप को 77°C से 227°C करने में उसके अणुओं की औसत गतिज ऊर्जा का अनुपात क्या होगा?
उत्तर:
दिया है : T1 = (273 + 77)K = 350K तथा T2 = (273 + 227)K = 500K.
सूत्र : E ∝ T से,
\(\frac{\mathrm{E}_{1}}{\mathrm{E}_{2}}=\frac{\mathrm{T}_{1}}{\mathrm{~T}_{2}}=\frac{350}{500}=\frac{7}{10}\)
∴ E1:E2 = 7:10.
प्रश्न 8.
एक बर्तन A का आयतन दूसरे बर्तन B के आयतन से दुगुना है तथा दोनों में एक ही गैस भरी है। यदि बर्तन A की गैस बर्तन B की गैस के सापेक्ष दुगुने ताप व दुगुने दाब पर है, तो A व B में गैस के अणुओं में क्या अनुपात होगा?
उत्तर:
सूत्र : PV =nRT से,
\(\frac{\mathrm{PV}}{n \mathrm{~T}}\) = R = एक नियतांक

∴ n1 : n2 = 2 : 1.
प्रश्न 9.
(i) किसी गैस के निश्चित ताप पर उसका आयतन आधा कर दिया जाए तो अणुओं के औसत वर्ग-माध्य-मूल वेग पर क्या प्रभाव पड़ेगा?
(ii) यदि गैस का आयतन तथा ताप स्थिर रखते हुए गैस के अणुओं की संख्या बढ़ा दी जाये तो गैस के वर्ग-माध्य-मूल वेग पर क्या प्रभाव पड़ेगा?
(iii) 1.5 लीटर धारिता के एक बर्तन में हाइड्रोजन तथा ऑक्सीजन गैसों का मिश्रण भरा है। दोनों गैसों की औसत गतिज ऊर्जा का अनुपात क्या होगा?
उत्तर:
(i) \(\bar{c}=\sqrt{\frac{3 \mathrm{RT}}{\mathrm{M}}}\) में R व M नियतांक हैं।
∴ \(\bar{c} \propto \sqrt{\mathrm{T}}\)
अत: आयतन आधा कर देने पर ताप नियत रहने के कारण वर्ग-माध्य-मूल वेग पर कोई प्रभाव नहीं पड़ेगा अर्थात् वेग समान रहेगा।
(ii) \(\bar{c} \propto \sqrt{\mathrm{T}}\)
ताप नियत रहने के कारण वर्ग-माध्य-मूल वेग नियत रहेगा।
(iii) सूत्र – E = \(\frac{3}{2}\) kT से,
या Ε ∝ Τ
या \(\frac{\mathrm{E}_{1}}{\mathrm{E}_{2}}=\frac{\mathrm{T}_{1}}{\mathrm{~T}_{2}}\)
ताप समान होने के कारण – T1 = T2
∴ \(\frac{E_{1}}{E_{2}}=\frac{1}{1}\)
या E1 : E2 = 1 : 1
प्रश्न 10.
ऑक्सीजन के अणुओं के आयतन और STP पर इनके द्वारा घेरे गए कुल आयतन का अनुपात ज्ञात कीजिए। ऑक्सीजन के एक अणु का व्यास 3Å लीजिए।
उत्तर:
STP पर ऑक्सीजन के एक मोल का आयतन = 22.4 लीटर
=\(\frac{22 \cdot 4}{1000}\)m3 = 224 × 10-4m3 Å
ऑक्सीजन के अणु की त्रिज्या r = \(\frac{3}{2}\) Å
=1.5 × 10-10m
ऑक्सीजन के एक मोल में अणु का आयतन = \(\frac{4}{3}\) πr3 × N
= \(\frac{4}{3}\) × 3.14 × (1.5 × 10-10)3 × 6.023 × 1023
वास्तविक आयतन एवं मोलर आयतन का अनुपात
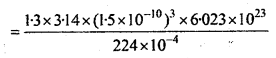
= 3.7 × 10-4
प्रश्न 11.
मोलर आयतन, STP पर किसी आदर्श गैस के एक मोल द्वारा घेरा गया आयतन है (STP: 1 atm दाब, 0°C) दर्शाइये कि यह 22.4 लीटर है।
उत्तर:
आदर्श गैस के एक मोल के लिए,
PV = RT
⇒ V = \(\frac{\mathrm{RT}}{\mathrm{P}}\)
परन्तु T = 0°C + 273 = 273K
P = एक वायुमंडलीय दाब = 1.01 x 105 N/m2
R = 8:31Jmol-1K-1
∴ V = \(\frac{8 \cdot 31 \times 273}{1 \cdot 01 \times 10^{5}}\)
=0.0224 m3 = 22.4 लीटर। सिद्ध हुआ।
![]()
प्रश्न 12.
वायु का एक बुलबुला, जिसका आयतन 1.0 cm3 है, 40m गहरी झील की तली से जहाँ ताप 12°C है, ऊपर उठकर पृष्ठ पर आता है जहाँ ताप 35°C है। अब इसका आयतन क्या होगा? ।
उत्तर:
झील की तली पर दाब, आयतन एवं ताप क्रमशः P1V1 एवं T1 है।
P1 = वायुमंडलीय दाब + 40m जल स्तंभ द्वारा आरोपित दाब
P1 = 1.01 × 105 + 40 × 1000 × 9.8 = 4.9 × 105Pa
V1 = 1 × 10-6 m3
T1 = 12 + 273 = 285K
झील के पृष्ठ पर दाब, आयतन एवं ताप क्रमश: P2, V2 एवं T2 है।
P2 = वायुमंडलीय दाब = 1.01 × 10 N/m
V2 = ?
T2 35+273 = 308K
∵ \(\frac{\mathrm{P}_{1} \mathrm{~V}_{1}}{\mathrm{~T}_{1}^{\prime}}=\frac{\mathrm{P}_{2} \mathrm{~V}_{2}}{\mathrm{~T}_{2}}\)
या V2 = \(\frac{\mathrm{P}_{1} \mathrm{~V}_{1} \mathrm{~T}_{2}}{\mathrm{P}_{2} \mathrm{~T}_{1}}\)
V2 = \(\frac{4 \cdot 9 \times 10^{5} \times 10^{-6} \times 308}{1 \cdot 01 \times 10^{5} \times 285}\)
∴ V2 = 5.3 × 10-6m3.
प्रश्न 13.
किस ताप पर आर्गन गैस सिलिंडर में अणुओं की νrms -20°C पर हीलियम गैस परमाणुओं की νrms के बराबर होगी। (Ar का परमाणु द्रव्यमान = 39.9 u एवं हीलियम का परमाणु द्रव्यमान = 4.0u)
उत्तर:
आर्गन गैस के लिए,
आर्गन परमाणु का द्रव्यमान m1 = 39.9 × 1.6 × 10-27kg
ताप = T1 = ?
ν1(rms) = \(\sqrt{\frac{3 k \mathrm{~T}_{1}}{m_{1}}}\),
(k = बोल्ट्ज मैन नियतांक = 1:38 × 10-23JK-1)
हीलियम परमाणु के लिए,
m2 = 4 × 1.6 × 10-27kg
तथा T2 =-20 + 273 = 253K
ν2(rms) = \(\sqrt{\frac{3 k T_{2}}{m_{2}}}\)
∵ ν1(rms) = ν2(rms)
\(\sqrt{\frac{3 k \mathrm{~T}_{1}}{m_{1}}}=\sqrt{\frac{3 k \mathrm{~T}_{2}}{m_{2}}}\)
या \(\frac{3 k \mathrm{~T}_{1}}{m_{1}}=\frac{3 k \mathrm{~T}_{2}}{m_{2}}\)
या T1 = \(\frac{m_{1}}{m_{2}}\) T2
या T1 = \(\frac{39 \cdot 9 \times 1 \cdot 6 \times 10^{-27}}{4 \times 1 \cdot 6 \times 10^{-27}}\) × 253
या T1 = 2.523.675K
या T1 = 2.523 × 103K.
वस्तुनिष्ठ प्रश्न
सही विकल्प चुनकर लिखिए-
प्रश्न 1.
-273°C पर गैस के अणु गति करते हैं-
(a) अधिकतम वेग से
(b) न्यूनतम वेग से
(c) शून्य वेग से
(d) उस वेग से जो \(\sqrt{273}\) के समानुपाती है।
उत्तर:
(c) शून्य वेग से
प्रश्न 2.
कम ताप पर आदर्श गैस नियम से विचलन किस कारण होता है-
(a) आण्विक संघट्ट अप्रत्यास्थ हो जाते हैं
(b) अणुओं का आयतन नगण्य नहीं माना जा सकता
(c) अणुओं के बीच लगने वाले बल क्षीण हो जाते हैं
(d) आण्विक वेग कम हो जाते हैं।
उत्तर:
(b) अणुओं का आयतन नगण्य नहीं माना जा सकता
प्रश्न 3.
एक बर्तन में N अणु हैं। अणुओं की संख्या दुगुनी करने पर गैस का दाब-
(a) दुगुना हो जाता है
(b) समान रहता है
(c) चार गुना हो जाता है
(d) चौथाई रह जाता है।
उत्तर:
(a) दुगुना हो जाता है
4. परम शून्य ताप पर गैसों के अणु की गति-
(a) कम हो जाती है
(b) वृद्धि हो जाती है
(c) शून्य हो जाती है
(d) इनमें से कोई नहीं।
उत्तर:
(c) शून्य हो जाती है
प्रश्न 5.
समान ताप पर आदर्श गैस के अणुओं का वर्ग-माध्य-मूल वेग-
(a) समान होता है
(b) अणुभार के वर्गमूल के व्युत्क्रमानुपाती होता है
(c) अणुभार के अनुक्रमानुपाती होता है
(d) अणुभार के व्युत्क्रमानुपाती होता है।
उत्तर:
(b) अणुभार के वर्गमूल के व्युत्क्रमानुपाती होता है
![]()
प्रश्न 6.
यदि कोई गैस बॉयल के नियम का पालन करे तो उसके लिए PV व P के बीच ग्राफ होगा-
(a) अतिपरवलय
(b) PV-अक्ष के समान्तर रेखा
(c) P-अक्ष के समान्तर सरल रेखा
(d) मूलबिन्दु से गुजरती P-अक्ष से 45°C कोण पर सरल रेखा।
उत्तर:
(c) P-अक्ष के समान्तर सरल रेखा
प्रश्न 7.
गैसों के अणुगति सिद्धान्त के सम्बन्ध में असत्य कथन है-
(a) दो अणुओं की टक्कर पूर्णतः प्रत्यास्थ होती है
(b) अणुओं की माध्य गतिज ऊर्जा गैस के परम ताप के समानुपाती होती है
(c) गैस का परम ताप उसके अणुओं के वर्ग-माध्य-मूल वेग के व्युत्क्रमानुपाती होती है
(d) परम शून्य ताप पर अणुओं की माध्य गतिज ऊर्जा शून्य होती है।
उत्तर:
(c) गैस का परम ताप उसके अणुओं के वर्ग-माध्य-मूल वेग के व्युत्क्रमानुपाती होती है
प्रश्न 8.
एक गैस द्वारा बर्तन की दीवारों पर आरोपित बल का कारण यह है कि गैस के अणु-
(a) अपनी गतिज ऊर्जा खो रहे हैं
(b) दीवारों से चिपक रहे हैं
(c) दीवारों से टक्कर के कारण उसका संवेग बदल रहा है
(d) दीवारों की ओर त्वरित हो रहे हैं।
उत्तर:
(c) दीवारों से टक्कर के कारण उसका संवेग बदल रहा है
प्रश्न 9.
चन्द्रमा पर कोई वायुमण्डल नहीं है, क्योंकि-
(a) वह पृथ्वी के निकट है
(b) वह पृथ्वी की परिक्रमा करता है
(c) वह सूर्य से प्रकाश प्राप्त करता है
(d) वहाँ गैस अणुओं का पलायन वेग उसके वर्ग-माध्य-मूल वेग से कम होता है।
उत्तर:
(d) वहाँ गैस अणुओं का पलायन वेग उसके वर्ग-माध्य-मूल वेग से कम होता है।
प्रश्न 10.
एक आदर्श गैस का ताप 27°C से 927°C तक बढ़ाया जाता है। उसके अणुओं का वर्ग-माध्य-मूल वेग हो जायेगा-
(a) दुगुना
(b) आधा
(c) चार गुना
(d) एक-चौथाई।
उत्तर:
(a) दुगुना
प्रश्न 11.
प्रत्येक गैस आदर्श गैस की तरह व्यवहार करती है-
(a) निम्न दाब तथा उच्च ताप पर
(b) उच्च दाब तथा निम्न ताप पर
(c) सामान्य दाब व ताप पर
(d) उच्च दाब व उच्च ताप पर।
उत्तर:
(a) निम्न दाब तथा उच्च ताप पर
प्रश्न 12.
सार्वत्रिक गैस नियतांक का मात्रक है-
(a) जूल/मोल-केल्विन
(b) मोल/जूल-केल्विन
(c) जूल-मोल-केल्विन
(d) केल्विन/जूल/मोल।
उत्तर:
(a) जूल/मोल-केल्विन
प्रश्न 13.
गैस का दाब आधा करने पर, आयतन हो जायेगा यदि ताप स्थिर है-
(a) आधा
(b) दुगुना
(c) अपरिवर्तित
(d) चार गुना।
उत्तर:
(b) दुगुना
प्रश्न 14.
गैस समीकरण PV=RT में V आयतन है-
(a) गैस का
(b) 1 ग्राम गैस का
(c) 1 लिटर गैस का
(d) 1 मोल गैस का।
उत्तर:
(d) 1 मोल गैस का।
![]()
प्रश्न 15.
बर्तन में बन्द गैस का दाब निम्नलिखित के कारण है-
(a) इसमें अत्यधिक संख्या में अणु हैं
(b) अणुओं और बर्तन की दीवारों में आकर्षण होता है
(c) अणु बर्तन की दीवारों से टकराते हैं
(d) इनमें से कोई नहीं।
उत्तर:
(c) अणु बर्तन की दीवारों से टकराते हैं
प्रश्न 16.
गैस के अणुओं की माध्य गतिज ऊर्जा प्रति इकाई स्वतन्त्रता किस कोटि की होती है-
(a) \(\frac{3}{2}\)kT
(b) kT
(c) \(\frac{1}{2}\)kT
(d) \(\frac{3}{2}\)RT
उत्तर:
(c) \(\frac{1}{2}\)kT
प्रश्न 17.
गैस पात्र की दीवारों पर दाब डालती है, क्योंकि-
(a) गैस का भार होता है
(b) गैस के अणुओं का संवेग होता है
(c) गैस के अणु परस्पर संघटन करते हैं
(d) गैस के अणु पात्र की दीवारों के साथ संघटन करते हैं।
उत्तर:
(d) गैस के अणु पात्र की दीवारों के साथ संघटन करते हैं।
प्रश्न 18.
गैस का वर्ग-माध्य-मूल वेग होता है-
(a) उसके विशिष्ट अणुभार के अनुक्रमानुपाती
(b) उसके अणुभार के वर्ग के व्युत्क्रमानुपाती
(c) उसके मोलर भार के वर्गमूल के व्युत्क्रमानुपाती
(d) परम ताप के वर्ग के व्युत्क्रमानुपाती।
उत्तर:
(c) उसके मोलर भार के वर्गमूल के व्युत्क्रमानुपाती
प्रश्न 19.
एक ग्राम मोल गैस के लिए R का मान है-
(a) 8.31 अर्ग
(b) 8.31 mks मात्रका
(c) 4.2 जूल
(d) 4.2 कैलोरी।
उत्तर:
(b) 8.31 mks मात्रका
प्रश्न 20.
यदि किसी गैस के अणु का rms वेग दुगुना कर दिया जाये तो दाब
(a) बढ़ेगा
(b) घटेगा
(c) घटेगा या बढ़ेगा यह गैस पर निर्भर करेगा
(d) इनमें से कोई नहीं।
उत्तर:
(a) बढ़ेगा
2. रिक्त स्थानों की पूर्ति कीजिए
1. गैस अणुओं द्वारा पात्र की दीवारों के प्रति इकाई क्षेत्रफल को दिया गया संवेग गैस के ………………. के बराबर होता है।
उत्तर:
दाब
2. परम शून्य ताप पर अणुओं की ………….. शून्य हो जाती है।
उत्तर:
गतिज ऊर्जा
![]()
3. कोई कण स्वतन्त्रतापूर्वक जितनी दिशाओं में गमन कर सकता है उसे उसकी …………. कहते हैं।
उत्तर:
स्वतन्त्रता की कोटि
4. प्रत्येक स्वातंत्र्य कोटि से संलग्न गतिज ऊर्जा का मान …………. होता है।
उत्तर:
\(\frac{1}{2}\)kT
5. स्थिर दाब पर किसी गैस के निश्चित द्रव्यमान के ताप को 1°C बढ़ाने पर उसका दाब 0°C के दाब
का …………. वाँ भाग बढ़ जाता है।
उत्तर:
\(\frac{1}{273}\)
3. सही जोड़ियाँ बनाइए
| खण्ड ‘अ’ | खण्ड ‘ब |
| 1. गैस का दाब P | (a) ∝T |
| 2. गैस का परम ताप T | (b) 3 |
| 3. माध्य गतिज ऊर्जा E | (c) 5 |
| 4. एकपरमाणुक गैस की स्वतन्त्रता की कोटि | (d) ∝ \(\bar{c}^{2}\) |
| 5. द्विपरमाणुक गैस की स्वतन्त्रता की कोटि | (e) \(\frac{1}{3} \frac{m \mathrm{~N}}{\mathrm{~V}}\) |
उत्तर:
1. (e) \(\frac{1}{3} \frac{m \mathrm{~N}}{\mathrm{~V}}\)
2. (d) ∝ \(\bar{c}^{2}\)
3. (a) ∝T
4. (b) 3
5. (c) 5