MP Board Class 11th Chemistry Solutions Chapter 8 अपचयोपचय अभिक्रियाएँ
अपचयोपचय अभिक्रियाएँ NCERT अभ्यास प्रश्न
प्रश्न 1.
निम्नलिखित स्पीशीज़ में रेखांकित तत्वों की ऑक्सीकरण संख्या बताइए –
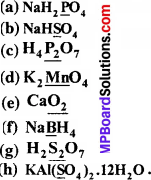
उत्तर:

प्रश्न 2.
निम्नलिखित स्पीशीज़ में रेखांकित तत्वों की ऑक्सीकरण संख्या ज्ञात कीजिए –
(a) KI3
(b) H2S4O6
(c) Fe3O4
(d) CH3CH2OH
(e) CH3COOH
उत्तर:
![]() या x = 1/3 (I की ऑक्सीकरण संख्या)
या x = 1/3 (I की ऑक्सीकरण संख्या)
व्याख्या: I2 की ऑक्सीकरण संख्या प्रभाज में आती है। इसकी I–3 की संरचना द्वारा व्याख्या कर सकते हैं।
![]()
I का औसत ऑक्सीकरण संख्या = -1/3 यह प्रदर्शित करता है कि परमाणु विभिन्न ऑक्सीकरण अवस्था में होते हैं। दो I परमाणुओं की ऑक्सीकरण संख्या शून्य तथा एक की -1 है इसलिये I–3 की -1 होगी।
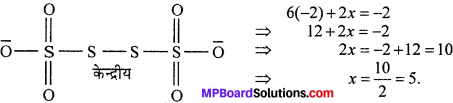
![]() या x = 2.5 (S की ऑक्सीकरण संख्या)
या x = 2.5 (S की ऑक्सीकरण संख्या)
S की ऑक्सीकरण संख्या प्रभाज में आती है जो प्रदर्शित करता है कि S परमाणु विभिन्न ऑक्सीकरण अवस्था प्रदर्शित करता है।

इसे निम्न प्रकार से समझा सकते हैं –
- यहाँ S – S बंध के बीच कोई इलेक्ट्रॉन का वितरण नहीं है।
- दो किनारे की S – परमाणुओं की ऑक्सीकरण संख्या +5 है।
- दो बीच के S – परमाणुओं की ऑक्सीकरण संख्या शून्य है।
औसत ऑक्सीकरण संख्या = \(\frac {5 + 0 + 0 + 5}{ 4 }\) = 2.5
(c) Fe2O2 यह FeO. Fe2O3, का मिश्रण है। Fe की ऑक्सीकरण संख्या +2 और +3 है। अत: औसत ऑक्सीकरण संख्या + 8 / 3 होगी।
(d) CH3CH2OH या C2H6O परम्परागत (conventional) कार्बन की ऑक्सीकरण संख्या = -2 होता है, परन्तु दो कार्बन परमाणु विभिन्न ऑक्सीकरण संख्या प्रदर्शित करते हैं।
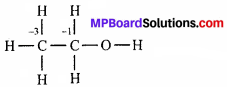
सभी H- परमाणु का ऑक्सीकरण संख्या +1 है, O की ऑक्सीकरण संख्या = -2, C का CH3 समूह में ऑक्सीकरण संख्या -3 तथा C जो O परमाणु से जुड़ी है, की ऑक्सीकरण संख्या -1 है। इस कार्बन पर इलेक्ट्रॉन 2H परमाणु से आते हैं, तथा इलेक्ट्रॉन को O परमाणु ले लेता है और C – C बंध के बीच इलेक्ट्रॉन का वितरण नहीं होता है।
C की औसत ऑक्सीकरण संख्या जो O-परमाणु से जुड़ी है, होगी = -2 + 1 = -1.
कार्बन की औसत ऑक्सीकरण संख्या है- (-3 -1)/2 = -2.
(e) CH3COOH या C2H4O2 में C की परम्परागत ऑक्सीकरण संख्या = 0
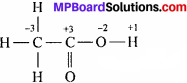
सभी H – परमाणु का ऑक्सीकरण संख्या +1 है तथा 0 परमाणु का – 2 तथा C – परमाणु जो O – परमाणु से जुड़ी हुई है उसकी ऑक्सीकरण संख्या + 3, कार्बन CH3– समूह वाले की ऑक्सीकरण संख्या – 3 है। औसत ऑक्सीकरण संख्या शून्य होगी।
प्रश्न 3.
सिद्ध कीजिए कि निम्नलिखित अभिक्रियाएँ रेडॉक्स अभिक्रियाएँ हैं –
1. CuO(s) + H2(g) → Cu(s) + H2O(g)
2. Fe2O3(s) + 3CO(g) → 2Fe(g) + 3CO2(g)
3. 4BCl3(g) + 3LiAlH4(s) → 2B2H6(g)) + 3LiCl(s) + 3AlCl3(s)
4. 2K(s) + F2(g) → 2K+F–(s)
5. 4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
उत्तर:
1. Cuo ऑक्सीजन का निष्कासन करके Cu में अपचयित हो जाता है जबकि H2, H2O में ऑक्सीकृत ऑक्सीजन का योग करके होती है। अतः यह एक रेडॉक्स अभिक्रिया है।
2. Fe2O3 ऑक्सीजन का निष्कासन करके Fe में अपचयित हो जाता है। जबकि CO ऑक्सीजन के योग द्वारा CO2 में ऑक्सीकृत हो जाता है। अतः यह एक रेडॉक्स अभिक्रिया है।
3. BCl3, B के चारों तरफ इलेक्ट्रॉन घनत्व बढ़ाकर B2H6 में बदल जाता है। अतः BCl3 में B अपचयित हुआ कहलायेगा जबकि Li और AI के चारों ओर इलेक्ट्रॉन घनत्व की कमी होकर LiCl में बदल जाता है अर्थात् Li और Al ऑक्सीकृत हुये कहलायेंगे। अतः यह एक रेडॉक्स अभिक्रिया है।
4. ऑक्सीकरण संख्या परिवर्तन के आधार पर K की ऑक्सीकरण संख्या 0(K में) से +1(KF में) बढ़ती है। दूसरे शब्दों में, K ऑक्सीकृत जबकि F2 अपचयित हुई है। अत: यह एक रेडॉक्स अभिक्रिया है।
5. N की ऑक्सीकरण संख्या -3(NH3 में) से +2(NO में) बढ़ी है तथा O2 की शून्य (O2में) से -2(H2O में) घटी है। दूसरे शब्दों में NH3 ऑक्सीकृत हुई जबकि O2 अपचयित हुई है। अत: यह एक रेडॉक्स अभिक्रिया है।
![]()
प्रश्न 4.
फ्लुओरीन बर्फ से क्रिया करके निम्नानुसार उत्पाद बनाती है –
H2O(s) + F2(g) → HF(g) + HOF(g)
सिद्ध कीजिए कि उक्त अभिक्रिया रेडॉक्स अभिक्रिया है। यदि HOF का ऑक्सीजन परमाणु विषमानुपात में टूटता है तो कौन – सी अभिक्रिया होगी ?
उत्तर:
![]()
यहाँ F, HF में अपचयित तथा HOF में ऑक्सीकृत होती है इसलिये ये रेडॉक्स अभिक्रिया है। HOF अस्थायी है तथा अपघटित होकर O2 और HF बनाता है।
![]()
इस अभिक्रिया में HOF की F अपचयित तथा HOF की ऑक्सीजन ऑक्सीकृत हुई है। अत: यह एक रेडॉक्स अभिक्रिया है परन्तु विषमानुपाती अभिक्रिया नहीं है। यदि HOF की ऑक्सीजन विषमानुपातित होती तो ऑक्सीजन तीन ऑक्सीकरण अवस्था प्रदर्शित करती है। यदि हम यह मानते हैं कि ऑक्सीजन की ऑक्सीकरण अवस्था HOF में शून्य है तो उसकी ऑक्सीकरण अवस्था घटकर-2 हो जाती है, HOF H2O में अपचयित होती है और बढ़कर +2 हो जाती है यदि HOF OF2, में ऑक्सीकृत होता है। अतः संभावित अभिक्रिया
![]()
प्रश्न 5.
H2SO5, में सल्फर की, CrO5, में क्रोमियम की तथा NO–3 में नाइट्रोजन की ऑक्सीकरण संख्या क्या है? इन स्पीशीज़ की संरचनाएँ बनाइए।
उत्तर:
(i) S की H2SO5 में ऑक्सीकरण संख्या:
परम्परागत विधि के आधार पर S की ऑक्सीकरण संख्या H2SO5 में + 8 आता है जैसा कि नीचे दिखाया गया है –
2(+1) + x + 5(-2)= 0 या x = + 8
यह असंभव है क्योंकि S की अधिकतम ऑक्सीकरण संख्या 6 से अधिक नहीं हो सकती क्योंकि इसमें छः संयोजी इलेक्ट्रॉन होते हैं। रासायनिक बंध विधि द्वारा S की O.N. की गणना कर इसकी इस संयोजकता को नियंत्रित किया जा सकता है।
H2SO5 की संरचना विभिन्न परमाणुओं की ऑक्सीकरण संख्या के साथ है –
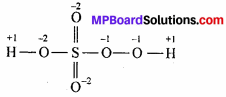
अर्थात्, 2(+1) + 3(-2) + x + 2(-1) = 0 या x = +6
(ii) Cr की CrO5 में ऑक्सीकरण संख्या:
परम्परागत विधिनुसार Cr की ऑक्सीकरण संख्या x + 5(-2) = 0 या x = +10 यह असंभव है क्योंकि Cr की अधिकतम ऑक्सीकरण संख्या 6 से ज्यादा नहीं हो सकती क्योंकि बाहरी कक्षक विन्यास में अधिकतम 6 इलेक्ट्रॉन (3d54s1) होते हैं जो बंध बनने में भाग ले सकते हैं, इस दोष को ऑक्सीकरण संख्या (Cr के) की रासायनिक बंध विधि द्वारा गणना करके हटाया जाता है। CrO5 की संरचना है –
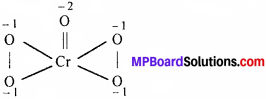
उपर्युक्त संरचनानुसार Cr की ऑक्सीकरण संख्या की इस तरह गणना कर सकते हैं –
x + 4(-1) + 1(-2)= 0 या x = +6
यहाँ यह ध्यान देने योग्य है कि चार ऑक्सीजन परमाणु परॉक्सी – लिंकेज (ऑक्सीकरण संख्या = -1) और एक ऑक्सीजन द्विबंध द्वारा जुड़ी है उसकी ऑक्सीकरण संख्या = -2
(iii) N की NO3 में ऑक्सीकरण संख्या:
परम्परागत विधिनुसार NO3– में N की ऑक्सीकरण संख्या ⇒ x + 3(-2) = -1 या x = + 5. रासायनिक बंध विधि के अनुसार NO3– आयन की संरचना है –
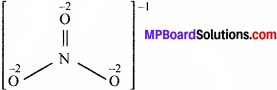
अतः नाइट्रोजन का ऑक्सीकरण संख्या x + 3(-2) = -1 या x = +5
अर्थात् N का NO–3 में ऑक्सीकरण संख्या परम्परागत विधि या रासायनिक बंध विधि दोनों में समान है।
प्रश्न 6.
निम्नलिखित यौगिकों के सूत्र लिखिए –
- मर्करी (II) क्लोराइड
- निकिल (II) सल्फेट
- टिन (IV) फ्लुओराइड
- थैलियम (II) सल्फेट
- आयरन (III) सल्फेट
- क्रोमियम (III) ऑक्साइड।
उत्तर:
- Hg(II)Cl2
- Ni(II)SO4
- Sn(IV)O2
- TI(I)SO4
- Fe2(III)(SO4)3
- Cr2 (III)O3.
प्रश्न 7.
उन यौगिकों के उदाहरण दीजिए जो कार्बन की -4 से +4 ऑक्सीकरण अवस्था तथा नाइट्रोजन की -3 से +5 ऑक्सीकरण अवस्था को प्रदर्शित करते हैं।
उत्तर:
1. C की परिवर्ती ऑक्सीकरण अवस्थायें:
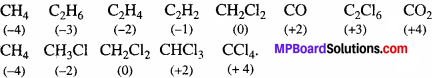
2. N की परिवर्ती ऑक्सीकरण अवस्थायें हैं:
![]()
प्रश्न 8.
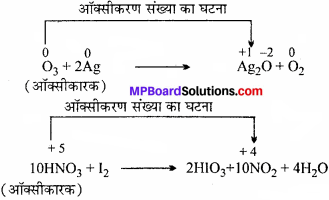
SO2 तथा H2O2ऑक्सीकारक तथा अपचायक दोनों के समान व्यवहार करते हैं जबकि O3 तथा HNO3, केवल ऑक्सीकारक के समान। ऐसा क्यों ?
उत्तर:
सल्फर डाइऑक्साइड (SO2) और हाइड्रोजन परॉक्साइड (H2O2) में S और ऑक्सीजन की ऑक्सीकरण अवस्थायें क्रमश: + 4 और -1 है। अतः घट या बढ़ सकते हैं जब इनके यौगिक रासायनिक क्रिया में भाग लेते हैं। ये ऑक्सीकारक या अपचायक की तरह कार्य कर सकते हैं।
उदाहरण:
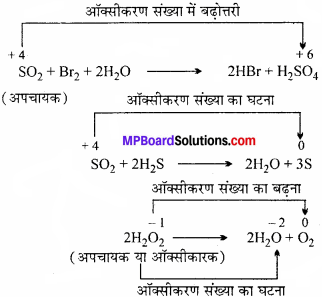
इसी तरह, O3 (ओजोन) में ऑक्सीजन की ऑक्सीकरण अवस्था शून्य तथा नाइट्रिक अम्ल में नाइट्रोजन की ऑक्सीकरण अवस्था +5 है। अर्थात् दोनों में ऑक्सीकरण अवस्था घटती है और उसका मान नहीं बढ़ता ये सिर्फ ऑक्सीकारक की तरह कार्य करते हैं अपचायक की तरह नहीं।
![]()
प्रश्न 9.
निम्नलिखित क्रियाओं को ध्यान से देखिए –
(a) 6CO2(g) + 6H2O(l) → C6H12O6(s) + 6O2(g)
(b) O3(g) + H2O2(l) → H2O(l) + 2O2(g).
उपर्युक्त अभिक्रियाओं को निम्नानुसार लिखना अधिक योग्य है, क्यों ?
(a) 6CO2(g) + 12H2O(l) → C6H12O6(s) + 6H2O(l) + 6O2(g)
(b) O3(g) + H2O(l) → H2O(l) + O2(g) + O2(g).
उत्तर:
(a) प्रकाश संश्लेषण में पानी से O2 मुक्त होता है, CO2 से नहीं। ये रेडियोएक्टिव ट्रेसर विधि द्वारा निश्चित होता है। क्रियाविधि निम्न प्रकार दी जाती है
6CO2(g) + 12H2O*(l) → C6H12O6(aq)+ 6H2O(l) + 6O*2
(b) इस क्रिया की क्रियाविधि निम्न प्रकार दी जा सकती है –
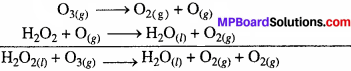
प्रश्न 10.
AgF2, एक अस्थायी यौगिक है फिर भी यदि यह बनता है तो एक तीव्र ऑक्सीकारक होगा। क्यों?
उत्तर:
Ag47 → 4d105s1
Ag+ → 4d105s0
Ag2+ → 4d95s0
विन्यास दर्शाता है कि Ag+, Ag2+ से ज्यादा स्थायी है इसलिये Ag2+ Ag+ में परिवर्तित हो जाता है तथा यह ऑक्सीकारक की तरह कार्य करती है।
![]()
प्रश्न 11.
जब भी किसी ऑक्सीकारक तथा अपचायक के मध्य अभिक्रिया होती है, तो यदि अपचायक आधिक्य में हो तो निम्नतर ऑक्सीकरण संख्या वाला उत्पाद बनता है जबकि ऑक्सीकारक आधिक्य में हो तो उच्चतर ऑक्सीकरण संख्या वाला उत्पाद बनता है। तीन उदाहरण प्रस्तुत करते हुए उक्त कथन की पुष्टि कीजिए।
उत्तर:
1. कार्बन और ऑक्सीजन के बीच होने वाली अभिक्रिया पर विचार करते हैं –

2. सफेद फॉस्फोरस और Cl2(g) के बीच अभिक्रिया पर विचार करते हैं-
अपचायक + ऑक्सीकारक

3. सल्फर व ऑक्सीजन के बीच होने वाली क्रिया पर विचार करते हैं-
अपचायक + ऑक्सीकारक

प्रश्न 12.
निम्नांकित प्रेक्षणों का कारण बताइए –
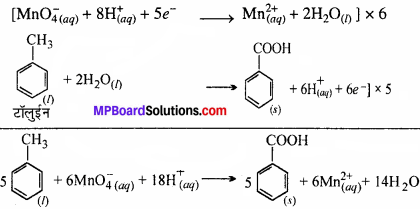
(a) यद्यपि क्षारीय KMnO4 तथा अम्लीय KMnO4 दोनों ऑक्सीकारक के रूप में प्रयुक्त होते हैं फिर भी टॉलुईन से बेंजोइक अम्ल बनाने के लिए एल्कोहॉलिक KMnO4 ऑक्सीकारक के रूप में लिया जाता है। क्यों ? अभिक्रिया का संतुलित समीकरण लिखिए।
(b) किसी अकार्बनिक मिश्रण में जिसमें क्लोराइड हो, सान्द्रH2SO4 मिलाने पर तीक्ष्ण गंध वाली HCl गैस निकलती है। किन्तु यदि मिश्रण में ब्रोमाइड हो तो ब्रोमीन की लाल वाष्प निकलती है। क्यों?
उत्तर:
(a) टॉलुईन अम्लीय, क्षारीय व उदासीन माध्यम में बेन्जोइक अम्ल में पोटैशियम परमैंग्नेट का उपयोग कर ऑक्सीकृत होती है –
(i) अम्लीय माध्यम में –
(ii) उदासीन (एल्कोहॉलीय) और क्षारीय माध्यम में से –
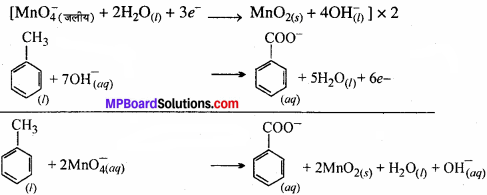
टॉलुईन से बेन्जोइक अम्ल निर्माण में उदासीन माध्यम को अम्लीय या क्षारीय माध्यम की तुलना में प्राथमिकता निम्न कारणों से दी जाती है –
उदासीन माध्यम में न तो अम्ल न तो क्षार बाहर से मिलते हैं जो कि निर्माण विधि में दर की निश्चित बचत करती है। ऐल्कोहॉल का यदि विलायक की तरह उपयोग करें तो ये टॉलुईन (अध्रुवीय) और KMnO4 (आयनिक) के बीच समांगी मिश्रण बनने में सहायता करता है। दरअसल ऐल्कोहॉल में अध्रुवीय एल्काइल समूह तथा ध्रुवीय OH समूह होता है।
(b) क्लोराइड जैसे NaCl सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म करने पर क्रिया करके हाइड्रोजन क्लोराइड गैस निकालती है। इसकी तीक्ष्ण गंध होती है।
![]()
इसी तरह से हाइड्रोजन ब्रोमाइड भी बनाया जा सकता है जब एक ब्रोमाइड को सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म करते हैं । अर्थात् अम्ल प्रबल ऑक्सीकारक है जो HBr को Br, में ऑक्सीकृत करता है जिससे लाल वाष्प निकलती है।
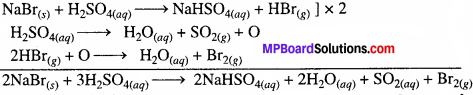
HCl(g) पूर्णतः स्थायी है और क्लोरीन में ऑक्सीकृत नहीं होता है सान्द्र सल्फ्यूरिक अम्ल के साथ।
प्रश्न 13.
निम्नलिखित अभिक्रियाओं में ऑक्सीकृत होने वाले, अपचयित होने वाले पदार्थ, ऑक्सीकारक तथा अपचायक की पहचान कीजिए –
(a) 2AgBr(s) + C6H6O2(aq)) → 2Ag(s) + 2HBr(aq) + C6H4O2(aq)
(b) HCHO(l) + 2[Ag(NH3)2]+(aq) + 3OH–(aq) → 2Ag(s) + HCOO–(aq) + 4NH3(aq) + 2H2O
(c) HCHO(l) + 2Cu2+(aq) + 5OH–(aq) → Cu2O(s) + HCOO–(aq) + 3H2O(l)
(d) N2H4(l) + 2H2O2(l) → N2(g) + 4H2O(l)
(e) Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l)
उत्तर:
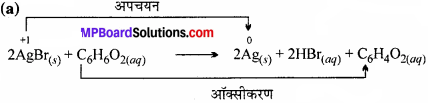
AgBr अपचयित होता है ऑक्सीकारक की तरह कार्य करता है।
C6H6O2, ऑक्सीकृत होता है एवं अपचायक की तरह कार्य करता है।

HCHO ऑक्सीकृत होता, अपचायक की तरह कार्य करता है।
[Ag(NH3)2]+ अपचयित होता है एवं ऑक्सीकारक का कार्य करता है।
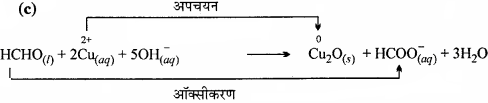
Cu2+(हलीय) अपचयित होता है ऑक्सीकारक की तरह कार्य करता है।
HCHO ऑक्सीकृत होता है एवं अपचायक की तरह कार्य करता है।
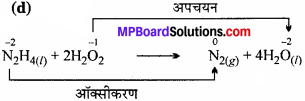
H2O2अपचयित हुआ, ऑक्सीकारक की तरह कार्य करता है।
N2H4 ऑक्सीकृत हुआ, अपचायक की तरह कार्य करता है।

PbO2 अपचयित हुआ, ऑक्सीकारक की तरह कार्य करता है।
Pb ऑक्सीकृत हुआ, अपचायक की तरह कार्य करता है।
![]()
प्रश्न 14.
निम्नलिखित अभिक्रियाओं में एक ही थायोसल्फेट आयन S2\(O \frac{2-}{3}\),आयोडीन तथा ब्रोमीन से अलग-अलग प्रतिक्रिया क्यों करता है –
1. 2S2\(\mathrm{O}_{3(a q)}^{2-}\) + I2(s) → S2\(\mathrm{O}_{6(a q)}^{2-}\)+ 2I–(aq)
2. S\(\mathrm{O}_{3(a q)}^{2-}\) + 2Br2(l) + 5H2O(l) → 2S\(\mathrm{O}_{4(a q)}^{2-}\) +4Br–(aq) + 10H+4(aq)
उत्तर:
Br2 I2 की तुलना में प्रबल ऑक्सीकारक है यह S2\(O \frac{2-}{3}\) को SO\(O \frac{2-}{4}\) अर्थात् सल्फर की +2 अवस्था से +6 अवस्था में ऑक्सीकृत कर देता है। अतः I2 दुर्बल ऑक्सीकारक है। S2\(O \frac{2-}{3}\) को S4\(O \frac{2-}{6}\) – आयन में ऑक्सीकृत होता है अर्थात् सल्फर की +2 से +2.5 अवस्था में।
प्रश्न 15.
कारण बताओ कि क्यों हैलोजनों में फ्लुओरीन सबसे अच्छा ऑक्सीकारक है जबकि हैलोजन अम्लों में HI सबसे अच्छा अपचायक ?
उत्तर:
अपचयन विभव जितना अधिक होगा उसका ऑक्सीकरण क्षमता उतनी ही अधिक होगी इसलिये ऑक्सीकरण क्षमता निम्न क्रम में घटती है –
![]()
अतःF2 प्रबल ऑक्सीकारक है। इस बात को इस आधार पर सहारा मिलता है कि F, सभी हैलोजनों को उनके लवण विलयन (आयन) से विस्थापित करती है।
2KCl + F2 → 2KF + Cl, 2KI + F → 2KF + I2यदि अधातु प्रबल ऑक्सीकारक हो तो उसका समरूपी ऐनायन दुर्बल अपचायक होगा। अत: F2प्रबल ऑक्सीकारक है इसलिये F-आयन दुर्बल अपचायक है। HX(या X– आयन) की अपचयन क्षमता निम्न क्रम में घटती है –
HI > HBr > HCl > HF
I2दुर्बल ऑक्सीकारक तथा I– एक प्रबल अपचायक है।
प्रश्न 16.
निम्नलिखित अभिक्रिया क्यों संभव है –
Xe\(\mathbf{O}_{6}^{4}\) + 2F–(aq) + 6H+(aq) → XeO3(aq) + F2(g)+ 3H2O(l)
यौगिक Na4 XeO6(जिसका Xe\(\mathbf{O}_{6}^{4}\) एक भाग है) के बारे में क्या निष्कर्ष निकलता है ? इस अभिक्रिया से K2MnF6 बनाया जा सकता है।
उत्तर:
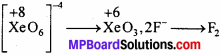
Xe का ऑक्सीकरण संख्या + 8 से + 6 घटता है। यह सिद्ध करता है कि XeO4-6एक ऑक्सीकारक है, ये F को F2 में ऑक्सीकृत करता है। यह अभिक्रिया सिद्ध करती है कि Na4 xeO6 (या Xe\(\mathbf{O}_{6}^{4}\))F2 की तुलना में प्रबल ऑक्सीकारक है।
प्रश्न 17.
निम्नलिखित अभिक्रियाओं में Ag+ तथा Cu2+ आयन के व्यवहार के बारे में क्या निष्कर्ष निकाला जा सकता है –
1. H3PO2(aq) + 4AgNO3(aq) + 2H2O(l) → H3PO4(aq) + 4Ag(s) + 4HNO3(aq)
2. H3PO2(aq) + 2CuSO4(s) + 22O(l) → H3PO4(aq) + 2Cu(s) + 2H2SO4(aq)
3. C6H5CHO(l) + 2[Ag(NH3)2 \(\mathrm{I}_{(a q)}^{+}\) + 3OH–(aq) → C6H6COO–(aq) + 2Ag(s) + 4NH3(aq) + 2H2O(l)
4. C6H5CHO(l) + \($2 \mathrm{Cu}_{(a q)}^{2+}$\) + 5OH–(aq) → No change
उत्तर:
(a) H3PO2(aq) + 4AgNO3(aq) + 2H2O(l) → H3PO4(aq) + 4Ag0(s) + 4HNO3(aq)
Ag+ आयन Ag में अपचयित हो जाता है इसलिये Ag+ एक ऑक्सीकारक की तरह कार्य करता है तथा ये H3PO2 को H3PO4 में ऑक्सीकृत करता है।
(b) H3PO2(aq) + 2\(\overset { +2 }{ cu } \)SO4(s) + 22O(l) → H3PO4(aq) + 2Cu(s) + 2H2SO4(aq)
Cu2+ आयन Cu(s) में अपचयित होता है। अत: Cu2+ ऑक्सीकारक की तरह कार्य करता है तथा H3PO2 को H3PO4 में ऑक्सीकृत करता है।
(c) C6H5CHO(l) + 2[\(\overset { +1 }{ ag } \)(NH3)]2+(aq)) + 3OH–(aq) → C6H6COO–(aq) + 2Ag(s)+ 4NH3(aq) + 2H2O(l)
उपर्युक्त क्रिया में Ag+ आयन Ag(s)अपचयित होता है अर्थात् यह ऑक्सीकारक का कार्य करता है, ये C6H5CHO(l) को CHECOO–(aq) में ऑक्सीकृत करता है।
(d) C6H5CHO(l) + 2Cu2+(aq) + 5OH–(aq) → कोई परिवर्तन नहीं, यह रेडॉक्स अभिक्रिया नहीं है।
![]()
प्रश्न 18.
आयन इलेक्ट्रॉन विधि से निम्नलिखित रेडॉक्स अभिक्रियाओं को संतुलित कीजिए –

उत्तर:
(a) पद 1.
अभिक्रिया के लिये ढाँचागत (कंकाल) समीकरण है –
![]()
पद 2.
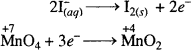
दोनों अर्द्ध अभिक्रिया लिखने पर,
ऑक्सीकरण अर्द्ध अभिक्रिया-

अपचयन अर्द्ध अभिक्रिया –
![]()
पद 3.
अर्द्ध अभिक्रिया में परमाणु को संतुलित करने पर,
2I–(aq)→ I2(s)
दूसरे समीकरण में इस पद की आवश्यकता नहीं है क्योंकि Mn संतुलित है।
पद 4.
अर्द्ध अभिक्रिया में इलेक्ट्रॉन योग द्वारा आवेश संतुलित करना –
पद 5.
ऑक्सीजन तथा H परमाणुओं को संतुलित करना –
MnO–4(aq) + 3e– → MnO2(s) + 2H2O(l))
H परमाणुओं को संतुलित करने के लिये हम 4H+ आयनों को बायें तरफ जोड़ते हैं –
MnO–4+ 4H–(aq) → MnO2(s) + 2H2O(l)
अभिक्रिया क्षारीय माध्यम में हो रही है इसलिये 4H+ आयन के लिये हम 4OH– आयनों को समीकरण के दोनों तरफ जोड़ते हैं –
MnO–4(aq) + 4H+(aq) + 4OH–(aq) → MnO2(s)+ 2H2O(l) + 4OH–(aq)
H+ तथा OH– आयन पानी बनाते हैं इसलिये परिणामी समीकरण होगा –
MnO–4(aq) + 2H2O(aq) + 3e– → MnO2(s)) + 4OH–(aq)
पद 6.
दोनों अर्द्ध समीकरणों में इलेक्ट्रॉनों को संतुलित करने पर,
2I–(aq) → I2(s) ) + 2e– ………….(i)
MnO–4(aq) + 2H2O(aq) + 3e– → MnO2(s) + 4OH–(aq) ………….(ii)
संमी. (i) को 3 तथा समी. (ii) को 2 से गुणा कर योग करने पर,
6I–(aq) + 2MnO–4(aq) + 4H2O(l)→ 3I2(s) + 2MnO2(s) + 8OH–(aq)
(b) उपर्युक्त समीकरण के बतायी गई विधि के उपयोग द्वारा ऑक्सीकारक अर्द्ध समीकरण होगा –
SO2(g) + 2H2O(l) → HSO–4(aq) + 3H+(aq) + 2e– ………….(i)
अपचयन अर्द्ध समीकरण होगा –
MnO–4(aq)+ 8H–(aq) + 5e– → Mn2+(aq) + 5HSO+4(aq) ………….(ii)
समी. (i) को 5 तथा समी. (ii) को 2 से गुणा कर योग करने पर,
2MnO+4(aq)+ 5SO2(g) + 2H2O(l) + H+(aq) → 5HSO–4(aq) + 2Mn2+(aq)
(c) ऊपर वर्णित प्रथम पाँच पदों के उपयोग द्वारा ऑक्सीकरण अर्द्ध समीकरण होगा –
Fe2+(aq) → Fe3+(aq) + e– ………….(i)
अपचयन अर्द्ध समीकरण होगा –
H2O2(aq) + 2H+(aq) + 2e– → 2H2O(l) ………….(ii)
समीकरण (i) को 2 से गुणा करके समीकरण (ii) से जोड़ने पर प्राप्त होता है –
H2O2(aq) + 2Fe2+(aq) + 2H+ → 2Fe3+(aq)+ 2H2O(l)
(d) उपर्युक्त विधि द्वारा वर्णित विधि के 5 पदों के प्रयोग द्वारा संतुलित अर्द्ध अभिक्रिया है –
ऑक्सीकरण अर्द्ध समीकरण –
SO2(g) + 2H2O(l) → SO2-4(aq) + 4H+4(aq) + 2e– ………….(i)
अपचयन अर्द्ध समीकरण –
Cr2O2-7(aq)+ 14H–(l) + 6e– → 2Cr3+(aq) + 7H2O(l) ………….(ii)
समीकरण (i) का 3 से गुणा करके समीकरण (ii) के साथ जोड़ने पर,
Cr2O2-7(aq) + 3SO2(g)+ 2H+(aq) → 2Cr+(s) + 3SO2-4(aq)+ H2O(l).
![]()
प्रश्न 19.
क्षारीय माध्यम में निम्नलिखित रेडॉक्स अभिक्रियाओं को आयन-इलेक्ट्रॉन विधि तथा ऑक्सीकरण संख्या विधि से संतुलित कीजिए। क्रियाओं में ऑक्सीकारक तथा अपचायक की पहचान कीजिए –
(a) P4(s) + OH–(aq) → PH3(aq) + H2PO–2(aq)
(b) NH2H4(l) + ClO3(aq) → NO(g) + Cl–(g)
(c) Cl2 O7(g) + H2O2(aq) → ClO–2(g) + O2(g) + H+
उत्तर:
(a) ऑक्सीकरण संख्या विधि –
![]()
अतः O.N. में कमी या वृद्धि को संतुलित करने के लिये PH, को 1 से तथाHPO, को 3 से गुणा करने पर –
P4(s) + OH–(aq) → PH3(s) + 3H2PO–2(aq)
क्षारीय माध्यम में ‘O’ तथा ‘H’ को संतुलित करने पर,
P4(s) + 3OH–(aq) + 3H2O(g) → PH3(g) + 3H2PO–2(aq)
आयन – इलेक्ट्रॉन विधि –
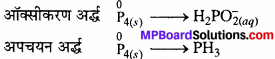
ऑक्सीकरण अर्द्ध में P परमाणु को संतुलित करना –
P4 →4H2 PO–2(aq)
O.N. को e जोड़कर संतुलित करना –
P4(s) →4H2PO–2 + 4e–
8 – OH आयन को जोड़कर आवेश संतुलित करना –
P4 + 8OH–(aq) → 4H2 PO–2 + 4e–
‘H’ तथा ‘O’ स्वतः संतुलित हो जाते हैं।
अब अपचयन अर्द्ध P4(s) → PH3(g)
P परमाणु को संतुलित करना P4(s) → 4PH3(g)
e– जोड़कर O.N. को संतुलित करना –
P4(s) + 12e– → 4PH3(g)
आवेश को OH– द्वारा संतुलित करना –
P4(s) + 12e– → 4PH3(g) + 12OH–(aq)
H2O को जोड़कर ‘O’ को संतुलित करना –
P4(s) + 12e– + 12H2O(l) → 4PH3(g) + 12OH–(aq)
इलेक्ट्रॉनों की कमी या वृद्धि को समान करने के लिये ऑक्सीकरण अर्द्ध को 3 से गुणा कर संयुक्त करने पर –
4P4(s) + 24OH–(aq) + 12H2O(l) → 4PH3(g)+ 12H2PO–2(aq) + 12OH–(aq)
या
P4(s) +3OH–(aq) + 3H2O(l) → PH3(g)+ 3H2PO–2(aq)
(b) ऑक्सीकरण संख्या विधि –
N के O.N. में कुल कमी N = 2 x 4 = 8
Cl के O.N. में कुल वृद्धि Cl = 1 x 6 = 6
O.N. को संतुलित करने के लिए N.H, को 3 से तथा ClO3 को 4 से गुणा करने पर –
3N2H4(l) + 4CIO–3(aq) → NO(g) + Cl–(aq)
N तथा Cl अणु को संतुलित करना –
3N2H4(l) + 4ClO–3(aq) → 6NO(g) + 4Cl–(aq)
6H2O को जोड़कर O अणु को संतुलित करना –
3N2H4(l) + 4ClO–3(aq) → 6NO(g) + 4Cl–(aq) + 6H2O(l)
यह ही आवश्यक संतुलित समीकरण है।
आयन-इलेक्ट्रॉन विधि –
![]()
N परमाणु को संतुलित करना –
N2H4(l)→ 2NO(g)
O.N. को जोड़कर संतुलित करना –
N2H4(l) → 2NO(g) + 8e –
आवेश को OH जोड़कर संतुलित करना –
N2H4(l) + 8OH–(aq) → 2NO(g) + 8e –
‘O’ परमाणु को संतुलित करना –
N2H4(l) + 8OH–(aq) → 2NO(g) + 6H2O2(l) + 8e–

O.N. को इलेक्ट्रॉन जोड़कर संतुलित करना –
CIO–3(aq) + 6e– → Cl–(aq)
आवेश को OH जोड़कर संतुलित करना –
CIO–3(aq) + 6e– → Cl–(aq) + 6OH–(aq)
O’ परमाणु को संतुलित करना –
ClO–3(aq) + 3H2O(l) + 6e– → Cl–(aq) + 6OH–(aq)
e– के कमी या वृद्धि को अपचयन अर्द्ध को 4 से तथा ऑक्सीकरण अर्द्ध को 3 से गुणा कर समान करने पर –
3N2H4(l) + 4ClO–3(aq) + 6e– → Cl–(aq) + 6H2O(l)
(c) ऑक्सीकरण संख्या विधि –

O.N. में कमी व वृद्धि को H2O2 को 4 से गुणा कर संतुलित करने पर –
Cl2O7+ 4H2O2 → ClO–2 + O2
दूसरे परमाणुओं को संतुलित करने पर –
Cl2O7(g) + 4H2O2(aq) → 2ClO2O2(aq) + 4O2(g)
आवेश संतुलित करने पर –
Cl2O7(g) + 4H2O2(aq) + 2OH–(aq) → 2CIO–2(aq) + 4O2(g)
‘H’ संतुलित करने पर –
Cl2O7(g) + 4H2O2(aq) + 2OH–(aq) → 2CIO–2(aq) + 4O2(g) + 5H2O
आयन-इलेक्ट्रॉन विधि –
ऑक्सीकरण अर्द्ध समीकरण –
![]()
2 इलेक्ट्रॉन जोड़कर O.N. को संतुलित करना –
H2O2(aq) → O2(g) + 2e–
2OH– जोड़कर आवेश को संतुलित करना –
H2O2(aq) + 2OH–(aq) → O2(g) + 2e–
2H2O जोड़कर ऑक्सीजन अणु को संतुलित करना –
H2O2(aq) + 2OH–(aq) → O2(g) + 2H2O(l) + 2e– ………(i)
अपचयन अर्द्ध समीकरण –
![]()
Cl अणु को संतुलित करना –
Cl2O7(g) → 2ClO–2(aq)
8 इलेक्ट्रॉनों को जोड़कर O.N. को संतुलित करना
Cl2O7(g) + 8e– → 2ClO–2(aq)
6OH– जोड़कर आवेश को संतुलित करना –
ClO2O7(g) + 8e– → 2CIO–2(aq) + 6OH–(aq)
3H2O जोड़कर ऑक्सीजन अणु को संतुलित करना –
Cl2O7(g) + 3H2O(l) + 8e– → 2CIO–2(aq) + 6OH–(aq) ………(ii)
संतुलित समीकरण, समीकरण (i) में 4 का गुणा करके और समीकरण (ii) में जोड़कर प्राप्त किया जा सकता है –
Cl2O7(g) + 4H2O2(aq) + 2OH–(aq) → 2CIO–2(aq)+ 4O2(g) + 5H2O(l)
![]()
प्रश्न 20.
निम्नलिखित अभिक्रिया के बारे में चार सूचनाएँ लिखिए –
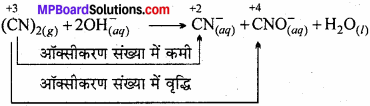
(CN)2(g) + 20H–(aq) → CN–(aq) + CNO–(aq) + H2O(l)
उत्तर:
- यह एक विषमानुपाती अभिक्रिया है।
- अभिक्रिया क्षारीय माध्यम में होती है।
- N का ऑक्सीकरण संख्या (CN)2 में -3 तथा CN में -2 तथा CNO में -5 है।
- सायनोजन (CN)2 एक साथ CN आयन में अपचयित तथा CNO– आयन में ऑक्सीकृत होता है।
प्रश्न 21.
Mn3+ आयन एक अस्थायी आयन है तथा विलयन में विषमानुपाती अपघटन से Mn3+ MnO2 तथा H+ आयन देता है। अभिक्रिया का संतुलित समीकरण लिखिए।
उत्तर:
2Mn3+ + 2H2O → Mn2+ + MnO2 + 4H+
प्रश्न 22.
निम्नलिखित तत्वों पर विचार कीजिए –
Cs, Ne, I, F
उस तत्व की पहचान करो जो –
- केवल ऋण ऑक्सीकरण अवस्था देता है।
- जो केवल धन ऑक्सीकरण अवस्था देता है।
- जो धन तथा ऋण दोनों अवस्थाएँ देता है।
- जो कोई भी ऑक्सीकरण अवस्था प्रदर्शित नहीं करता।
उत्तर:
- F(-1); यह सर्वाधिक विद्युत्ऋणी तत्व है।
- Cs(+1); यह सर्वाधिक विद्युत्धनी तत्व है।
- I; (-1 से +7)
- Ne; यह शून्य समूह का तत्व है।
प्रश्न 23.
जल को क्लोरीन से शुद्ध कर पेयजल बनाया जाता है। अधिक क्लोरीन हानिकारक है, उसे SO2 गैस से अभिकत करके अलग किया जाता है। जल में होने वाली इस रेडॉक्स अभिक्रिया के लिए संतुलित रासायनिक समीकरण लिखिए।
उत्तर:
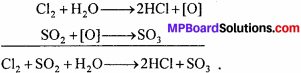
प्रश्न 24.
आवर्त तालिका का अवलोकन करते हुए निम्नांकित के उत्तर लिखिए –
(a) ऐसी संभावित अधातुओं को छाँटो जो विषमानुपाती अपघटन देती हैं।
(b) ऐसी तीन धातुओं को छाँटो जो विषमानुपाती अपघटन देती हैं।
उत्तर:
(a) अधातु P4 Cl2 Br2 I2 तथा S8 द्वारा प्रदर्शित विषमानुपाती (अपघटन) अभिक्रियायें हैं –
- P4(s) + 3OH–(aq) + 3H2O(l) → PH3(g) + 3H2PO–2(aq)
- Cl2(aq) + 2OH–(aq) → Cl–(aq) + CIO–(aq) + H2O
- S8(s) + 12HO–(aq) → 4S– + 2SO2O2-(aq)+ 6H2O(l)
(b) तीन धातुएँ जो विषमानुपाती अपघटन अभिक्रिया देती हैं –
Cu2+, Ga+ In+
- 2Cu+(aq)→ Cu++(aq)+ Cu(s)
- 3Ga+(aq) → Ga3+(aq) + 2Ga(s)
- 3In+(aq) → In3+(aq) + 2In(s).
प्रश्न 25.
नाइट्रिक अम्ल के निर्माण में (ओस्टवाल्ड विधि) प्रथम पद में अमोनिया का ऑक्सीजन गैस से ऑक्सीकरण होकर नाइट्रिक ऑक्साइड तथा वाष्प बनती है। 10.00 ग्राम अमोनिया तथा 20.00 ग्राम ऑक्सीजन से अधिक से अधिक कितने ग्राम नाइट्रिक ऑक्साइड बनेगी?
हल:
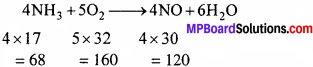
∴ 68 ग्राम NH3 से NO = 120 ग्राम
∴ 10 ग्राम NH3 से NO = \(\frac { 120 × 10 }{68 }\)=17.65 ग्राम
∴ 160 ग्राम ऑक्सीजन से NO = 120 ग्राम
∴ 20 ग्राम ऑक्सीजन से NO = \(\frac { 120 × 20 }{160 }\) = 15 ग्राम
प्रश्न 26.
सारणी में दिये प्रमाणिक इलेक्ट्रोड विभव के उपयोग करते हुये बताइये कि अभिक्रिया संभव है या नहीं –
1. Fe3+(aq) और I–(aq)
2. Ag+(aq और Cu–(s)
3. Fe3+(aq) और Br–(aq)
4. Ag(s) और Fe3+(aq)
5. Br2(aq) और Fe3+(aq)
उत्तर:
1. Fe3+(aq) + I–(aq) → Fe2+(aq) + \(\frac { 1 }{ 2 }\) I2
![]()
मान धनात्मक है अतः अभिक्रिया संभव है।
2. Ag+(aq) + Cu(s) →Ag0+ Cu+2
![]()
मान धनात्मक है अतः अभिक्रिया संभव है।
3. Fe3+(aq) + Br–(aq)→ Fe2+(aq) + Br2(गैस)
![]()
मान ऋणात्मक है, अतः अभिक्रिया संभव नहीं है।
4. Ag(s) + Fe3+(aq) → Ag+(aq) + Fe2+(aq)
![]()
मान ऋणात्मक है, अतः अभिक्रिया संभव नहीं है।
5. Br2(aq) + 2Fe2+(aq) → 2Fe3+(aq) + 2Br–(aq)
![]()
मान धनात्मक है अतः अभिक्रिया संभव है।
प्रश्न 27.
निम्नलिखित प्रत्येक के विद्युत् – अपघटन के उत्पादों की भविष्यवाणी कीजिये –
(a) सिल्वर इलेक्ट्रोड के साथ AgNO3 का जलीय विलयन
(b) प्लेटिनम इलेक्ट्रोड के साथ AgNO3 का जलीय विलयन
(c) प्लेटिनम इलेक्ट्रोड के साथ H2SO4 का तनु विलयन
(d) प्लेटिनम इलेक्ट्रोड के साथ CuCI2 का जलीय विलयन।
उत्तर:
(a) कैथोड पर – Ag+ +e – →Ag(s)
एनोड पर – Ag → Ag+(aq) + e –
(b) कैथोड पर – Ag+ +e – →Ag(s)
एनोड पर – 2OH– → H2O + \(\frac { 1 }{ 2 }\) O2 + 2e–
(c) कैथोड पर – 2H+ + 2e– → H2
एनोड पर – 20H– → H2O +\(\frac { 1 }{ 2 }\)O2 + 2e–
(d) कैथोड पर – Cu+2 + 2e– → Cu(s)
एनोड पर – 2Cl– → Cl2(g) + 2e–.
प्रश्न 28.
निम्नलिखित धातुओं को इस क्रम में व्यवस्थित कीजिये जिसमें वे एक दूसरे को उनके लवणों के विलयनों से विस्थापित करते हैं –
Al, Cu, Fe, Mg और Zn.
उत्तर:
Mg, Zn, Fe, Cu.
प्रश्न 29.
प्रमाणिक इलेक्ट्रोड विभव दिये गये हैं –
K+/ K = -2.93V,
Ag+/ Ag = 0.80V
Hg 2+/ Hg = 0.79V
Mg2+/ Mg = -2.37V,
Cr3+/ Cr = 0.74V
इन धातुओं को उनके बढ़ते अपचयन क्षमता में व्यवस्थित कीजिये।
उत्तर:
अपचयन विभव का कम मान (प्रमाणिक अपचयन विभव का ज्यादा ऋणात्मक होना) होने पर अपचयन क्षमता अधिक होगी –
Ag < Hg
प्रश्न 30.
गैल्वेनिक सेल जिसमें निम्न अभिक्रिया Zn(s) + 2Ag+(aq) → Zn2+(aq) + 2Ag(s) होती है, दर्शाये तथा प्रदर्शित कीजिये –
- कौन – सा इलेक्ट्रोड ऋण आवेशित है।
- सेल में धारा को ले जाने वाला है।
- प्रत्येक इलेक्ट्रोड की अलग-अलग अभिक्रियायें।
उत्तर:
- Zn(s) |Zn2+(aq)|| Ag+(aq) | Ag(s) एनोड पर ऑक्सीकरण तथा कैथोड पर अपचयन होता है।
- इलेक्ट्रॉन।
- Zn(s) → Zn2+ + 2e– (एनोड)
2Ag+(aq) + 2e– → 2Ag(s) (कैथोड)।
![]()
अपचयोपचय अभिक्रियाएँ अन्य महत्वपूर्ण प्रश्न
अपचयोपचय अभिक्रियाएँ वस्तुनिष्ठ प्रश्न
प्रश्न 1.
सही विकल्प चुनकर लिखिए –
प्रश्न 1.
धातुएँ जो डेनियल सेल में प्रयुक्त होती हैं –
(a) N और Cu
(b) Zn और Ag
(c) Ag और Cu
(d) Zn और Cu.
उत्तर:
(d) Zn और Cu.
प्रश्न 2.
निम्न में से कौन-सा प्रबल अपचायक है –
(a) F–
(b) Cr–
(c) Br–
(d) I–.
उत्तर:
(d) I–.
प्रश्न 3.
वैद्युत अपघटन में ऑक्सीकरण होता है –
(a) ऐनोड पर
(b) कैथोड पर
(c) दोनों इलेक्ट्रोडों पर
(d) इनमें से कोई नहीं।
उत्तर:
(a) ऐनोड पर
प्रश्न 4.
निम्न कथनों में से कौन – सा सही है ? गैल्वेनिक सेल परिवर्तित करता है –
(a) रासायनिक ऊर्जा को विद्युत् ऊर्जा में
(b) विद्युत् ऊर्जा को रासायनिक ऊर्जा में
(c) धातु को उसकी तत्व अवस्था से संयुक्त अवस्था में
(d) विद्युत् – अपघट्य को व्यक्तिगत आयनों में।
उत्तर:
(a) रासायनिक ऊर्जा को विद्युत् ऊर्जा में
प्रश्न 5.
K,MnO में Mn की ऑक्सीकरण संख्या है –
(a) +2
(b) +6
(c) +7
(d) 0.
उत्तर:
(b) +6
प्रश्न 6.
Ni(CO) में Ni की ऑक्सीकरण संख्या है –
(a) 0
(b)+2
(c) +1
(d) -1.
उत्तर:
(a) 0
प्रश्न 7.
नाइट्रोजन की ऑक्सीकरण अवस्था किसमें उच्चतम है –
(a) N3H
(b) NH2OH
(c) N2H4
(d) NH3
उत्तर:
(a) N3H
प्रश्न 8.
K4[Fe (CN)6] में Fe की ऑक्सीकरण अवस्था है –
(a) +2
(b) +6
(c) +3
(d) +4.
उत्तर:
(a) +2
![]()
प्रश्न 9.
H2S2O8, में S की ऑक्सीकरण संख्या है –
(a) +2
(b) +4
(c) +6
(d) 7.
उत्तर:
(c) +6
प्रश्न 10.
किस यौगिक में Cl की ऑक्सीकरण संख्या +1 है –
(a) Cl2O
(b) HCl
(c) ICl
(d) HClO4
उत्तर:
(a) Cl2O
प्रश्न 11.
सबसे आसानी से अपचयित होने वाला हैलोजन है –
(a) F2
(b) Cl2
(c) Br2
(d) I2
उत्तर:
(a) F2
प्रश्न 12.
CCl4 में C की ऑक्सीकरण संख्या है –
(a) +4
(b) -4
(c) +6
(d) -6.
उत्तर:
(a) +4
प्रश्न 13.
ऑक्सीकारक पदार्थ –
(a) इलेक्ट्रॉन ग्राही है
(b) इलेक्ट्रॉन दाता है
(c) प्रोटॉन ग्राही है
(d) न्यूट्रॉन ग्राही है।
उत्तर:
(a) इलेक्ट्रॉन ग्राही है
प्रश्न 14.
अभिक्रिया 3ClO–(aq) → ClO–3 + 2Cl– उदाहरण है –
(a) ऑक्सीकरण
(b) अपचयन
(c) असमानुपातन
(d) विलोपन।
उत्तर:
(c) असमानुपातन
![]()
प्रश्न 15.
S8, S2, F2, H2S में S की ऑक्सीकरण संख्या है –
(a) 0, +1, -2
(b) +2, +1, -2
(c) 0, +1, +2
(d) -2, +1, -2.
उत्तर:
(a) 0, +1, -2
प्रश्न 2.
रिक्त स्थानों की पूर्ति कीजिए –
- इलेक्ट्रॉन ग्रहण करने वाली अभिक्रिया ……….. कहलाती है।
- वायुमण्डलीय गैसों व नमी द्वारा धातुओं में होने वाला अवांछित परिवर्तन ……….. कहलाता है।
- विद्युत् रासायनिक श्रेणी में धातुओं की अपचयन क्षमता ऊपर से नीचे जाने पर ……….. है।
- सबसे प्रबल अपचायक तत्व ……….. है।
- सेल की साम्यावस्था पर Ecell का मान ……….. होता है।
- सोडियम अमलगम में सोडियम की ऑक्सीकरण संख्या ……….. है।
- Cr(CO)2 में Cr की ऑक्सीकरण संख्या ……….. है।
- SiH4, में Si की ऑक्सीकरण संख्या ……….. है।
- OF2, और O2, F2, में O की ऑक्सीकरण संख्या क्रमश ……….. है।
- Cu(OCl) Cl में Cl की ऑक्सीकरण संख्या क्रमश ……….. है।
उत्तर:
- अपचयन
- संक्षारण
- घटती
- लीथियम
- शून्य
- शून्य
- शून्य
- – 4
- +2, +1
- +1, -1.
![]()
प्रश्न 3.
उचित संबंध जोड़िए –

उत्तर:
- (d) लवण सेतु
- (f) [Ni (CN)4]2-
- (e) एनोड
- (a) नर्नस्ट समीकरण
- (c) 0.00V
- (b) सिल्वर
प्रश्न 4.
एक शब्द / वाक्य में उत्तर दीजिए –
- लोहा, ताँबे को उसके लवण के विलयन से विस्थापित क्यों करता है ?
- Cl2O में क्लोरीन की ऑक्सीकरण अवस्था कितनी है ?
- किसी विद्युत् अपघट्य को जल में विलेय करने पर वह आयनों में क्यों विभाजित हो जाता है ?
- लवण – सेतु बनाने हेतु KNO3, के संतृप्त विलयन का उपयोग किया जाता है, क्यों ?
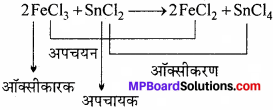
- SnCl2 + 2FeCl3 → SnCl4 + 2FeCl2, में ऑक्सीकरण कौन – सा यौगिक है ?
- XeO3, में Xe की ऑक्सीकरण संख्या कितनी है ?
उत्तर:
- क्योंकि लोहे का मानक अपचयन विभव ताँबे के मानक अपचयन विभव से कम है।
- +1
- क्योंकि जल के कारण आयनों के मध्य स्थिर वैद्युत आकर्षण बल टूट जाता है।
- क्योंकि K+ तथा NO3– आयनों का वेग लगभग बराबर होता है।
- FeCl3
- +6.
![]()
अपचयोपचय अभिक्रियाएँ अति लघु उत्तरीय प्रश्न
प्रश्न 1.
ऑक्सीकरण प्रक्रम किसे कहते हैं ? रेडॉक्स अभिक्रिया उदाहरण सहित समझाइये।
उत्तर:
ऑक्सीजन या ऋण विद्युती तत्व का योग या हाइड्रोजन अथवा धन विद्युती तत्व का त्याग ऑक्सीकरण कहलाता है।
2Mg + O2 → 2MgO [ऑक्सीजन का योग]
2FeCl + Cl2 → 2FeCl, [ऋण विद्युती तत्व का योग]
H2S + Cl2 → S + 2HCl [हाइड्रोजन का त्याग]
2KI + H2O2 → 2KOH + I2 [धन विद्युती तत्व का त्याग]
प्रश्न 2.
अपचयन या अवकरण प्रक्रम किसे कहते हैं ? उदाहरण सहित समझाइये।
उत्तर:
किसी पदार्थ द्वारा हाइड्रोजन अथवा धन विद्युती तत्व ग्रहण करने की प्रवृत्ति या ऑक्सीजन अथवा ऋण विद्युती तत्व का त्याग करने की प्रक्रिया अपचयन कहलाती है।
CuO + H2 → Cu+H2O[ऑक्सीजन का त्याग]
2FeCl3 + H2S → 2FeCl2 + 2HCl + S [ऋण विद्युती तत्व का त्याग]
C2 + H2 S → 2HCl + S [हाइड्रोजन का योग]
S + Fe → FeS [धन विधुती तत्व का योग]
प्रश्न 3.
AgF2 एक अस्थिर यौगिक है। यदि यह बन जाए, तो यह यौगिक एक अति शक्तिशाली ऑक्सीकारक की भाँति कार्य करता है। क्यों?
उत्तर:
AgF2 में Ag + 2 ऑक्सीकरण अवस्था में है। यह अत्यधिक अस्थायी है यह शीघ्रता से इलेक्ट्रॉन ग्रहण कर Ag + 1 ऑक्सीकरण अवस्था प्राप्त करता है क्योंकि Ag* में पूर्णतया भरे हुए विन्यास का होता है जो कि अधिक स्थायी है।
Ag2+ + e– →Ag+ यही कारण है कि AgF2 एक प्रबल ऑक्सीकारक की भाँति व्यवहार करता है।
प्रश्न 4.
निम्नलिखित अभिक्रियाओं में एक ही अपचायक थायोसल्फेट, आयोडीन तथा ब्रोमीन से अलग-अलग प्रकार से अभिक्रिया क्यों करता है –
2S2O2-3(aq) + I2(s) → S4O2-6(aq) + 2I–(aq)
S2O2-3(aq) + 2Br2(l) + 5H2O(l) → 2SO2-4(aq) + 4Br–(aq) + 10H+(aq)
उत्तर:

ब्रोमीन, आयोडीन की अपेक्षा प्रबल ऑक्सीकारक है। यह S2O32-की S (+2) कोSO42 (+2) में ऑक्सीकृत करता है। जबकि आयोडीन S2O2-3 में S(+2) को S4O2-6 में S(+2.5) में ऑक्सीकृत कर पाता है। हम देखते हैं कि SO2-4 की अपेक्षा S4O2-6 में S की ऑक्सीकरण संख्या कम है। यही कारण है एक ही अपचायक थायोसल्फेट, आयोडीन तथा ब्रोमीन से अलग – अलग व्यवहार करता है।
![]()
प्रश्न 5.
S4O2-6 की संरचना से स्पष्ट कीजिए सल्फर की ऑक्सीकरण अवस्था (+ 5) है।
उत्तर:
दो केन्द्रीय सल्फर परमाणुओं की ऑक्सीकरण संख्या शून्य है क्योंकि S-S बंध बनाने वाला इलेक्ट्रॉन युग्म केन्द्र में रहेगा। अतः शेष सल्फर परमाणु जो संरचना में (सिरों) पर है उनकी ऑक्सीकरण संख्या (+5) होगी।
प्रश्न 6.
विद्युत् रासायनिक श्रेणी किसे कहते हैं ?
उत्तर:
विभिन्न तत्वों एवं आयनों को उनके मानक अपचयन विभव के मानों के बढ़ते हुए क्रम में व्यवस्थित करने से जो श्रेणी प्राप्त होती है, उसे विद्युत् रासायनिक श्रेणी कहते हैं।
प्रश्न 7.
लवण सेतु क्या है ? इसके दो कार्य लिखिए।
उत्तर:
किसी विद्युत् अपघट्य जैसे KCl या KNO3 तथा अगर-अगर विलयन की जेली से भरी हुई U आकार की नली को लवण सेतु कहते हैं।
कार्य:
- यह परिपथ को पूर्ण करता है तथा धारा को प्रवाहित होने देता है।
- दोनों पात्रों में उपस्थित विलयन की उदासीनता को बनाये रखता है।
प्रश्न 8.
इलेक्ट्रॉन स्थानान्तरण के आधार पर ऑक्सीकरण और अपचयन को स्पष्ट कीजिए।
उत्तर:
इलेक्ट्रॉनिक सिद्धान्त के अनुसार, ऑक्सीकरण प्रक्रम में कोई परमाणु मूलक या आयन एक से अधिक इलेक्ट्रॉन का त्याग करता है। अर्थात् उसकी धनात्मक ऑक्सीकरण संख्या में वृद्धि होती है या ऋणात्मक ऑक्सीकरण संख्या में कमी आती है। अपचयन प्रक्रिया में कोई परमाणु मूलक या आयन एक से अधिक इलेक्ट्रॉन ग्रहण करता है, जिससे उसकी धनात्मक ऑक्सीकरण में कमी या ऋणात्मक ऑक्सीकरण संख्या में वृद्धि होती है।
K – e– → K+ ऑक्सीकरण
Cu+2 + 2e– → Cu° अपचयन
![]()
प्रश्न 9.
वैद्युत रासायनिक तुल्यांक किसे कहते हैं ?
उत्तर:
किसी वैद्युत अपघट्य के विलयन में 1 ऐम्पियर की धारा को 1 सेकण्ड तक प्रवाहित करने पर किसी इलेक्ट्रोड पर मुक्त होने वाली पदार्थ की मात्रा वैद्युत रासायनिक तुल्यांक कहलाती है। इसका मात्रक ग्राम / कूलॉम है।
प्रश्न 10.
Zn धातु को CuSO4 के विलयन में रखने पर क्या होता है ? समीकरण सहित स्पष्ट कीजिए।
उत्तर:
Zn धातु को CuSO4 विलयन में डालने पर जिंक Cu को विस्थापित कर देता है क्योंकि जिंक Cu की तुलना में अधिक क्रियाशील है।
Zn + CuSO4 + ZnSO4 + Cu
प्रश्न 11.
मानक इलेक्ट्रोड विभव से क्या तात्पर्य है ?
उत्तर:
जब किसी धातु इलेक्ट्रोड को 298 K ताप पर 1 मोलर सान्द्रण वाले विलयन में रखने पर धातु और विलयन के मध्य जो विभवान्तर उत्पन्न होता है उसे मानक इलेक्ट्रोड विभव कहते हैं। इसे E से दर्शाते हैं। यदि इलेक्ट्रोड गैसीय इलेक्ट्रोड है तो गैस का दाब एक वायुमण्डलीय दाब होना चाहिये।
प्रश्न 12.
निम्नलिखित धातुओं को उनके लवणों के विलयन में से विस्थापन के क्षमता के क्रम में लिखिए- AI, Cu, Fe, Mn तथा Zn
उत्तर:
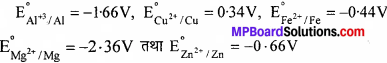
E 0अपचायक के अधिक ऋणात्मक मान वाली धातु का ऋणात्मक या धनात्मक E 0अपचायक वाली धातुओं की अपेक्षा प्रबल अपचायक अभिकर्मक है। अत: Mg दी गई सभी धातुओं को उनके लवणों के जलीय विलयन से विस्थापित कर सकती है। AI, Mg के अतिरिक्त सभी धातुओं को उनके लवणों के जलीय विलयन से विस्थापित कर सकती है। Zn, Fe तथा Cu को उनके लवणों के जलीय विलयन से विस्थापित कर सकती है। Fe केवल Cu को उसके लवणों के जलीय विलयन से विस्थापित कर सकती है। अतः धातुओं का लवणों के जलीय विलयन से विस्थापित करने की क्षमता का क्रम निम्न है-Mg, AI, Zn, Fe, Cu.
प्रश्न 13.
निम्नलिखित अभिक्रिया विरंजन की प्रक्रिया को प्रदर्शित करती है। उस स्पीशीज को पहचान कर उसका नाम लिखिए जो पदार्थों को उसकी ऑक्सीकारक प्रवृत्ति के कारण विरंजित करती है।
Cl2(aq) + 2OH–(aq) → CIO–(aq) + Cl–(aq) + H2O(l)
उत्तर:
प्रत्येक तत्व की ऑक्सीकरण संख्या को उसके प्रतीक के ऊपर लिखने पर,
![]()
इस क्रिया में Cl की ऑक्सीकरण संख्या 0(Cl2) में बढ़कर 1 (ClO–) में हो जाती है। जबकि 0(Cl2) में से घटकर -1 (Cl–) हो जाती है। अतः क्लोरीन अपचायक और ऑक्सीकारक दोनों की भाँति व्यवहार करती है। यह एक असमानुपातन अभिक्रिया का उदाहरण है। इस क्रिया में ClO–(हाइपोक्लोरेट आयन) अपने ऑक्सीकारक गुण के कारण पदार्थों को विरंजित करती हैं। ClO– में, Cl अपनी ऑक्सीकरण संख्या + 1 से 0 अथवा -1 तक घटा सकता है।
प्रश्न 14.
ऑक्सीकारक व अपचायक को परिभाषित कीजिए।
उत्तर:
ऑक्सीकारक:
वह अभिकारक जो दूसरे अभिकारक से इलेक्ट्रॉन ग्रहण कर उसे ऑक्सीकृत कर देता है तथा स्वयं अपचयित हो जाता है ऑक्सीकारक कहलाता है।
अपचायक:
वह अभिकारक जो स्वयं इलेक्ट्रॉन का त्याग कर दूसरे अभिकारक को अपचयित कर देता है तथा स्वयं ऑक्सीकृत होता है, अपचायक कहलाता है।
प्रश्न 15.
लोहे की एक छड़ को यदि CuSO4 के विलयन में रखा जाये तो ताँबा विस्थापित हो जाता है। परन्तु ताँबे की छड़ को FeSO4 के विलयन में डालने पर लोहा विस्थापित नहीं होता है, क्यों ?
उत्तर:
लोहा कॉपर की तुलना में अत्यधिक क्रियाशील है इसलिये CuSO4 के विलयन में Fe की छड़ रखने पर Fe विलयन में से Cu को प्रतिस्थापित कर देता है।
Fe + CuSO4 → FeSO4 +Cu
लेकिन कम क्रियाशील होने की वजह से Cu, FeSO4 विलयन में से Fe को प्रतिस्थापित नहीं कर पाता है।
Cu + FeSO4 → कोई अभिक्रिया नहीं।
प्रश्न 16.
क्या हम CuSO4के विलयन को रजत के पात्र में रख सकते हैं और क्यों ?
उत्तर:
विद्युत् रासायनिक श्रेणी में रजत Cu के नीचे आता है अर्थात् Ag की क्रियाशीलता Cu से कम है इसलिये Ag, CuSO4 विलयन में Cu को प्रतिस्थापित नहीं करेगा इसलिये रजत के पात्र में CuSO4को रखा जा सकता है।
![]()
प्रश्न 17.
ऑक्सीकरण संख्या किसे कहते हैं ?
उत्तर:
किसी तत्व की ऑक्सीकरण संख्या वह संख्या है जो किसी आयन में उपस्थित उस तत्व के परमाणु पर उपस्थित आवेश को दर्शाती है। इसका मान धनात्मक, ऋणात्मक या उदासीन हो सकता है।
उदाहरण – KMnO4 में Mn की ऑक्सीकरण संख्या + 7 है।
प्रश्न 18.
फ्लुओरीन बर्फ से अभिक्रिया करके यह परिवर्तन लाती है –
H2O(s)+ F2(g) → HF(g) + HOF(g) इस अभिक्रिया का रेडॉक्स औचित्य स्थापित कीजिए।
उत्तर:
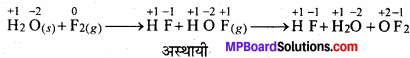
F का ऑक्सीकरण संख्या 0 (F2 में ) से घटकर -1 (HF में ) हो जाता है तथा 0 का ऑक्सीकरण संख्या -2 (H2O में) से बढ़कर + 2 (OF2 में) हो जाती है। अत: F2 का अपचयन तथा H2O का ऑक्सीकरण हो रहा है। अतः यह अभिक्रिया रेडॉक्स अभिक्रिया है।
प्रश्न 19.
MnO42- अम्लीय माध्यम में असमानुपातन अभिक्रिया प्रदर्शित करता है परन्तु MnO42- नहीं करता है। कारण भी दीजिए।
उत्तर:
MnO42- में Mn की ऑक्सीकरण संख्या + 6 है। यह अपनी ऑक्सीकरण संख्या में वृद्धि (+7) या कमी (+ 4, + 3, + 2, 0 तक) कर सकता है। अतः यह अम्लीय माध्यम में असमानुपातन अभिक्रिया प्रदर्शित करता है।
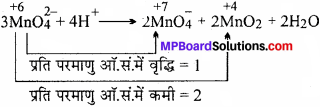
MnO–4 में Mn अपनी उच्चतम ऑक्सीकरण अवस्था (+7) में है। यह अपनी ऑक्सीकरण संख्या में केवल कमी कर सकता है। जिसके कारण यह असमानुपातन अभिक्रिया प्रदर्शित नहीं कर पाता है।
प्रश्न 20.
निम्न अभिक्रिया में किसका ऑक्सीकरण और किसका अपचयन हो रहा है –
PbS + 4H2O2 → PbSO4 + 4H2O
उत्तर:
इस अभिक्रिया में PbS का PbSO4 में ऑक्सीकरण हो रहा है तथा H2O2 का H2O में अपचयन हो रहा है।
प्रश्न 21.
ऑक्सीकरण संख्या व संयोजकता में क्या अंतर है ?
उत्तर:
ऑक्सीकरण संख्या व संयोजकता में अंतर –
- ऑक्सीकरण संख्या
- यह वह संख्या है जो किसी आयन पर उपस्थित आवेश को दर्शाती है।
- ऑक्सीकरण संख्या धनात्मक, ऋणात्मक होती है इसका मान शून्य भी हो सकता है।
- इसका मान पूर्णांक में या भिन्नात्मक भी हो सकता है।
संयोजकता
- इलेक्ट्रॉनों की वह संख्या जिसे कोई दान करता है या ग्रहण करता है।
- संयोजकता का मान धन या ऋण आवेश रहित होता है।
- इसका मान सदैव पूर्णांक में होता है।
प्रश्न 22.
विद्युत् रासायनिक श्रेणी में धातुओं की सक्रियता किस क्रम में घटती और बढ़ती है ?
उत्तर:
जिस धातु का मानक अपचयन विभव का मान जितना अधिक ऋणात्मक होता है उसकी इलेक्ट्रॉन त्याग करने की प्रवृत्ति उतनी अधिक होती है तथा वह धातु उतनी अधिक क्रियाशील होती है। इस प्रकार विद्युत् रासायनिक श्रेणी में ऊपर से नीचे आने पर क्रियाशीलता में कमी आती है।
प्रश्न 23.
गैल्वेनिक सेल के लिये E cell का धनात्मक मान क्या दर्शाता है ?
उत्तर:
गैल्वेनिक सेल के Ecell का धनात्मक मान दर्शाता है कि –
- जिस इलेक्ट्रोड पर ऑक्सीकरण हो रहा है उसे एनोड की भाँति माना जाये।
- जिस इलेक्ट्रोड पर अपचयन हो रहा है उसे कैथोड की तरह माना जाये।
प्रश्न 24.
इलेक्ट्रोड विभव क्या है ? इसका मान किन कारकों पर निर्भर करता है ?
उत्तर:
किसी धातु इलेक्ट्रोड को उनके आयनों के किसी लवण के विलयन के संपर्क में रखने पर धातु तथा विलयन के मध्य उत्पन्न हुआ विभवान्तर इलेक्ट्रोड विभव कहलाता है । इलेक्ट्रोड विभव किसी अर्द्ध सेल में किसी इलेक्ट्रोड द्वारा इलेक्ट्रॉन मुक्त करने या इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति है।
प्रश्न 25.
फ्लुओरीन असमानुपातन अभिक्रिया प्रदर्शित नहीं करता है, क्यों ? ..
उत्तर:
असमानुपातन अभिक्रिया में एक ही स्पीशीज एक साथ ऑक्सीकृत तथा अपचयित होती है। अतः ऐसी रेडॉक्स अभिक्रिया के होने के लिए अभिकारक स्पीशीज में कम से कम तत्व अवश्य होना चाहिए जो कम से कम तीन ऑक्सीकरण अवस्थाएँ प्रदर्शित करता हो। अभिकारक स्पीशीज में तत्व मध्यवर्ती ऑक्सीकरण संख्या में होना चाहिए जबकि निम्न और उच्च ऑक्सीकरण अवस्थाएँ क्रमशः अपचयन तथा ऑक्सीकरण के लिए उपलब्ध होनी चाहिए। फ्लुओरीन प्रबलतम ऑक्सीकारक पदार्थ है। यह धनात्मक ऑक्सीकरण अवस्था (संख्या) प्रदर्शित नहीं करता है। यही कारण है कि फ्लुओरीन असमानुपातन अभिक्रिया प्रदर्शित नहीं करता है।
![]()
प्रश्न 26.
उस गैल्वेनिक सेल को चित्रित कीजिए, जिसमें निम्न अभिक्रिया होती है –
Zn(s) + 2Ag+(aq) → Zn2+(aq) + 2Ag(s)
अब बताइए कि –
- कौन-सा इलेक्ट्रोड ऋण आवेशित है?
- सेल में विद्युत्धारा का वाहक कौन है ?
- प्रत्येक इलेक्ट्रोड पर होने वाली अभिक्रियाएँ क्या हैं ?
उत्तर:
गैल्वेनिक सेल –
Zn(s) |Zn2+(aq)| Ag+(aq)| Ag(s)
- Zn इलेक्ट्रोड ऋणात्मक आवेशित है। Zn का Zn+2 आयनों में ऑक्सीकरण होता है।
- धारा सिल्वर से जिंक इलेक्ट्रोड की ओर बहेगी एवं इलेक्ट्रॉन जिंक से सिल्वर की ओर बहेगा।
- इलेक्ट्रोड पर होने वाली अभिक्रिया
कैथोड – Zn → Zn2+ + 2e–
एनोड- 2Ag2++2e– → 2Ag(s)
प्रश्न 27.
नीचे दिए गए मानक इलेक्ट्रोड विभवों के आधार पर धातुओं को उनकी बढ़ती अपचायक क्षमता के क्रम में लिखिए –
1. K+/K = – 2.93V
2. Ag / Ag = 0 – 80V
3. Hg + /Hg = 0.79V
4. Mg + /Mg = -2:37V
5. Cr+3 /Cr = – 0.74V.
उत्तर:
मानक इलेक्ट्रोड विभव (E ) का मान जितना कम है, पदार्थ उतना ही प्रबल अपचायक होता है। अतः धातुओं की बढ़ती हुई अपचायक क्षमता का क्रम निम्न है- Ag < Hg < Cr < Mg
![]()
प्रश्न 28.
निम्नलिखित अभिक्रिया क्यों होती है –
XeO4-6(aq) + 2F–(aq) +6H+(aq) →XeO3(g)+ F3(g) +3H2O(l). यौगिक Na4Xe06 (जिसका एक भाग XeO4-6(aq) है) के बारे में आप इस अभिक्रिया से क्या निष्कर्ष निकाल सकते हैं ?
उत्तर:
![]()
उपर्युक्त अभिक्रिया में Xe की ऑक्सीकरण संख्या +8(XeO4-6(aq) में) से घटकर +6(XeO3 में) होती है तथा F की ऑक्सीकरण संख्या -1 (F में) से बढ़कर 0 (F, में) हो जाती है अतः XeO4-6(aq)या Na XeO6 अपचयित होता है तथा F ऑक्सीकृत होता है। यह अभिक्रिया संभव है क्योंकि Na4XeO6 या XeO4-6(aq)फ्लुओरीन की अपेक्षा प्रबल ऑक्सीकारक है।
प्रश्न 29.
Mgo, Zn0, Cuo और Cao में कौन-सा ऑक्साइड हाइड्रोजन से अपचयित होगा और क्यों?
उत्तर:
Mg, Zn तथा Ca विद्युत् रासायनिक श्रेणी में हाइड्रोजन की तुलना में अत्यधिक क्रियाशील हैं इसलिये ये हाइड्रोजन द्वारा अपचयित नहीं होंगे। Cu विद्युत् रासायनिक श्रेणी में हाइड्रोजन के नीचे व्यवस्थित है अर्थात् Cu की क्रियाशीलता हाइड्रोजन से कम है इसलिये CuO हाइड्रोजन द्वारा सरलता से अपचयित हो जाता है।
प्रश्न 30.
Ag, Ba, Mg और Au के E के मान क्रमशः + 0.80, – 2.90, – 2.37 और + 1.42 Volt है, इसमें कौन-सी धातु अम्लों में से हाइड्रोजन को विस्थापित करेगी और कौन-सी नहीं?
उत्तर:
जिन धातुओं के E° के मान ऋणात्मक होते हैं वे हाइड्रोजन की तुलना में अधिक क्रियाशील हैं तथा तनु अम्लों में से हाइड्रोजन को सरलता से विस्थापित कर सकते हैं। इसलिये Ba तथा Mg तनु अम्लों में H2 को प्रतिस्थापित कर सकते हैं। तथा Ag और Au के E° के मान धनात्मक हैं ये हाइड्रोजन की तुलना में कम क्रियाशील हैं इसलिये ये तनु अम्लों में से हाइड्रोजन को प्रतिस्थापित नहीं कर सकते।।
प्रश्न 31.
विद्युत् रासायनिक सेल की परिभाषा लिखिये। डेनियल सेल की रासायनिक अभिक्रिया दर्शाइये।
उत्तर:
वह पात्र या निकाय जिसमें रासायनिक अभिक्रिया के फलस्वरूप विद्युत् धारा उत्पन्न होती है विद्युत् रासायनिक सेल कहलाता है। इसमें होने वाली रेडॉक्स अभिक्रिया अप्रत्यक्ष होती है अर्थात् ऑक्सीकरण और अपचयन अभिक्रिया अलग – अलग पात्र में होती है।
अपचयोपचय अभिक्रियाएँ लघु उत्तरीय प्रश्न
प्रश्न 1.
इलेक्ट्रॉन विभव को प्रभावित करने वाले कारक लिखिए।
उत्तर:
इलेक्ट्रॉन विभत्र को प्रभावित करने वाले कारक निम्नलिखित हैं –
- धातु की इलेक्ट्रॉन त्यागने की प्रवृत्ति-जिस धातु की इलेक्ट्रॉन त्यागने की प्रवृत्ति जितनी अधिक होगी उसका इलेक्ट्रोड विभव उतना ही अधिक होगा।
- ताप-विलयन का ताप बढ़ाने पर इलेक्ट्रोड विभव का मान बढ़ता है।
- विलयन की सान्द्रता-विलयन में धातु आयनों की सान्द्रता अधिक होने पर इलेक्ट्रोड विभव का मान उच्च होता है।
प्रश्न 2.
निम्नलिखित की ऑक्सीकरण संख्या ज्ञात कीजिए –
- K2Cr2O7 में Cr की –
- KMnO4में Mn की,
- Na2S4O6 में S की,
- H3PO4 में P की,
- K2MnO4 में Mn की,
- MnO2 में Mn की।
उत्तर:
(1) K2Cr2O7 में Cr की –
2(+1) + 2x+7(-2)= 0
या 2+ 2 x – 14 = 0
या 2 x = 12
या x = +6
(2) KMnO4में Mn की –
1(+1) +1 x + 4(-2)= 0
या 1 + x – 8 = 0
या x = +7
(3) Na2S4O6 में S की –
2(+1) + 4x +6(-2) = 0
या 2 + 4x – 12 = 0
या 4x = 10
या x = \(\frac { 10 }{ 4 }\) = 2.5
(4) H3PO4 में P की –
3(+1) + 1 x + 4(-2)= 0
3+ x – 8 = 0
x = + 5.
(5) K2MnO4 में Mn की –
(+1 x 2)+ x + (-2 × 4)= 0
2 + x – 8 = 0
x = 8 – 2 = 6.
(6) MnO2 में Mn की।
x + (-2) × 2 = 0
या x – 4 = 0
x = 4.
![]()
प्रश्न 3.
रेडॉक्स अभिक्रिया क्या है ? उदाहरण सहित समझाइये।
उत्तर:
ऑक्सीकरण प्रक्रम वह प्रक्रम है जिसमें कोई तत्व एक या एक से अधिक इलेक्ट्रॉन दान करता है इसे डी-इलेक्ट्रोनेशन भी कहते हैं। तथा अपचयन वह प्रक्रम है जिसमें कोई तत्व एक या एक से अधिक इलेक्ट्रॉन ग्रहण करता है इसे इलेक्ट्रोनेशन भी कहते हैं। इस प्रकार अभिक्रिया के दौरान यदि एक तत्व इलेक्ट्रॉन दान करता है तो दूसरा तत्व इलेक्ट्रॉन ग्रहण करता है अर्थात् किसी भी अभिक्रिया में ऑक्सीकरण तथा अपचयन प्रक्रम एक साथ होते हैं। इसलिये इसे ऑक्सीकरण-अपचयन प्रक्रम या रेडॉक्स अभिक्रिया कहते हैं अत: रेडॉक्स अभिक्रिया वह अभिक्रिया है जिसमें इलेक्ट्रॉनों का स्थानांतरण एक अभिकारक से दूसरे अभिकारक तक होता है।

प्रश्न 4.
विद्युत् अपघटनी सेल तथा विद्युत् रासायनिक सेल में अंतर लिखिए।
उत्तर:
विद्युत् अपघटनी सेल तथा विद्युत् रासायनिक सेल में अंतर –
विद्युत् अपघटनी सेल:
- इसमें विद्युत् ऊर्जा का रासायनिक ऊर्जा में परिवर्तन होता है।
- रेडॉक्स अभिक्रिया प्रत्यक्ष विधि द्वारा होती है।
- लवण सेतु की कोई आवश्यकता नहीं होती है।
- एनोड धन ध्रुव तथा कैथोड ऋण ध्रुव होता है।
विद्युत् रासायनिक सेल:
- इसमें रासायनिक ऊर्जा का विद्युत् ऊर्जा में परिवर्तन होता है।
- रेडॉक्स अभिक्रिया अप्रत्यक्ष विधि द्वारा होती है।
- लवण सेतु की आवश्यकता होती है।
- एनोड ऋण ध्रुव तथा कैथोड धन ध्रुव होता है।
प्रश्न 5.
विद्युत् रासायनिक श्रेणी की प्रमुख विशेषताएँ लिखिए।
उत्तर:
विद्युत् रासायनिक श्रेणी की विशेषताएँ निम्नलिखित हैं –
- वैद्युत रासायनिक श्रेणी में धातुओं की रासायनिक सक्रियता ऊपर से नीचे आने पर घटती है।
- वैद्युत रासायनिक श्रेणी में अधातुओं की रासायनिक सक्रियता ऊपर से नीचे आने पर बढ़ती है।
- श्रेणी में मानक अपचयन विभव का ऋणात्मक मान जितना अधिक होगा वह तत्व उतना प्रबल अपचायक होगा।
- श्रेणी में मानक अपचयन विभव का धनात्मक मान जितना उच्च होगा वह तत्व उतना प्रबल ऑक्सीकारक होगा।
- श्रेणी में जो तत्व H, से ऊपर व्यवस्थित है वह तनु अम्लों में से सरलता से हाइड्रोजन को प्रतिस्थापित करती है।
- श्रेणी में जो तत्व हाइड्रोजन से नीचे व्यवस्थित है वह तनु अम्लों में से हाइड्रोजन को प्रतिस्थापित नहीं करती है।
- श्रेणी में ऊपर आने वाले तत्व बाद में आने वाले तत्वों को उनके लवणों के विलयन में से सरलता से प्रतिस्थापित करते हैं।
प्रश्न 6.
ननस्ट समीकरण क्या है ? E और E° में संबंध स्पष्ट कीजिए।
उत्तर:
किसी इलेक्ट्रोड का विभव विलयन की सान्द्रता 1M तथा ताप 298 K से किस प्रकार प्रभावित होता है। तथा साधारण परिस्थितियों में ज्ञात किये गये इलेक्ट्रोड विभव और मानक इलेक्ट्रोड विभव के बीच संबंध को स्थापित करने के लिये ननस्ट ने एक समीकरण दिया जिसे ननस्ट समीकरण कहते हैं।
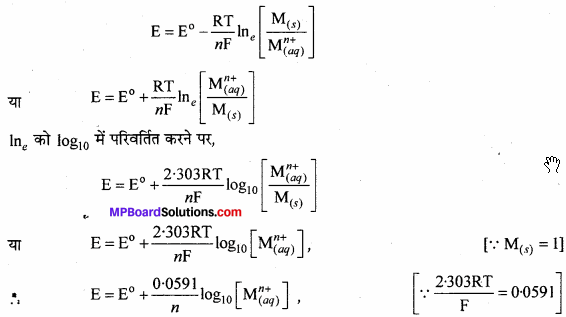
प्रश्न 7.
विद्युत् रासायनिक श्रेणी के प्रमुख उपयोग लिखिए।
उत्तर:
(1) गेल्वनिक सेलों का E.M.E. ज्ञात करना-दो अर्द्ध सेलों से बने हुये किसी गैल्वनिक सेल का मानक विद्युत वाहक बल E° की गणना निम्न सूत्र की सहायता से ज्ञात की जा सकती है।
![]()
(2) रेडॉक्स अभिक्रिया की सम्भावना:
यदि सेल विभव का मान धनात्मक हो, तो रेडॉक्स अभिक्रिया संभव है और यदि सेल विभव का मान ऋणात्मक हो, तो रेडॉक्स अभिक्रिया संभव नहीं होगी।
(3) धातुओं का धन विद्युती गुण;
जो परमाणु अपने बाह्यतम कोश से सबसे सरलता से इलेक्ट्रॉन त्यागते हैं, वह उच्चतम धन विद्युती गुण दर्शाता है। और जो कठिनाई से इलेक्ट्रॉन त्यागते हैं, निम्नतम धन विद्युती गुण दर्शाता है।
(4) धातु की सक्रियता की तुलना:
जिस धातु के E° का ऋणात्मक मान जितना अधिक होगा वह उतनी ही सरलता से इलेक्ट्रॉन त्याग कर धनायन बनाता है अतः E° का ऋणात्मक मान होने पर धातु की क्रियाशीलता व अपचायक गुण अधिक होता है।
(5) ऑक्सीकारक व अपचायक का ज्ञान:
मानक अपचयन इलेक्ट्रोड विभव का ऋणात्मक मान जितना अधिक होगा वह तत्व उतना प्रबल अपचायक होगा तथा मानक अपचयन इलेक्ट्रोड विभव का मान जितना अधिक धनात्मक होगा वह तत्व उतना प्रबल ऑक्सीकारक होगा।
![]()
अपचयोपचय अभिक्रियाएँ दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
नाइट्रिक अम्ल निर्माण की ओस्टवाल्ड विधि के प्रथम पद में अमोनिया गैस के ऑक्सीजन गैस द्वारा ऑक्सीकरण से नाइट्रिक ऑक्साइड गैस तथा जल वाष्प बनती है। 100 ग्राम अमोनिया 20.0 ग्राम ऑक्सीजन द्वारा नाइट्रिक ऑक्साइड की कितनी अधिकतम मात्रा प्राप्त हो सकती है।
उत्तर:
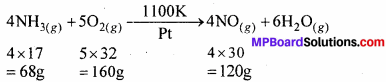
परन्तु O2 की उपलब्ध मात्रा 20.0g है जो कि 10g NH3 से पूर्णतः क्रिया करने के लिए आवश्यक मात्रा (23.5g) से कम है। अत: O2 सीमांत अभिकर्मक है तथा यह उत्पन्न NO की मात्रा को सीमित करता है।
उपर्युक्त संतुलित समीकरण से –
∴ 160 g O2 उत्पन्न होती है = 120g NO से
∴ 1g O2 उत्पन्न होती है = \(\frac { 120 x 1 }{ 160 }\) g NO से
∴ 20 g O2 उत्पन्न होगी = 120 = \(\frac { 120 x 1 x 20 }{ 160 }\) = 15 g NO से।
प्रश्न 2.
मानक हाइड्रोजन इलेक्ट्रोड क्या है ? यह कैसे बनाया जाता है ?
उत्तर:
मानक हाइड्रोजन इलेक्ट्रोड:
इसमें प्लैटिनम ब्लैक की पर्त चढ़ी हुई प्लैटिनम की एक पतली पत्ती का इलेक्ट्रोड हाइड्रोजन आयन के 1 मोलर सान्द्रता के विलयन में डुबोकर रखा जाता है। यह काँच की एक नली से ढंका रहता है। नली में से एक वायुमण्डलीय। शुद्ध हाइड्रोजन गैस दाब पर शुद्ध हाइड्रोजन गैस प्रवाहित करते हैं।
प्लैटिनम या हाइड्रोजन हाइड्रोजन गैस प्लेटिनम तार गैस अवशोषित होती है तथा शीघ्र ही H, गैस HO+ आयनों के काँच का जैकेट मध्य एक साम्य स्थापित हो जाता है। परिस्थिति के अनुसार हाइड्रोजन इलेक्ट्रोड एनोड तथा कैथोड की तरह कार्य करता है, यदि मानक हाइड्रोजन इलेक्ट्रोड एनोड की तरह कार्य करता है तो उस पर ऑक्सीकरण होता है और इस पर होने वाली सेल अभिक्रिया
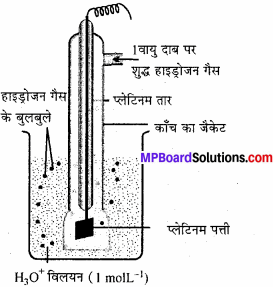
H2 → 2H2++ 2e
इस सेल अभिक्रिया को निम्न प्रकार से दर्शाया जा सकता है –
Pt, H2(g) (1 atm P) | 2H+ (1M)
यदि मानक हाइड्रोजन इलेक्ट्रोड कैथोड की तरह कार्य करता है तो उस पर अपचयन होगा और इस पर होने वाली सेल अभिक्रिया
2H+ + 2e → H2
2H+ (1M) / PtH2(g) (latmP)
इस मानक हाइड्रोजन इलेक्ट्रोड विभव का मान मानक स्थिति में शून्य होता है।
![]()
प्रश्न 3.
ऑक्सीकरण संख्या क्या है ? इसे ज्ञात करने के प्रमुख नियम लिखिए।
उत्तर:
किसी यौगिक या आयन में किसी तत्व के परमाणु पर स्थित धन या ऋण आवेश को उस तत्व की ऑक्सीकरण संख्या कहलाती है।
ऑक्सीकरण संख्या ज्ञात करने के नियम –
- किसी तत्व की स्वतंत्र अवस्था या मूल अवस्था में ऑक्सीकरण संख्या शून्य होती है।
- किसी तत्व के एक परमाण्विक आयन की ऑक्सीकरण संख्या उस आयन पर उपस्थित आवेश के बराबर होती है।
- किसी भी संकुल आयन में + ve और – ve ऑक्सीकरण संख्या का जो अंतर होता है वही उस संकुल आयन पर आवेश होता है।
- किसी भी उदासीन अणु या यौगिक में धनात्मक तथा ऋणात्मक ऑक्सीकरण संख्या का योग शून्य है।
- जब दो ऋणविद्युती तत्व आपस में संयोग कर यौगिक बनाते हैं तो प्रबल ऋणविद्युती तत्व ऋणात्मक ऑक्सीकरण संख्या तथा कम ऋणविद्युती तत्व धनात्मक ऑक्सीकरण संख्या दर्शाता है।
- फ्लुओरीन आवर्त सारणी में सबसे ऋणविद्युती तत्व है इसीलिये F सदैव – 1 ऋणात्मक ऑक्सीकरण संख्या दर्शाता है। जबकि अन्य हैलोजन ऋणात्मक ऑक्सीकरण संख्या के साथ धनात्मक ऑक्सीकरण संख्या भी दर्शाते हैं।
- जब हाइड्रोजन किसी अधातु के साथ संयोग कर यौगिक बनाता है तो हाइड्रोजन की ऑक्सीकरण संख्या + 1 होती है जब H2 धातु के साथ संयोग कर हाइड्राइड बनाता है तो H2 की ऑक्सीकरण संख्या – 1 होती है।
- सामान्य यौगिकों में ऑक्सीजन की ऑक्सीकरण संख्या – 2 होती है। इस परिस्थिति में इन्हें ऑक्साइड कहते हैं। कुछ यौगिकों में O2
की ऑक्सीकरण संख्या -1 और –\(\frac { 1 }{ 2 }\) भी संभव है इन्हें परॉक्साइड तथा सुपर ऑक्साइड कहते हैं।
प्रश्न 4.
रेडॉक्स अभिक्रिया के समीकरण को आयन इलेक्ट्रॉन विधि से किस प्रकार संतुलित किया जाता है ? समझाइये।
उत्तर:
- दिये गये रासायनिक समीकरण में प्रत्येक तत्व की ऑक्सीकरण संख्या को दर्शाते हैं।
- ऑक्सीकरण संख्या के आधार पर ऑक्सीकरण तथा अपचयन की अभिक्रिया की पहचान करते हैं।
- ऑक्सीकरण तथा अपचयन के आधार पर रेडॉक्स अभिक्रिया को दो पदों में विभाजित करते हैं।
- H2 तथा O2 के अतिरिक्त प्रत्येक अन्य तत्वों को अर्द्ध समीकरण में संतुलित करते हैं।
- ऑक्सीकरण संख्या में परिवर्तन के आधार पर इलेक्ट्रॉन का आदान-प्रदान कर आवेश को संतुलित करते हैं।
- जिस ओर ऑक्सीजन की कमी हो उस ओर H2O को जोड़कर ऑक्सीजन को संतुलित करते हैं।
- H2 को संतुलित करने के लिये निम्नलिखित दो पदों का उपयोग करते हैं
- अम्लीय माध्यम में – यदि अभिक्रिया अम्लीय माध्यम में हो रही है तो जिस तरफ H2 की कमी हो उस तरफ H आयन जोड़ते हैं।
- क्षारीय माध्यम में – यदि अभिक्रिया क्षारीय माध्यम में हो रही है तो जिस तरफ H2 की कमी हो उस तरफ H2O तथा दूसरी तरफ OH– आयन जोड़ते हैं।
- दोनों अर्द्ध समीकरण में इलेक्ट्रॉन को संतुलित करने के लिये किसी उपयुक्त संख्या से गुणा करते हैं।
- दोनों अर्द्ध समीकरण को जोड़कर पूर्ण समीकरण प्राप्त करते हैं।
प्रश्न 5.
निम्नलिखित अभिक्रिया से आप कौन-सी सूचनाएँ प्राप्त कर सकते हैं –
(CN)2(g) + 2OH–2(aq) → CN–2(aq) + CNO–2(aq) + H2O(l)
उत्तर:
(CN)2(g) + 2OH–2(aq) → CN–2(aq) + CNO–2(aq) + H2O(l)
1. माना (CN)2में C की ऑक्सीकरण संख्या = x
2x + 2(-3) = 0
x = + 3
2. माना CN– में C की ऑक्सीकरण संख्या = x
x+ (-3) = -1
x = +2
3. माना CNO– में C की ऑक्सीकरण संख्या = x
x+ (-3) + (-2) = -1
x = + 4
ऑक्सीकरण संख्या में वृद्धि उपर्युक्त समीकरण से निम्नलिखित सूचनाएँ प्राप्त होती हैं –
- साइनोजन का साइनाइड आयन (CN–) तथा सायनेट आयन (CNO– ) में अपघटन क्षारीय माध्यम में होता है।
- साइनोजन ऑक्सीकारक तथा अपचायक दोनों की भाँति व्यवहार करता है।
- यह समीकरण असमानुपातन अभिक्रिया (रेडॉक्स अभिक्रिया का विशिष्ट प्रकार) का उदाहरण है।
- साइनोजन (CN)2 को छद्म हैलोजन कहते हैं जबकि CN– ,CNO– आयनों को छद्म हैलाइड आयन कहते हैं।
![]()
प्रश्न 6.
निम्नलिखित रेडॉक्स अभिक्रिया को आयन इलेक्ट्रॉन विधि द्वारा संतुलित कीजिए –
Cr2O-27 + Fe+2 + H+ → Cr+3 + Fe+3
उत्तर:
(1) प्रत्येक तत्व की ऑक्सीकरण संख्या को दर्शाते हैं।
![]()
(2) ऑक्सीकरण तथा अपचयन अभिक्रिया की पहचान
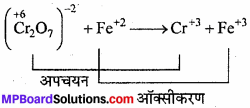
(3) अभिक्रिया को दो पदों में विभाजित करते हैं -]
Fe+2 → Fe+3
Cr2O-27 → Cr+3
(4) तत्व को संतुलित करना –
Fe+2 → Fe+3
Cr2O-27 → 2Cr+3
(5) आवेश संतुलित करना –
Fe+2 – 1e →F+3
Cr2O-27 +6e → 2Cr+3
(6) ऑक्सीजन को संतुलित करना –
Fe+2 – 1e → Fe+3
Cr2O-27+6e →2Cr+3 + 7H2O
(7) H2 को संतुलित करना –
Fe+2 – 1e → Fe+3
Cr2O-27 + 6e +14H+ →2Cr+3 + 7H2O
(8) इलेक्ट्रॉन को संतुलित करना –
6Fe+2 – 6e → 6Fe+3
Cr2O-27 +6e+ 14H+ →2Cr+3+ 7H2O
(9) दोनों समीकरण को जोड़ने पर –
6Fe+2 – 6e → 6Fe+3
Cr2O-27 + 6e +14H+ → 2Cr+3 + 7H2O
6Fe+2 + Cr2O-27 + 14H+ →2Cr+3 + 6Fe+3 +7H2O
प्रश्न 7.
Cs, Ne, I और F में ऐसे तत्व की पहचान कीजिए जो –
- केवल ऋणात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है।
- केवल धनात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है।
- ऋणात्मक और धनात्मक दोनों ऑक्सीकरण अवस्था प्रदर्शित करता है।
- न ऋणात्मक और न ही धनात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है।
उत्तर:
- F केवल ऋणात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है क्योंकि यह सर्वाधिक विद्युत् ऋणात्मक तत्व है।
- Cs केवल धनात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है क्योंकि यह सर्वाधिक विद्युत् धनात्मक तत्व है।
- I धनात्मक एवं ऋणात्मक दोनों ऑक्सीकरण अवस्थाएँ प्रदर्शित करता है। आयोडीन -1,0,+1,+3,+5 और +7 ऑक्सीकरण अवस्थाएँ प्रदर्शित करता है। (+3,+5 और +7 ऑक्सीकरण अवस्थाएँ रिक्त d- कक्षक के कारण प्रदर्शित करता है।)
- Ne अक्रिय गैस है, अतः यह न ऋणात्मक और न धनात्मक ऑक्सीकरण अवस्था प्रदर्शित करती है।
![]()
प्रश्न 8.
किसी विलयन में अपचायक/ऑक्सीकारक की क्षमता को ज्ञात करने के लिए किस विधि का प्रयोग करते हैं ? उदाहरण सहित वर्णन कीजिए।
उत्तर:
सर्वप्रथम मानक हाइड्रोजन इलेक्ट्रोड के साथ दी गई स्पीशीज के रेडॉक्स युग्म को युग्मित करके इसके इलेक्ट्रोड विभव का मापन करते हैं। यदि यह धनात्मक होता है तो दी गई स्पीशीज का इलेक्ट्रोड अपचायक की भाँति कार्य करता है तथा यदि यह ऋणात्मक होता है तो दी गई स्पीशीज का इलेक्ट्रोड ऑक्सीकारक की भाँति व्यवहार करता है। इसी विधि से अन्य दी गई स्पीशीज का इलेक्ट्रोड विभव ज्ञात करते हैं। इन मानों की तुलना करते है तथा अपचायक अथवा ऑक्सीकारक के रूप में उनकी आपेक्षिक क्षमता ज्ञात करते हैं।
उदाहरण:
मानक हाइड्रोजन इलेक्ट्रोड (SHE) को संदर्भ इलेक्ट्रोड की भाँति प्रयोग करके Zn+2 / Zn इलेक्ट्रोड के मानक इलेक्ट्रोड विभव की गणना निम्न प्रकार से करते हैं –
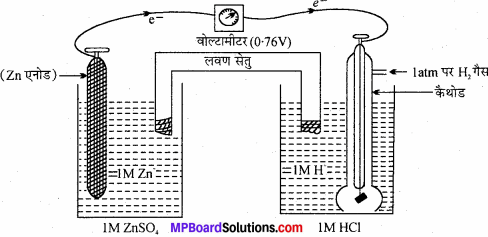
सेल के विद्युत् वाहक बल (emf) का मान 0.76V प्राप्त होता है। (वोल्टामीटर का पाठ्यांक 0.76V है) Zn+2 / Zn युग्म एनोड की भाँति कार्य करता है तथा मानक हाइड्रोजन कैथोड की भाँति कार्य करता है।

प्रश्न 9.
अपनी अभिक्रियाओं में SO2 और हाइड्रोजन परॉक्साइड ऑक्सीकारक तथा अपचायक दोनों के रूप में क्रिया करते हैं, जबकि ओजोन तथा HNO3 केवल ऑक्सीकारक के रूप में ही क्यों?
उत्तर:
1. SO2 में S की ऑक्सीकरण संख्या +4 है। इसकी न्यूनतम ऑक्सीकरण संख्या-2 तथा अधिकतम ऑक्सीकरण संख्या +6 हो सकती है। अत: SO2 में S अपनी ऑक्सीकरण संख्या को घटा तथा बढ़ा दोनों सकता है, इसी कारण SO2 ऑक्सीकारक और अपचायक दोनों की भाँति व्यवहार कर सकता है।
2. H2O2 में 0 की ऑक्सीकरण संख्या -1 है। इसकी न्यूनतम ऑक्सीकरण संख्या – 2 तथा अधिकतम ऑक्सीकरण संख्या ऑक्सीजन की(O2F2 तथा OF2 में क्रमशः +1 तथा +2 भी संभव है) अतः H2O2 में ऑक्सीजन की ऑक्सीकरण संख्या को घटा तथा बढ़ा भी सकता है। अत: HO2 ऑक्सीकारक एवं अपचायक दोनों की भाँति व्यवहार कर सकता है।
3. O3 में ऑक्सीजन की ऑक्सीकरण संख्या शून्य है। यह अपनी ऑक्सीकरण संख्या में वृद्धि नहीं कर पाता है। यह केवल ऑक्सीकरण संख्या शून्य से -1 तथा –2 तक घटा सकता है। अत: O3 (ओजोन)केवल ऑक्सीकारक की भाँति व्यवहार कर सकता है।
4. HNO3 में, N की ऑक्सीकरण संख्या +5 है जो कि अधिकतम है। अत: HNO3 में N की ऑक्सीकरण संख्या में केवल कमी ही हो सकती है। अतः केवल ऑक्सीकारक की भाँति व्यवहार कर सकता है।
प्रश्न 10.
उन यौगिकों की सूची तैयार कीजिए जिसमें कार्बन -4 से +4 तक की तथा नाइट्रोजन -3 से +5 तक की ऑक्सीकरण अवस्था में होता है।
उत्तर:
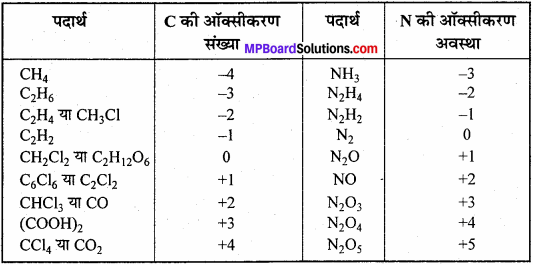
प्रश्न 11.
अभिक्रिया देते हुए सिद्ध कीजिए कि हैलोजनों में फ्लुओरीन श्रेष्ठ ऑक्सीकारक तथा हाइड्रोहैलिक यौगिकों में हाइड्रो आयोडिक अम्ल (HI) श्रेष्ठ अपचायक है।
उत्तर:

हैलोजन का मानक अपचयन विभव धनात्मक होता है तथा फ्लुओरीन से आयोडीन तक क्रमशः घटता है। अत: हैलोजन प्रबल ऑक्सीकारक अभिकर्मक की भाँति व्यवहार करते हैं तथा उनकी ऑक्सीकारक क्षमता फ्लुओरीन से आयोडीन तक घटती जाती है। फ्लुओरीन प्रबलतम ऑक्सीकारक अभिकर्मक है। यह अन्य हैलाइड आयनों को विलयन या शुष्क अवस्था में संगत हैलोजन में ऑक्सीकृत कर देता है।
F2 + 2X– F– + X2 (X– = CI–,Br–,I–)
सामान्य रूप से, निम्न परमाणु संख्या वाली हैलोजन उच्च परमाणु संख्या वाली हैलोजन के हैलाइड आयन को ऑक्सीकृत कर देती है।
हैलाइड आयन, X–अथवा HX अणु जब किसी ऑक्सीकारक के साथ क्रिया करता है तो यह ऑक्सीकारक पदार्थ को अपचयित कर देता है तथा स्वयं X2 अणु में अपचयित हो जाता है। X– आयन की इलेक्ट्रॉन त्यागकर X2 अणु बनाने की प्रवृत्ति F से I आयन तक क्रमशः बढ़ती है। X– आयनों अथवा HX अणुओं की यह अपचायक क्षमता F– से I– आयनों अथवा HF से HI अणुओं तक क्रमशः बढ़ती है।

प्रबलतम अपचायक → दुर्बलतम अपचायक
2HF + H2SO4 → कोई क्रिया नहीं
HCl भी H2SO4 के साथ क्रिया नहीं करता है।
किन्तु 2HI + H2SO4 → SO2 +2H2O + I2
HBr भी इसी प्रकार क्रिया करता है।
HF या F– आयन एक दुर्बल अपचायक है। यह इतना दुर्बल अपचायक है कि यह अत्यधिक प्रबल ऑक्सीकारक पदार्थ जैसे – H2SO4R को भी अपचयित नहीं कर पाता है। जबकि HI या I– आयन प्रबल ऑक्सीकारक पदार्थों को अपचयित करते हैं तथा स्वयं I2 में ऑक्सीकृत हो जाते हैं। यही कारण है कि HI श्रेष्ठ अपचायक है।
प्रश्न 12.
मानक इलेक्ट्रोड विभव के मानों के आधार पर बताइये कि निम्नलिखित में से कौन-सी अभिक्रियाएँ संभव होगी

1. Cu+Zn2+ → Cu2+ + Zn
2. Mg + Fe2+ → Mg 2+ + Fe
3. Br2 + 2Cl– → Cl2 + 2Br–
4. Fe+ Cd 2+ → Cd + Fe 2+
उत्तर:
1. Cu + Zn2+ → Cu2+ + Zn
दी गई सेल अभिक्रिया में Cu, Cu2+ में ऑक्सीकृत होता है। अत: Cu2+/ Cu युग्म एनोड की भाँति कार्य करते है तथा Zn2+/ Zn युग्म कैथोड की भाँति कार्य करेगा।
E0cell = E0cathod – E0Anode
E0cell = -0. 76 – (+0.34) = -1.1v
E0cell का मान ऋणात्मक यह प्रदर्शित करता है कि यह क्रिया संभव नहीं है।
2. Mg + Fe2+ → Mg2+ + Fe
![]()
Mg, Mg 2+ में ऑक्सीकृत होगा अतः एनोड का कार्य Mg2+ / Mg करेगा।
Fe2+ Fe में अपचयित होगा अतः कैथोड का कार्य Fe2+ / Fe युग्म करेगा।
E0cell = E0cathod – E0Anode
E0cell = -0. 74 – (-2.37) = +1.63v
E0सेल का धनात्मक मान प्रदर्शित करता है कि यह अभिक्रिया होगी।
3. Br2 + 2Cl– → Cl2 + 2Br–
![]()
सेल क्रिया में Cl–, Cl2 में ऑक्सीकृत होता है अत: Cl–/ Cl2 युग्म एनोड की भाँति एवं Br2 Br– में अपचयित होता है अत: Br–/ Br2 युग्म कैथोड की भाँति कार्य करेगा।
E0cell = E0 कैथोड – E0 एनोड
E0cell = +1. 08 – (+1.36) = +0.28v
E0सेल का मान ऋणात्मक होना यह दर्शाता है कि यह अभिक्रिया नहीं होगी।
4. Fe+ Cd 2+ → Cd + Fe 2+
इसमें Fe, Fe2+ में ऑक्सीकृत होता है अत: Fe2+/ Fe एनोड और Cd2+,Cd में अपचयित होता है अतः Cd2+ / Cd युग्म कैथोड की भाँति कार्य करेगा।
![]()
E0सेल= E0 कैथोड = E0 एनोड
E0सेल = -0.44 – (-0.74) = + 0.30v
E0सेल का मान धनात्मक है अत: यह अभिक्रिया संभव है।