Students get through the MP Board Class 12th Physics Important Questions Chapter 12 परमाणु which are most likely to be asked in the exam.
MP Board Class 12th Physics Important Questions Chapter 12 परमाणु
अति लघु उत्तरीय प्रश्न
प्रश्न 1.
α – कण क्या है ?
उत्तर:
हीलियम नाभिक 2He4 को ही अल्फा कण कहते हैं।
प्रश्न 2.
संघट्ट प्राचल का मान शून्य होने पर a-कण का प्रकीर्णन कोण कितना होगा?
उत्तर:
संबंध b ∝ cot \(\frac{\theta}{2}\) में संघट्ट प्राचल b का मान शून्य होने पर,
cot\(\frac{\theta}{2}\) = 0
या \(\frac{\theta}{2}\) = 90° या θ = 180° .
प्रश्न 3.
टॉमसन के परमाणु मॉडल का एक महत्वपूर्ण निष्कर्ष लिखिए।
उत्तर:
परमाणु का द्रव्यमान तथा धनावेश सम्पूर्ण गोले में समान रूप से वितरित रहते हैं।
प्रश्न 4.
रदरफोर्ड के द्वारा परमाणु के किस महत्वपूर्ण भाग की खोज की गयी?
उत्तर:
नाभिक।
प्रश्न 5.
बोर के परमाणु मॉडल में प्रथम कक्षा की त्रिज्या r0है। दूसरी कक्षा की त्रिज्या क्या होगी?
उत्तर:
सूत्र – rn = r0n2 में n = 2 रखने पर,
r2 = r0 × 22 = 4r0
प्रश्न 6.
बोर के परमाणु मॉडल में स्थायी कक्षा किसे कहते हैं ?
उत्तर:
स्थायी कक्षा उन कक्षाओं को कहते हैं जिनमें किसी इलेक्ट्रॉन का कोणीय सांवेग \(\frac{h}{2 \pi}\) का पूर्ण
गुणक होता है।
प्रश्न 7.
बोर का क्वांटीकरण प्रतिबंध बताइए।
उत्तर:
कोणीय संवेग mνr = \(\frac{n h}{2 \pi}\), जहाँ n = 1, 2, 3, 4, ………..
![]()
प्रश्न 8.
द्वितीय कक्षा में इलेक्ट्रॉन के कोणीय संवेग के लिए क्वांटीकरण प्रतिबंध लिखिए।
उत्तर:
सूत्र – mνr = \(\frac{n h}{2 \pi}\) में, n = 2 रखने पर,
mνr = \(\frac{2 h}{2 \pi}=\frac{h}{\pi}\)
प्रश्न 9.
किसी कक्षा में इलेक्ट्रॉन की ऋणात्मक ऊर्जा का क्या महत्व है ?
उत्तर:
नाभिक और इलेक्ट्रॉन मिलकर बद्ध निकाय बनाते हैं।
प्रश्न 10.
यदि परमाणु के अन्दर इलेक्ट्रॉन स्थिर होते तो क्या होता?
उत्तर:
यदि इलेक्ट्रॉन स्थिर होते तो नाभिक के आकर्षण बल के कारण इलेक्ट्रॉन नाभिक की ओर आकर्षित होते।
प्रश्न 11.
परमाणु में नाभिक के चारों ओर इलेक्ट्रॉन परिक्रमा क्यों करते हैं ?
उत्तर:
परमाणु में नाभिक के चारों ओर इलेक्ट्रॉन के परिक्रमा करने के कारण परमाणु की रचना स्थायी होती है।
प्रश्न 12.
बोर की त्रिज्या क्या है ?
उत्तर:
हाइड्रोजन परमाणु की प्रथम कक्षा की त्रिज्या को बोर त्रिज्या कहते हैं। इसका मान 0.53 Å होता है।
प्रश्न 13.
हाइड्रोजन परमाणु के स्पेक्ट्रम में बॉमर श्रेणी की रेखा कब मिलती है ?
उत्तर:
जब इलेक्ट्रॉन उच्च ऊर्जा स्तर से दूसरे ऊर्जा स्तर में कूदते हैं।
प्रश्न 14.
किसी परमाणु के नाभिक की त्रिज्या की कोटि क्या है ?
उत्तर:
10-14 मीटर।
![]()
प्रश्न 15.
परमाणु के आकार की कोटि बताइए।
उत्तर:
10-10 मीटर।
प्रश्न 16.
निम्न में से अस्थायी कण कौन-सा है
α – कण, β – कण, प्रोटॉन, न्यूट्रॉन।
उत्तर:
न्यूट्रॉन।
लघु उत्तरीय प्रश्न
प्रश्न 1.
α – कणों के प्रकीर्णन में स्वर्णपत्र ही क्यों लिया जाता है ?
उत्तर:
α – कणा क प्रकीर्णन के लिए प्रयुक्त पत्र को एकदम पतला होना चाहिये ताकि α – कण का प्रकीर्णन एक ही टक्कर के कारण हो। इसके साथ ही साथ पत्र के नाभिक को भारी होना चाहिये ताकि α – कणों का प्रकीर्णन अधिक हो । स्वर्ण में उपर्युक्त दोनों गुण होते हैं। स्वर्ण का बारीक पत्र आसानी से बनाया जा सकता है।
प्रश्न 2.
बोर की प्रथम कक्षा में इलेक्ट्रॉन का कोणीय संवेग कितना होता है ?
उत्तर:
n वीं कक्षा में एक इलेक्ट्रॉन का कोणीय संवेग mνr = \(\frac{n h}{2 \pi}\)
n = 1 रखने पर,
प्रथम कक्षा में इलेक्ट्रॉन का कोणीय संवेग = \(\frac{h}{2 \pi}\)
प्रश्न 3.
हाइड्रोजन परमाणु में केवल एक ही इलेक्ट्रॉन है किंतु उसके उत्सर्जन स्पेक्ट्रम में कई रेखाएँ होती हैं। कारण बताइए।
उत्तर:
हाइड्रोजन के प्रकाश-स्रोत में असंख्य परमाणु होते हैं। भिन्न-भिन्न परमाणुओं में संक्रमण भिन्न-भिन्न होता है। अतः हाइड्रोजन के उत्सर्जन स्पेक्ट्रम में कई रेखाएँ होती हैं।
प्रश्न 4.
संक्रमण का क्या अर्थ है ? इसमें कितना समय लगता है ?
उत्तर:
परमाणु का एक ऊर्जा अवस्था से दूसरी ऊर्जा अवस्था में जाना संक्रमण कहलाता है। इसमें 10-8 सेकंड का समय लगता है।
प्रश्न 5.
ऊर्जा स्तर n = 5 तथा n = 1 के बीच संभव उत्सर्जन संक्रमणों की अधिकतम तथा न्यूनतम संख्या कितनी हो सकती है?
उत्तर:
अधिकतम संख्या = 10
(5 → 4,5 → 3,5 → 2,5 → 1,4 → 3,4 → 2, 4 → 1,3 → 2,3 → 1,2 → 1)
न्यूनतम संख्या = 1
(5 → 1).
प्रश्न 6.
हाइड्रोजन परमाणु को उत्तेजित करने वाले इलेक्ट्रॉन की न्यूनतम ऊर्जा कितनी हो कि हाइड्रोजन स्पेक्ट्रम में तीन स्पेक्ट्रमी रेखाएँ प्राप्त हों ?
उत्तर:
हाइड्रोजन स्पेक्ट्रम में तीन स्पेक्ट्रमी रेखाएँ प्राप्त करने के लिए आवश्यक है कि हाइड्रोजन परमाणु को उत्तेजित करने वाले इलेक्ट्रॉन की ऊर्जा इतनी हो कि वह उसको n = 1 से n = 3 तक उत्तेजित कर सके । इस स्थिति में तीन उत्सर्जन संक्रमण होंगे – 3 → 2,3 → 1 तथा 2 → 1
अतः अभीष्ट न्यूनतम ऊर्जा =E3 – E1
\(=\left[\frac{-136}{3^{2}}-\frac{-13 \cdot 6}{1^{2}}\right] \mathrm{eV}\)
= 12.1 eV.
![]()
प्रश्न 7.
नाभिकीय घनत्व, परमाणु घनत्व की अपेक्षा इतना अधिक क्यों होता है ?
द्रव्यमान
उत्तर:
हम जानते हैं कि घनत्व ![]() नाभिक के द्रव्यमान तथा परमाणु के द्रव्यमान तो लगभग समान होते हैं। किन्तु नाभिक की त्रिज्या लगभग 10-15 मीटर और परमाणु की त्रिज्या लगभग 10-10 मीटर की कोटि की होती है। अतः नाभिक का आयतन 10-45 मीटर3 और परमाणु का आयतन 10-30 मीटर3 की कोटि का होता है। इस तरह नाभिक का आयतन परमाणु के आयतन का लगभग 10-15 गुना होता है। इसी कारण नाभिक का घनत्व, परमाणु के घनत्व का लगभग 1015 गुना अधिक होता है।
नाभिक के द्रव्यमान तथा परमाणु के द्रव्यमान तो लगभग समान होते हैं। किन्तु नाभिक की त्रिज्या लगभग 10-15 मीटर और परमाणु की त्रिज्या लगभग 10-10 मीटर की कोटि की होती है। अतः नाभिक का आयतन 10-45 मीटर3 और परमाणु का आयतन 10-30 मीटर3 की कोटि का होता है। इस तरह नाभिक का आयतन परमाणु के आयतन का लगभग 10-15 गुना होता है। इसी कारण नाभिक का घनत्व, परमाणु के घनत्व का लगभग 1015 गुना अधिक होता है।
प्रश्न 8.
बोर के क्वाण्टम प्रतिबन्ध और आवृत्ति प्रतिबन्ध क्या है ?
उत्तर:
(i) अधिकतम संभव कक्षाओं में इलेक्ट्रॉन केवल उन्हीं कक्षाओं में नाभिक के चारों ओर घूम सकता है, जिनमें उसका कोणीय संवेग \(\frac{h}{2 \pi}\) का पूर्ण गुणक (Integral multiple) होता है। यहाँ पर h प्लांक
आयतन नियतांक है अर्थात् कोणीय संवेग L = mνr = \(\frac{n h}{2 \pi}\), जहाँ n = 1, 2, 3,….. इस समीकरण को बोर का क्वाण्टम प्रतिबन्ध कहते हैं। n को मुख्य क्वाण्टम संख्या कहते हैं।
(ii) यदि इलेक्ट्रॉन किसी उच्च ऊर्जा E2 की कक्षा से निम्न ऊर्जा E1 में कूदता है तो इन कक्षाओं की ऊर्जाओं में जो अंतर होता है वह विकिरण (फोटॉन) के रूप में उत्सर्जित हो जाता है अत: E2 – E1 = hυ
जहाँ पर υ उत्सर्जित विकिरण की आवृत्ति है। इस समीकरण को बोर का आवृत्ति प्रतिबंध (Bohr’s frequency condition) कहते हैं।
प्रश्न 9.
हाइड्रोजन परमाणु के प्रथम कक्षा की त्रिज्या की गणना कीजिये। सिद्ध कीजिये कि प्रथम कक्षा के इलेक्ट्रॉन का वेग प्रकाश के वेग का \(\frac{1}{137}\) वाँ गुना होता है।
उत्तर:
दिया है – n = 1, h = 6.62 x 10-34 जूल सेकंड,m = 9.1 x 10-31kg, Z = 1,e = 1.6 x 10 -19C और k =\(\frac{1}{4 \pi \varepsilon_{0}}\) = 9 x 109 Nm2C-2
हाइड्रोजन परमाणु के प्रथम कक्षा की त्रिज्या

हाइड्रोजन परमाणु के लिए n = 1
∴ ν = \(\frac{c}{137}\)
प्रश्न 10.
यदि परमाणु में इलेक्ट्रॉन स्थिर है तो क्या होगा?
उत्तर:
किसी कक्षा में इलेक्ट्रॉन का वृत्तीय मार्ग में चक्कर लगाना उस अभिकेन्द्र बल के कारण संभव होता है जो नाभिक के धनावेश और इलेक्ट्रॉनों के बीच लगने वाले स्थिर विद्युत् आकर्षण बल से संतुलित होता है। जब इलेक्ट्रॉन स्थिर हैं, तब अभिकेन्द्र बल के अभाव में इलेक्ट्रॉन स्थिर विद्युत् आकर्षण बल के कारण नाभिक में गिर जायेगा।
प्रश्न 11.
किसी कक्षा में इलेक्ट्रॉन की ऋणात्मक ऊर्जा का अर्थ स्पष्ट कीजिए ।
उत्तर:
किसी कक्षा में इलेक्ट्रॉन की कुल ऊर्जा ऋणात्मक होती है। ऋणात्मक ऊर्जा का अर्थ यह होता है कि इलेक्ट्रॉन नाभिक से बद्ध होता है। प्रथम कक्षा की ऋणात्मक ऊर्जा अधिकतम (अर्थात् ऊर्जा न्यूनतम) होती है। अतः प्रथम कक्षा के इलेक्ट्रॉन नाभिक से दृढ़तापूर्वक बद्ध होते हैं। n > 1 के लिए अर्थात् कक्षा की संख्या बढ़ने से ऋणात्मक ऊर्जा क्रमशः कम होने लगता है। अतः नाभिक के साथ इलेक्ट्रॉनों का बंधन कम होने लगता है। n = ∞ पर यह ऊर्जा शून्य हो जाती है अर्थात् अंतिम कक्षा के इलेक्ट्रॉनों की ऊर्जा शून्य अर्थात् सबसे कम होती है। अतः ये इलेक्ट्रॉन नाभिक के साथ दृढ़तापूर्वक बद्ध नहीं होते। इन्हें मुक्त इलेक्ट्रॉन कहते हैं।
प्रश्न 12.
मूलभूत नियतांकों e, me और h की सहायता से लम्बाई की विमा में राशि स्थापित कीजिये।
उत्तर:
यह राशि बोर त्रिज्या होगी। बोर त्रिज्या q0 = \(\frac{4 \pi \varepsilon_{0} \times h^{2}}{4 \pi^{2} m_{e} e^{2}}\).
प्रश्न 13.
समीकरण \(\frac{1}{\lambda}=\mathbf{R}\left(\frac{1}{n_{2}^{2}}-\frac{1}{n_{1}^{2}}\right)\) के अनुसार हाइड्रोजन परमाणु के लिए सबसे छोटा तरंगदैर्घ्य क्या होगा जो अवशोषित या उत्सर्जित होगा?
उत्तर:
सबसे छोटे तरंगदैर्घ्य के लिए दिये गये समीकरण का दायाँ पक्ष सबसे बड़ा होना चाहिए अर्थात्
जब n1 = ∞ और n2 = 1 हो,तब \(\frac{1}{\lambda}\) = R

या λ = 91.157 नैनोमीटर। .
![]()
प्रश्न 14.
यदि प्रकृति में n > 4 मुख्य क्वाण्टम संख्या के साथ वाले तत्त्व शामिल नहीं होते तो ऐसे संभव तत्त्वों की संख्या क्या होगी?
उत्तर:
मुख्य क्वाण्टम संख्या 4 तक किसी परमाणु में K, L, M और N कोश होंगें। इनमें इलेक्ट्रॉनों की अधिकतम संख्या 2n2 के अनुसार 2, 8, 18 व 32 अर्थात् इन कोशों में कुल अधिकतम इलेक्ट्रॉनों की संख्या 2 + 8 + 18 + 32 = 60 होगी अत: ऐसे कुल तत्त्वों की संख्या 60 होगी।
दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
α – कणों के प्रकीर्णन संबंधी रदरफोर्ड के प्रयोग का वर्णन कीजिए तथा प्राप्त परिणाम का महत्व बताइए।
उत्तर:
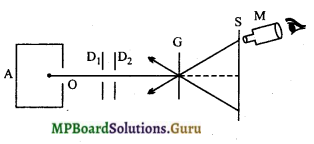
α – कणों के प्रकीर्णन सम्बन्धी रदरफोर्ड के प्रयोग का प्रायोगिक प्रबंध निम्न चित्र में प्रदर्शित किया गया है। रेडियोएक्टिव पदार्थ रेडॉन या पॉलीनियम को सीसे के बॉक्स A में रखा जाता है। इस बॉक्स के छिद्र O में से α – कण तीव्र वेग से निकतले हैं। डायफ्राम D1 और D2 में से गुजरने के बाद α – कण संकीर्ण किरण पुंज के रूप में पतली स्वर्ण पन्नी G पर आपतित होता है। स्वर्ण पन्नी की मोटाई लगभग 10-6 सेमी होती है। प्रकीर्णित α – कणों को एक पर्दे S पर डाला जाता है जिस पर जिंक सल्फाइड की तह चढ़ी होती है। α – कण इस पर्दे से टकराकर प्रस्फुरण उत्पन्न करते हैं। इस प्रस्फुरण को एक सूक्ष्मदर्शी M की सहायता से देखा जा सकता है।
प्रेक्षण –
(1) अधिकांश α – कण पन्नी को पार करके सीधे निकल जाते हैं।
(2) कुछ α – कण छोटे कोण से विक्षेपित हो जाते हैं।
(3) कुछ α – कण (1000 में से 1) 90° से अधिक कोण पर प्रकीर्णित हो जाते हैं।
(4) कुछ α – कण वापस लौट जाते हैं।
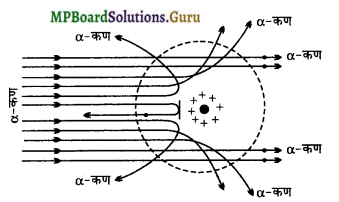
निष्कर्ष-
(1) चूँकि अधिकांश α – कण पन्नी को पारकर सीधे निकल जाते हैं, परमाणु का अधिकांश भाग खोखला होता है।
(2) धनावेशित α – कण प्रक्षेपित होते हैं । अतः परमाणु के अन्दर धनावेशित कण होना चाहिए।
(3) कुछ α – कण अधिक कोण से प्रकीर्णित होते हैं तथा कुछ α – कण वापस लौट जाते हैं। यह तभी सम्भव है जबकि सम्पूर्ण धनावेश एक ही सीमित स्थान में केन्द्रित हो।
प्रयोग का महत्व – रदरफोर्ड के प्रयोग से इस बात की जानकारी हुई कि परमाणु का सम्पूर्ण धनावेश एक ही सीमित स्थान में जिसे नाभिक कहते हैं, केन्द्रित होता है।
प्रश्न 2.
हाइड्रोजन परमाणु के प्रथम उत्तेजन अवस्था में इलेक्ट्रॉन की कुल ऊर्जा लगभग-3.4ev है। बताइये-
(i) इस अवस्था में इलेक्ट्रॉन की गतिज ऊर्जा क्या होगी?
(ii) इस अवस्था में इलेक्ट्रॉन की स्थितिज ऊर्जा क्या होगी?
(ii) यदि स्थितिज ऊर्जा के शून्य चयन को बदला जाये तो कौन से उपरोक्त उत्तर को बदलना होगा?
(NCERT)
उत्तर:
इलेक्ट्रॉन की गतिज ऊर्जा

(i) व (ii) से, PE. = – 2 K.E.
कुल ऊर्जा E = PE. + K.E.,.,.,
(i) प्रथम उत्तेजन अवस्था में गतिज ऊर्जा
K.E. = – E = -(-3.4 eV) = 3.4eV
(ii) प्रथम उत्तेजन अवस्था में स्थितिज ऊर्जा
– 2 K.E. = -2 × 3.4eV = – 6.8 eV
(iii) यदि स्थितिज ऊर्जा के शून्य को बदला जाय तो गतिज ऊर्जा नहीं बदलेगा और यह 3.4eV के समान रहेगा परन्तु निकाय की कुल ऊर्जा बदल जायेगी। क्योंकि इलेक्ट्रॉन की स्थितिज ऊर्जा बदल जायेगी।
प्रश्न 3.
सिद्ध कीजिये कि एक परमाणु कीn वीं बोर कक्षा की त्रिज्या के अनुक्रमानुपाती होता है जहाँ n2 मुख्य क्वाण्टम संख्या है।
उत्तर:
बोर के n वीं स्थायी कक्षा में इलेक्ट्रॉनों का कोणीय संवेग \(\frac{h}{2 \pi}\) का पूर्ण गुणक होता है।

चूँकि किसी दिये गये निकाय के लिए n को छोड़कर बाकी सभी राशियाँ नियतांक हैं।
अतः
r ∝ n2.
प्रश्न 4.
बॉमर श्रेणी के हाइड्रोजन परमाणु के उत्सर्जन स्पेक्ट्रम में दो रेखाएँ 4102 A और 4861A पर है। यदि उपरोक्त दोनों रेखाओं की तरंग संख्या का अंतर एक स्पेक्ट्रम रेखा के तरंग संख्या के समान है तो यह रेखा कौन-सी श्रेणी को व्यक्त करेगी? इस रेखा की तरंगदैर्घ्य क्या होगी?
मानलो n1 = 2 और n2 = x (4102 A रेखा के लिए) तथा 4861 A रेखा के लिए n1= 2 और n2 = y.
समीकरण \(\frac{1}{\lambda}=\mathrm{R}\left(\frac{1}{n_{1}^{2}}-\frac{1}{n_{2}^{2}}\right)\) में मान रखने पर,
\(\frac{1}{4102 \times 10^{-10}}\) = 1. 097 × 107\(\left(\frac{1}{2^{2}}-\frac{1}{x^{2}}\right)\) ……(1)
तथा \(\frac{.1}{4861 \times 10^{-10}}\) = 1. 097 × 107\(\frac{.1}{4861 \times 10^{-10}}\) …..(2)
समी. (1) व (2) को हल करने पर,
x = 6 और y = 4
अर्थात् जब इलेक्ट्रॉन n2 = 6 से n1 = 4 ऊर्जा स्तर में कूदते हैं या संक्रमण करते हैं तब हमें तीसरी रेखा प्राप्त होती है। जो कि ब्रैकेट श्रेणी की दूसरी संख्या है और इस स्पेक्ट्रल रेखा का तरंगदैर्घ्य
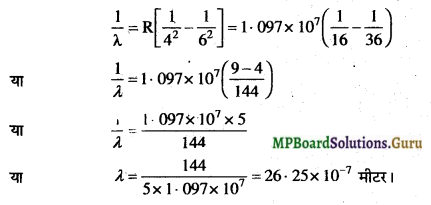
प्रश्न 5.
बोर के परमाणु मॉडल के प्रमुख अभिगृहीत लिखिए।
उत्तर:
बोर के परमाणु मॉडल के प्रमुख अभिगृहीत निम्नलिखित हैं-
(1) परमाणु का समस्त द्रव्यमान और समस्त धनावेश उसके नाभिक पर केन्द्रित रहता है।
(2) इलेक्ट्रॉनों और नाभिक के धनावेशों के मध्य लगने वाला आकर्षण बल इलेक्ट्रॉनों को वृत्तीय गति करने के लिए आवश्यक अभिकेन्द्रीय बल प्रदान करता है।
(3) इलेक्ट्रॉन नाभिक के चारों ओर सभी संभव कक्षाओं में नहीं घूमते अपितु कुछ विशिष्ट कक्षाओं में ही घूमते हैं। इन कक्षाओं को स्थायी कक्षा कहते हैं।
(4) स्थायी कक्षाएँ वे कक्षाएँ होती हैं जिनमें किसी इलेक्ट्रॉन का कोणीय संवेग \(\frac{h}{2 \pi}\)का पूर्ण गुणज होता है जहाँ h प्लांक नियतांक है (h = 6.63 × 10-34 जूल × सेकण्ड)
यदि m द्रव्यमान का इलेक्ट्रॉन r त्रिज्या की कक्षा में ν वेग से घूम रहा हो तो इसका कोणीय संवेग mνr
होगा।
∴ mνr = \(\frac{n h}{2 \pi}\)
जहाँ n = 1, 2, 3, 4, ……. n को मुख्य क्वांटक संख्या कहते हैं।
(5) स्थायी कक्षा में घूमते समय इलेक्ट्रॉन ऊर्जा का उत्सर्जन या अवशेषण नहीं करते। ऊर्जा का उत्सर्जन या अवशोषण उसी समय होता है जब वे एक कक्षा से दूसरी कक्षा में कूदते हैं।
![]()
आंकिक प्रश्न
प्रश्न 1.
हाइड्रोजन परमाणु की आयनीकरण ऊर्जा 13.6 ev है। हाइड्रोजन परमाणु पर एक फोटॉन जो प्रारंभ में मूल अवस्था में था वह n=4अवस्था में कूदता है। फोटॉन के तरंगदैर्घ्य की गणना कीजिये।
उत्तर:
हाइड्रोजन परमाणु की मूल अवस्था में ऊर्जा, E1 = -13.6eV
हाइड्रोजन परमाणु की n = 4 अवस्था में ऊर्जा E4 = \(\frac{-13 \cdot 6}{4^{2}}\) = -0.85eV
फोटॉन की ऊर्जा = E4 – E1 = -0.85 + 13.6 =12.75 eV
अत: hυ = E तथा c = υλ से, h × \(\frac{c}{\lambda}\) =E
λ = \(\frac{h c}{\mathrm{E}}=\frac{6 \cdot 62 \times 10^{-34} \times 3 \times 10^{8}}{12 \cdot 75 \times 1 \cdot 6 \times 10^{-19}}\)
λ = 975 × 10-10 मीटर = 975 Å.
प्रश्न 2.
दिये गये संघट्ट प्राचलb के लिए यदि ऊर्जा के मान में वृद्धि किया जाये तो विक्षेपण कोण बढ़ेगा या घटेगा?
(NCERT)
उत्तर:
दिये गये संघट्ट प्राचल के लिए b = \(\frac{Z e^{2} \cot (\theta / 2)}{4 \pi \varepsilon_{0} \times \frac{1}{2} m v^{2}}=\frac{Z e^{2} \cot (\theta / 2)}{4 \pi \varepsilon_{0} \times E}\)
यदि ऊर्जा के मान में वृद्धि किया जाये तो उसी अनुपात में cot(θ/2) के मान में भी वृद्धि करनी होगी अर्थात् प्रकीर्णन कोण का मान घटता जायेगा।
प्रश्न 3.
संघट्ट प्राचल b = 0 के लिए प्रकीर्णन कोण क्या होगा?
(NCERT)
उत्तर:
हम जानते हैं कि संघट प्राचल b = \(\frac{Z e^{2} \cot (\theta / 2)}{4 \pi \varepsilon_{0} \times \frac{1}{2} m v^{2}}\)
यदि b = 0, तब cot(θ/2) = 0 = cot(90°)
⇒ \(\frac{\theta}{2}\) = 90°
या θ = 180°.
प्रश्न 4.
रदरफोर्ड के प्रयोग में 90° के कोण पर प्रकीर्णित होने वाले कणों की संख्या 28 प्रति मिनट थी, तो 120° के कोण से प्रकीर्णित होने वाले कणों की संख्या ज्ञात करो।
उत्तर:
सूत्र

दिया है – θ1 = 90°,θ2 = 120° तथा N1 = 28 प्रति मिनट
उपर्युक्त सूत्र में मान रखने पर,
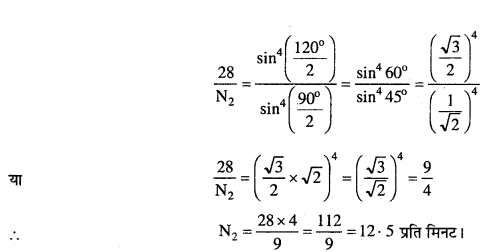
प्रश्न 5.
8 MeV ऊर्जा का α – कण चाँदी (Z = 47) के नाभिक के अधिकतम कितने निकट पहुँच सकता है?
उत्तर:
सूत्र r0 = \(\frac{1}{4 \pi \varepsilon_{0}} \cdot \frac{2 Z e^{2}}{E}\)
दिया है- \(\frac{1}{4 \pi \varepsilon_{0}}\) = 9 × 109 न्यूटन मीटर2 / कूलॉम2, Z = 47, e = 1. 6 × 10-19 कूलॉम,
E = 8 MeV = 8 × 106 × 1.6 × 10-19 जूल
सूत्र में मान रखने पर,
r0 = 9 × 109 × \(\frac{2 \times 47 \times\left(1 \cdot 6 \times 10^{-19}\right)^{2}}{8 \times 10^{6} \times 1 \cdot 6 \times 10^{-19}}\)
\(=\frac{9 \times 10^{9} \times 2 \times 47 \times 1 \cdot 6 \times 10^{-19}}{8 \times 10^{6}}\)
= 1. 69 × 10-14 मीटर।
![]()
वस्तुनिष्ठ प्रश्न
1. सही विकल्प चुनकर लिखिए
प्रश्न 1.
रदरफोर्ड परमाणु मॉडल के अनुसार परमाणु के अन्दर इलेक्ट्रॉन-
(a) स्थिर होते हैं
(b) केन्द्रीकृत होते हैं
(c) परिक्रमा करते हैं
(d) इनमें से कोई नहीं।
उत्तर:
(c) परिक्रमा करते हैं
प्रश्न 2.
परमाणु का आकार निम्न कोटि का होता है-
(a) 10-15 मीटर
(b) 10-15 सेमी
(c) 10-10 मीटर
(d) 10-10 सेमी।
उत्तर:
(c) 10-10 मीटर
प्रश्न 3.
बोर के परमाणु मॉडल के अनुसार किसी स्थायी कक्षा में इलेक्ट्रॉन की चाल νn मुख्य क्वांटम संख्या n से निम्न प्रकार संबंधित रहता है-
(a) νn = \(\frac{c}{n}\)
(b) ν = \(\frac{n}{c}\)
(c) ν = n × c
(d) \(\frac{c}{n^{2}}\)
उत्तर:
(a) νn = \(\frac{c}{n}\)
प्रश्न 4.
रिडबर्ग नियतांक के पदों में बामर श्रेणी की प्रथम स्पेक्ट्रमी रेखा की तरंग संख्या है-
(a) R
(b) 3R
(c) \(\frac{5 \mathrm{R}}{36}\)
(d) \(\frac{8 \mathrm{R}}{9}\)
उत्तर:
(c) \(\frac{5 \mathrm{R}}{36}\)
प्रश्न 5.
हाइड्रोजन परमाणु निम्नतम अवस्था से n=4 अवस्था में उत्तेजित होता है प्रेक्षित स्पेक्ट्रमी रेखाओं की संख्या होगी-
(a) 3
(b) 6
(c) 5
(d) 2.
उत्तर:
(b) 6
प्रश्न 6.
बोर त्रिज्या का मान होता है-
(a) 5.3 × 10-11 मीटर
(b) 3.5 × 10-10 मीटर
(c) 53.3 × 10-11 मीटर
(d) इनमें से कोई नहीं।
उत्तर:
(a) 5.3 × 10-11 मीटर
![]()
प्रश्न 7.
रिडबर्ग नियतांक R का मान होता है-
(a) 1.097 × 10-7 मीटर-1
(b) 1.097 × 10-8 मीटर-1
(c) 1.097 × 108 मीटर-1
(d) 1.097 × 107 मीटर-1
उत्तर:
(d) 1.097 × 107 मीटर-1
प्रश्न 8.
बोर मॉडल के अनुसार प्रथम कक्षा में इलेक्ट्रॉन की चाल होती है-
(a) \(\frac{137}{c}\)
(b) 137 × c
(c) 137 + c
(d) \(\frac{c}{137}\)
उत्तर:
(d) \(\frac{c}{137}\)
2. रिक्त स्थानों की पूर्ति कीजिए
1. अल्फा कण के गाइगर-मार्सडन प्रयोग में प्रयुक्त अल्फा कण की ऊर्जा ………………… थी।
उत्तर:
5.5 MeV
2. रदरफोर्ड मॉडल के अनुसार इलेक्ट्रॉन की कुल ऊर्जा ………………… होती है। (धनात्मक/ऋणात्मक)
उत्तर:
ऋणात्मक
3. हाइड्रोजन के दृश्य भाग में स्पेक्ट्रमी श्रेणी में सर्वप्रथम ………………… ने देखा था।
उत्तर:
बॉमर
4. रिडबर्ग नियतांक R का मान ……………… होता है।
उत्तर:
1.097 × 107 मीटर -1
5. इलेक्ट्रॉन नाभिक के चारों ओर उन कक्षाओं में ही परिक्रमण करता है। जिनके लिए कोणीय संवेग का मान ……………… का पूर्ण गुणक होता है।
उत्तर:
\(\frac{h}{2 \pi}\)
![]()
6. हाइड्रोजन परमाणु की आयनन ऊर्जा ………………… होती है।
उत्तर:
13.6eV
7. हाइड्रोजन परमाणु की प्रथम उत्तेजित अवस्था में इलेक्ट्रॉन की कुल ऊर्जा लगभग ………………… ev होती है।
उत्तर:
-3.4eV
3. उचित संबंध जोड़िए
| स्तम्भ ‘अ’ | स्तम्भ ‘ ब’ |
| 1. बोर त्रिज्या | (a) \(\frac{-m e^{4}}{8 n^{2} \varepsilon_{0}^{2} h^{2}}\) |
| 2. En | (b) \(\frac{e^{2}}{2 \varepsilon_{0} n h}\) |
| 3. रिडबर्ग नियतांक | (c) \(\frac{n h}{2 \pi}\) |
| 4. νn | (d) \(\frac{m e^{4}}{8 \varepsilon_{0}^{2} c h^{3}}\) |
| 5. कोणीय संवेग | (e) \(\frac{h^{2} \varepsilon_{0}}{\pi m e^{2}}\) |
उत्तर:
1. (e) \(\frac{h^{2} \varepsilon_{0}}{\pi m e^{2}}\)
2. (a) \(\frac{-m e^{4}}{8 n^{2} \varepsilon_{0}^{2} h^{2}}\)
3. (d) \(\frac{m e^{4}}{8 \varepsilon_{0}^{2} c h^{3}}\)
4. (b) \(\frac{e^{2}}{2 \varepsilon_{0} n h}\)
5. (c) \(\frac{n h}{2 \pi}\)